在体单向肠灌流模型检验大豆皂苷苷元的肠吸收特性
2021-06-18潘承慧齐东月赵大云
潘承慧,齐东月,赵大云
(上海交通大学农业与生物学院,上海 200240)
大豆皂苷(Soyasaponin)是由非极性的苷元(Soyasapogenol)和极性的低聚糖链组成,主要来源于豆类植物[1-2]。根据苷元结构,一般将大豆皂苷分为A类、B类、C类、E类和DDMP类[3]。目前大豆皂苷的性质、功能以及应用的研究以A类和B类为主[4-8]。大豆皂苷具有降血脂[9]、降血压[10]、减少肝细胞损伤[11]、抑制癌细胞增殖[12]以及抗氧化抗炎[13]等多种生理功能。活性成分在体内的生物利用度对其功效发挥具有重要意义[14-15]。体内外代谢研究表明,大豆皂苷在体内无法直接被吸收,而是进一步降解为苷元发挥功效,且口服生物利用度不理想[16-18]。
肠道是消化吸收的主要部位,研究功能性食品及药物的肠道吸收特性,可指导选择适宜的制剂方式,从而提高制剂的生物利用度。肠吸收的研究方法包括离体外翻肠囊模型、Caco-2细胞模型、在体循环肠灌流和在体单向肠灌流模型[19-22]。在体单向肠灌流模型因简单、易操作,实验条件与实际肠道内环境接近,国内外广泛应用该技术于研究各种化学药物的吸收行为,在中药及功能食品研究中也日益普及,成为预测活性成分在体内吸收特征的重要手段[23-24]。当前,苷元在肠道的吸收、分布、代谢和排泄等规律研究尚未见报道,而吸收是苷元可利用的关键阶段,直接影响其生理功效作用[25]。因此,研究苷元在肠道的吸收特征对提高其在实际应用中的附加值具有关键的指导意义。
本研究以大豆皂苷元A和B为研究对象,建立了大豆皂苷元A和B的HPLC分析方法和可靠的在体单向肠灌流模型,并通过该模型考察了肠段、苷元剂量和胆汁等因素对其在大鼠肠道的表观渗透系数和吸收速率常数的影响,以阐明苷元在小肠中的吸收特征和吸收机制,为其在食品和制药行业的应用提供理论依据。
1 材料与方法
1.1 材料与仪器
大豆皂苷苷元A和B样品 纯度>98%,由实验室制备[26];大豆皂苷苷元A标准品(批号:79086525)、大豆皂苷苷元B标准品(批号:SLCC1104) 纯度>98%,戊巴比妥钠 分析纯,美国Sigma公司;生理盐水 山东康宁药业有限公司;Krebs-Ringer缓冲液 北京雷根生物技术有限公司;其他有机试剂 均为分析纯,上海凌锋化学试剂有限公司;雄性Sprague-Dawley(SD)大鼠(6~8周龄,共24只)体质量(250±20) g,北京维通利华有限公司,经上海交通大学实验动物伦理与使用委员会批准(IACUC),批准号:A2019086,饲养在12 h光照12 h黑暗循环条件下,室温保持24 ℃,饲喂不含大豆制品的饲料,适应性喂养一周后开始实验。
HL-1S型恒流泵 上海青浦沪西仪器厂;R-300型超高效液相色谱仪(UPLC-PDA-ELSD) 美国Waters公司;DM 4000型光学显微镜 德国Leica公司;Sirion型高分辨场发射扫描电子显微镜 美国FEI公司;Tecnai G2型生物型透射电镜美国Thermoscientific公司。
1.2 实验方法
1.2.1 溶液配制
1.2.1.1 大豆皂苷苷元标准液的配制 准确称取大豆皂苷苷元A和B标准品1.00 mg,分别用甲醇定容至10 mL容量瓶中,配制成100 μg/mL的母液,置于4 ℃冰箱中保存,备用。
1.2.1.2 大豆皂苷苷元灌流液的配制 准确称取适量大豆皂苷苷元A和B,溶解于Krebs-Ringer缓冲液,配制成10 mg/L(低剂量)和50 mg/L(高剂量)的灌流液。空白灌流液为Krebs-Ringer缓冲液。
1.2.2 液相色谱条件及方法学考察
1.2.2.1 色谱条件 色谱柱:Inertsil ODS C18柱 (i.d.250 mm×4.6 mm,5 μm),进样体积:10 μL,柱温:25 ℃,流 动 相:乙 腈-正 丙 醇-水-乙 酸(80:6:13.9:0.1,v:v:v:v),流速:0.9 mL/min,等度洗脱;紫外检测范围200~600 nm,检测波长205 nm;蒸发光检测器参数:漂移管温度52 ℃,增益值1,气体压力35 psi。
1.2.2.2 专属性考察 分别吸取空白灌流液、大豆皂苷苷元标准液和灌流液适量进行液相检测,得到色谱图,考察该色谱方法的专属性。
1.2.2.3 标准曲线制作 精密吸取大豆皂苷苷元标准母液(100 μg/mL)适量,制备系列浓度标准液,分别为10、20、30、40、50、70、100 μg/mL,精密吸取各浓度标准液10 μL进行色谱测定,得到苷元A和B的峰面积。以苷元质量浓度为横坐标(X),峰面积为纵坐标(Y),绘制双对数坐标,并进行线性回归,计算苷元A和B的标准曲线方程。
1.2.2.4 精密度考察 分别吸取浓度为20、50和100 μg/mL的大豆皂苷苷元标准液进样测定,每个浓度日内间隔测定5次,连续测定5 d,得到苷元A和B的峰面积,计算其含量,考察该方法日内和日间精密度。
1.2.2.5 回收率考察 分别精密吸取浓度为20、50和100 μg/mL的大豆皂苷苷元标准液,进样检测,得到峰面积代入标准曲线方程计算其实测质量浓度,以实测浓度与配制浓度的比值计算该方法的回收率。
1.2.2.6 稳定性考察 取浓度为10 mg/L的大豆皂苷苷元灌流液,置于37 ℃恒温水浴,分别测定0、30、60、90、120 min时间点下苷元A和B的峰面积,计算其浓度,并与0 min时测得的浓度作百分比,考察灌流液在试验过程中的稳定性。
1.2.3 大鼠在体单向肠灌流实验 实验前,将SD大鼠禁食12 h,自由饮水。腹腔注射1%戊巴比妥钠(40 mg/kg)进行麻醉,麻醉后置于电热垫,保持体温37 ℃,并将背位固定于手术台上。沿腹中线剪开腹腔部位,切口为3~4 cm,确定四个肠段部位:十二指肠段在距幽门1 cm处开始向下取5 cm,空肠肠段在距十二指肠出口端4 cm处开始向下取5 cm,回肠肠段在距和盲肠连接处上端2 cm处开始向上取5 cm,结肠肠段在距和盲肠连接处开始向下取10 cm。四个肠段两端切口插管并用手术线结扎,用37 ℃生理盐水缓慢将肠内容物冲洗干净,排空生理盐水后,连接恒流泵,先用Krebs-Ringer缓冲液(提前37 ℃预热)以0.2 mL/min 的流速平衡各肠段30 min,再切换为大豆皂苷苷元灌流液开始试验,分别在15、30、45、60、75、90、105、120 min时间点收集流出液于已知质量离心管中,灌流期间用浸湿生理盐水的棉布覆盖腹腔,保持湿润,间断给予1%戊巴比妥钠维持麻醉状态。实验结束后,再次称取收集后的离心管质量,剪取各灌流肠段部位,分别测量内径及长度。
1.2.4 大鼠小肠形态学变化实验 验证大鼠在体单向肠灌流模型的可靠性,采用50 mg/L苷元灌流液,在有胆汁情况下按1.2.3灌流操作,分别取灌流前(0 h)、灌流2和4 h的大鼠肠段1 cm,生理盐水清洗除去表面杂垢后,立即投入预先配好的固定液中保存24 h后,进行形态学观察。
1.2.4.1 光学显微镜 将切下的空肠段投入预先配好的4%多聚甲醛溶液保存过夜,经脱水、石蜡包埋、切片(厚度3 μm)以及HE染色,光学显微镜低倍镜下观察切片并测量空肠壁厚度、粘膜厚度、皱襞高度、皱襞表面积,平行测定5次,计算其平均值。
1.2.4.2 扫描电镜 将切下的空肠段投入预先装有2.5%戊二醛固定液的小瓶固定过夜,脱水程序如下:0.1 mol/L PBS缓冲液漂洗,10 min×4次;用1%四氧化锇0.2 mL二次固定2 h;再次用0.1 mol/L PBS缓冲液漂洗,10 min×4次;用50%、70%、90%乙醇清洗15 min;最后用90%乙醇:90%丙酮(1:1)和90%丙酮各脱水20 min。将样品放进CO2干燥机进行临界干燥3 h,干燥后喷金,进行扫描电镜观察。
1.2.4.3 透射电镜 将切下的空肠段投入预先装有2.5%戊二醛固定液的小瓶固定过夜,按照1.2.3.2脱水程序处理方法,再用100%丙酮进一步脱水,15 min×3次;丙酮:环氧树脂(1:1)0.5 mL浸泡1 h,再用丙酮:环氧树脂(1:2)0.5 mL浸泡过夜;用环氧树脂0.4 mL置换,4 h×2次,经树脂包埋后在60 ℃烘箱里聚合48 h,取出进行超薄切片(大小1 mm3),最后用醋酸铀和柠檬酸铅染色,进行透射电镜观察。
1.2.5 苷元肠吸收特性的单因素影响实验 探究不同因素对大豆皂苷苷元在肠道的吸收影响,将大鼠分为低剂量组和高剂量组(10 、50 mg/L,有胆汁)、有胆汁组和无胆汁组(不结扎胆管,结扎胆管,50 mg/L),分别考察不同肠段、剂量和胆汁对大豆皂苷苷元灌流液在大鼠小肠的吸收能力。
1.2.6 灌流液样品HPLC测定 准确吸取灌流液样品200 μL,置于1.5 mL离心管,再加入800 μL内标液,涡旋混匀1 min后,12000 r/min下离心10 min,取上清液,50 ℃水浴加热氮吹至干后,加入100 μL甲醇溶解,经0.22 μm微孔滤膜过滤,取滤液进行色谱分析,得到灌流液中苷元浓度,并计算苷元在体的吸收速率常数Ka(s-1)和表观渗透系数Papp(cm/s)。
采用重量法,校正因肠内水分吸收引起的灌流液质量变化。吸收速率常数Ka(s-1)、表观渗透系数Papp(cm/s)计算公式如下:
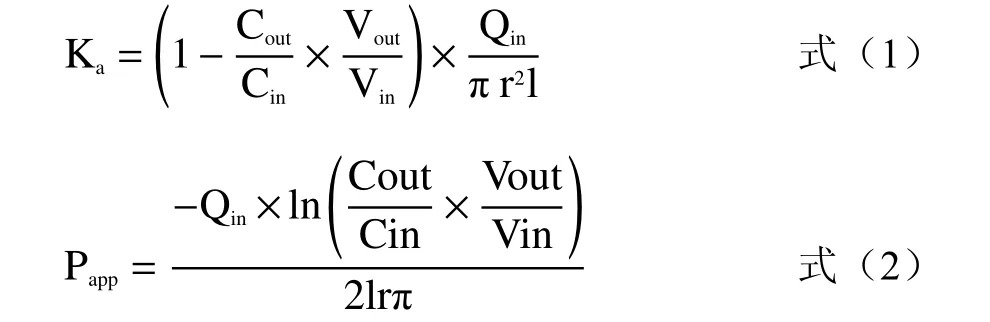
式中:Cin和Cout分别表示肠道进口灌流液和出口收集液的样品浓度,mg/L;Vin和Vout分别表示肠道进口灌流液和出口收集液的样品体积,mL;Qin表示灌流速度,0.2 mL/min;r表示灌流肠段的内径,cm;l表示灌流肠段的长度,cm。
1.3 数据处理
采用Origin软件进行绘图,采用SPSS 24.0软件系统进行方差分析,结果以表示,采用Tukey HSD检验组间显著性,P<0.05表示差异显著。
2 结果与分析
2.1 方法学考察
HPLC色谱参考Rupasinghe等[27]的方法,分别将空白灌流液、大豆皂苷苷元标准液和灌流液进行检测,结果如图1所示。空白灌流液中的物质在4.11 min洗脱出来,而苷元A和B的保留时间分别为8.34和12.45 min,且分离度较好,无其他物质干扰,说明此色谱方法适于两种苷元及其灌流液的分析。

图1 大豆皂苷苷元标准液及灌流液的HPLC色谱图Fig.1 HPLC chromatograms of soyasapogneols standard and intestinal liquid
蒸发光散射检测器信号与峰面积的关系符合Y=aXb,两者的对数呈线性关系[28]。对检测得到的系列浓度苷元峰面积和对应的标准液浓度取对数,经线性回归计算,得到苷元A的标准曲线方程为:Y=0.062X1.610(R2=0.9997),苷元B的标准曲线为:Y=0.225X1.466(R2=0.9994),说明苷元A和B在浓度范围10~100 μg/mL内拟合度较好。苷元A和B的检测限(LOD,S/N=3)分别为4.06和2.17 μg/mL,定量限(LOQ,S/N=10)为10.81和5.77 μg/mL。
大豆皂苷苷元的精密度、回收率和稳定性结果如表1所示。在20、50、100 μg/mL浓度时,苷元A和B的日内和日间精密度RSD(n=5)均小于9%,苷元A提取回收率在98.42%~103.43%,RSD小于6%,苷元B提取回收率在94.56%~104.32%,RSD小于7%,说明此HPLC条件下的精密度良好,回收率符合苷元的检测要求。苷元A和B在37 ℃水浴不同时间点测得的浓度百分比RSD分别为3.23%和4.56%,表明苷元在37 ℃水浴时热稳定性良好。
2.2 大鼠空肠的形态学变化
选取空肠段,考察灌流前(0 h)、灌流2和4 h时的形态学变化,光镜测量空肠各结构的结果见表2,扫描电镜和透射电镜观察结果见图2。
由表2可知,随着灌流时间的增长,空肠肠壁厚度、粘膜厚度减小,皱襞高度以及表面积都呈现降低的趋势,灌流2 h组参数分别为646.42、524.57、391.93 μm和63930.46 μm2,空肠肠壁厚度、皱襞表面积与灌流前差异不显著(P>0.05),其他差异显著;而灌流4 h组显著减少(P<0.05),这说明,此实验采用的单向在体灌流模型在2 h内肠壁受到的机械损伤程度较低,从而更好地减小实验误差,测得的吸收参数可靠。
扫描电镜观察灌流内壁结果发现,灌流前大鼠空肠皱襞表面光滑,腺体大小一致,呈有序排列,隐凹结构明显;受灌流机械作用,皱襞表面易出现破裂,灌流2 h组有轻微裂口,隐凹深度变浅;灌流4 h组破裂程度加重,粘膜内物质有溶出现象,隐凹结构难以观察。
透射电镜观察内部细胞结构发现,灌流前大鼠空肠粘膜杯状细胞数量多,排列整齐;随着灌流时间的延长,粘膜杯状细胞和上皮吸收细胞数量减少,灌流2 h组细胞结构保留相对完整,灌流4 h组细胞结构破坏严重,细胞膜破裂,细胞器分散明显。
从空肠表观和内部形态观察结果来看,由于灌流的机械作用,大鼠肠道存在不同程度的损伤,且灌流时间越长,损伤越严重,为保证苷元肠吸收实验的可靠性,选择灌流2 h为实验时长。
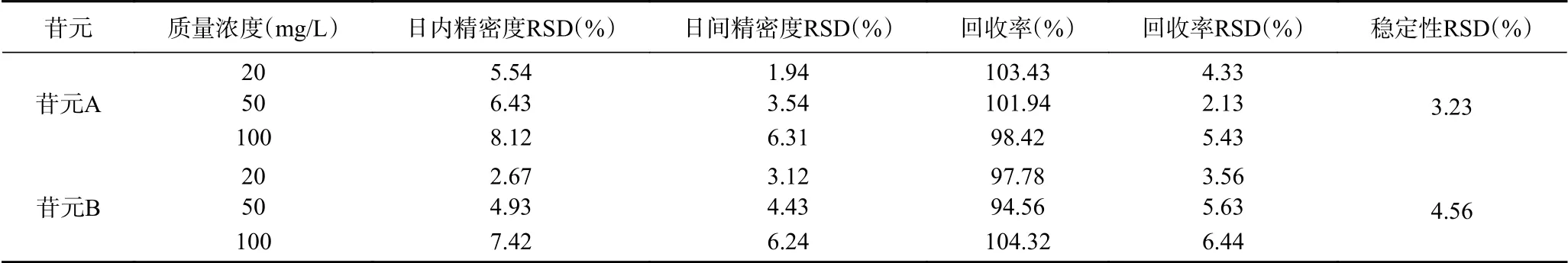
表1 大豆皂苷苷元HPLC的精密度、回收率和稳定性考察(n=5)Table 1 Accuracy, recovery and stability of soyasapogenol by HPLC (n=5)

表2 空肠结构形态学变化Table 2 Morphological changes of jejunum structure

图2 扫描和透射电镜下空肠形态学变化Fig.2 Morphological changes of jejunum by scanning and transmission electron microscope
2.3 不同因素对大豆皂苷苷元A和B肠吸收特性的影响
2.3.1 不同肠段对肠吸收的影响 50 mg/L下苷元A和B在不同肠段的表观渗透系数Papp及吸收速率常数Ka结果如表3所示。
大鼠肠道包括十二指肠、空肠、回肠和结肠,各部小肠绒毛和粘膜皱襞结构存在差异,因此,成分在不同肠道的吸收具有部位特异性。苷元A在不同肠段的表观渗透系数Papp大小为:空肠>十二指肠>回肠>结肠,空肠渗透系数最高,50 mg/L剂量时为15.34×10-5cm/s,是十二指肠的1.64倍、回肠的2.75倍、结肠的4.10倍,显著优于其他肠段(P<0.05);吸收速率常数Ka大小为:空肠>十二指肠>回肠>结肠,空肠与十二指肠吸收能力接近,50 mg/L剂量时分别为3.06×10-5、2.74×10-5s-1,无显著差异(P>0.05)。苷元B在不同肠段的渗透和吸收情况与苷元A相似,均为空肠优于十二指肠、回肠、结肠,但渗透和吸收参数低于苷元A。苷元A和B在各肠段均存在吸收,且空肠段吸收效果最优,可考虑将其制为空肠特定部位靶向制剂[29]。
2.3.2 不同剂量对肠吸收的影响 从表3来看,大豆皂苷苷元A高剂量组的表观渗透系数Papp和吸收速率常数Ka均高于低剂量组,在空肠段高剂量组的渗透和吸收能力是低剂量组的1.54、1.15倍,有显著性差异(P<0.05),说明苷元A在肠道的吸收存在浓度依赖性,吸收机制为被动扩散[30]。空肠段苷元B高、低剂量组的表观渗透系数Papp分别为6.32×10-5、11.36×10-5cm/s,差异明显(P<0.05),而吸收速率常数Ka分别为2.42×10-5、2.74×10-5s-1,无显著性差异(P>0.05)。
2.3.3 胆汁对肠吸收的影响 如表4可知,苷元A和B有胆汁组在十二指肠部位的表观渗透系数Papp分别为9.76×10-5、3.77×10-5cm/s,在空肠部位分别为16.56×10-5、12.01×10-5cm/s,在十二指肠部位吸收速率常数Ka分别为3.96×10-5、1.82×10-5s-1,在空肠部位分别为3.06×10-5、2.97×10-5s-1,均显著高于无胆汁组(P<0.05),说明胆汁的分泌对苷元吸收具有特殊吸收机制,苷元在体内吸收形式为肠肝循环,胆汁中的胆汁酸对苷元在小肠部位的消化吸收具有促进作用[31]。胆汁在回肠段和结肠段的促进效果不明显,说明胆汁主要作用部位于肠部上端。
表3 各剂量对大豆皂苷苷元在各肠段Papp和Ka的影响(D,n=4)Table 3 Effect of concentration on soyasapogenol absorptivity at different intestines ( D, n=4)

表3 各剂量对大豆皂苷苷元在各肠段Papp和Ka的影响(D,n=4)Table 3 Effect of concentration on soyasapogenol absorptivity at different intestines ( D, n=4)
注:不同字母表示表观渗透系数Papp和吸收速率常数Ka的高低剂量组间显著差异,P<0.05。
苷元 剂量 吸收参数 十二指肠 空肠 回肠 结肠苷元A 10 mg/L(低) Papp*10-5(cm/s) 4.81±1.08b 9.99±2.71b 3.01±1.23b 2.70±0.15b Ka*10-5(s-1) 2.61±0.31b 2.66±0.14a 3.41±0.23a 0.70±0.01a 50 mg/L(高) Papp*10-5(cm/s) 9.37±0.95a 15.34±0.60a 5.58±0.70a 3.74±0.38a Ka*10-5(s-1) 3.05±0.09a 3.06±0.13b 2.51±0.09b 0.72±0.01a 10 mg/L(低) Papp*10-5(cm/s) 2.63±0.03b 6.32±1.14b 1.90±0.58b 1.38±±0.35b Ka*10-5(s-1) 2.03±0.16a 2.42±0.23a 1.38±0.35a 0.48±0.08a 50 mg/L(高) Papp*10-5(cm/s) 3.77±1.51a 11.36±0.70a 3.18±0.66a 1.64±0.27a Ka*10-5(s-1) 2.34±0.33a 2.74±0.02a 1.59±0.24a 0.55±0.05a苷元B
表4 有无胆汁对大豆皂苷苷元在各肠段Papp和Ka的影响(D,n=4)Table 4 Effect of bile on soyasapogenol absorptivity at different Intestines (D, n=4)
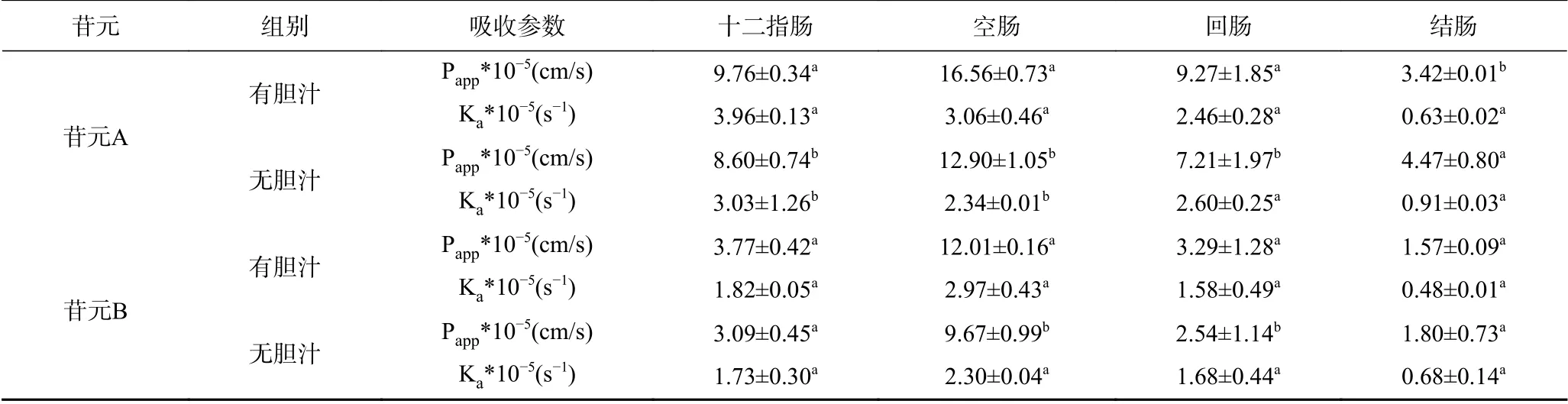
表4 有无胆汁对大豆皂苷苷元在各肠段Papp和Ka的影响(D,n=4)Table 4 Effect of bile on soyasapogenol absorptivity at different Intestines (D, n=4)
注:不同字母表示表观渗透系数Papp和吸收速率常数Ka的有无胆汁组间显著差异,P<0.05。
苷元 组别 吸收参数 十二指肠 空肠 回肠 结肠苷元A有胆汁 Papp*10-5(cm/s) 9.76±0.34a 16.56±0.73a 9.27±1.85a 3.42±0.01b Ka*10-5(s-1) 3.96±0.13a 3.06±0.46a 2.46±0.28a 0.63±0.02a无胆汁 Papp*10-5(cm/s) 8.60±0.74b 12.90±1.05b 7.21±1.97b 4.47±0.80a Ka*10-5(s-1) 3.03±1.26b 2.34±0.01b 2.60±0.25a 0.91±0.03a有胆汁 Papp*10-5(cm/s) 3.77±0.42a 12.01±0.16a 3.29±1.28a 1.57±0.09a Ka*10-5(s-1) 1.82±0.05a 2.97±0.43a 1.58±0.49a 0.48±0.01a无胆汁 Papp*10-5(cm/s) 3.09±0.45a 9.67±0.99b 2.54±1.14b 1.80±0.73a Ka*10-5(s-1) 1.73±0.30a 2.30±0.04a 1.68±0.44a 0.68±0.14a苷元B
3 结论
形态学研究显示,大鼠空肠的结构在灌流2 h和灌流前无显著差异,表明在体单向肠灌流模型在实验期间保持良好的肠道环境,通过该模型评估大豆皂苷苷元A和B时可行的。在体肠吸收结果表明,大豆皂苷苷元A和B在不同肠段的吸收能力为:空肠>十二指肠>回肠>结肠,主要吸收部位为空肠,提示在开发苷元制剂时,可考虑空肠特定靶向产品,以提高苷元的生物利用度;苷元A的在体肠渗透和吸收能力均具有显著的浓度依赖性,推测其吸收机制为被动扩散;而苷元B渗透参数随浓度变化明显,吸收情况的浓度依赖性不显著,提示苷元B的吸收机制不是简单的被动扩散,可能还存在跨膜、载体蛋白等多种形式的结合方式;内源物胆汁对苷元A和B的吸收起促进作用,且主要作用于肠部上端。本研究为苷元以后的深度开发利用提供了科学依据。
