鹿鞭醇提物对秀丽隐杆线虫衰老的影响
2021-06-18迟东泽刘芳芳
迟东泽,何 源,刘芳芳,张 晶,
(1.吉林农业大学中药材学院,吉林长春 130118;2.长春科技学院医药学院,吉林长春 130600)
衰老是指随着年龄增长,机体功能逐渐下降的过程,可导致多种慢性类疾病,如阿尔茨海默证、癌症、糖尿病和心血管疾病[1]。中医理论认为肾精不足、气血亏虚是导致衰老的主要原因[2],而传统的补益类中药具有补气、补血、滋阴、壮阳等功效,灵芝水提物[3]、玛咖醇提物[4]等均具有较强的抗衰老活性。
秀丽隐杆线虫是首个具有完成基因组测序的动物,60%~80%与人类基因具有同源性似,其行为和生理指标变化与人类较为相似,被广泛应用于生物活性化合物的抗衰老作用研究[5]。
中药鹿鞭(Penis et Testis Cervi)又称鹿肾、鹿冲,为鹿科动物梅花鹿(Cervus nipponTemmink)或马鹿(CelaphusLinnaeus)干燥带睾丸的阴茎[6],为传统补益类中药,其化学成分主要包括核苷类、氨基酸类、脂肪酸类、糖类、甾体类、无机元素、多胺类、磷脂类[7]。现代研究表明,鹿鞭中性激素可提高肾阳虚不育症大鼠睾酮水平、对大鼠生精功能起到调节作用[8]。鹿鞭活性肽具有抑制硫代巴比妥酸反应(TBARS)、增强还原能力、提高DPPH自由基清除率的功效[9]。鹿鞭乙醇提取物可延长小鼠负重游泳时间,降低运动后小鼠尿素氮(BUN)、血乳酸(BLA)和丙二醛(MDA)水平,提高小鼠抗疲劳能力[7]。然而,关于鹿鞭抗衰老活性研究未见报道,因此本文以秀丽隐杆线虫衰老为模型,通过测定线虫寿命、吐咽、生殖能力、运动能力、热应激、氧化应激、体内抗氧化酶活力等指标,研究鹿鞭醇提物的抗衰老活性及可能机制,并比较了梅花鹿鞭和马鹿鞭活性,以期为鹿鞭药材的开发利用提供参考。
1 材料与方法
1.1 材料与仪器
梅花鹿鹿鞭、马鹿鞭 分别购于吉林双阳西丰鹿场和新疆本草堂有限公司,由张晶教授鉴定为新疆马鹿鞭(CelaphusLinnaeus)和梅花鹿鞭(Cervus nipponTemmink),两种鹿鞭粉碎后过100目筛,粉末存于-80 ℃,待用;野生型秀丽隐杆线虫(Caenorhabditis.elegans)N2型 由吉林农业大学人参工程创新研究中心提供;胆固醇、琼脂粉、蛋白胨
国药试剂有限公司;百草枯 美国Sigma公司;OP50菌种 北京三药公司;磷酸二氢钾、磷酸氢二钠 分析纯,天津福晨试剂公司;氯化钠、硫酸镁、氢氧化钠、次氯酸 分析纯,上海国药试剂公司;活性氧ROS试剂盒、ELISA试剂盒 上海碧云天生物技术有限公司。
BS-250生化培养箱 上海博讯实业有限公司医疗设备厂;Thermo FisherST16R高速离心机 昊诺斯科技有限公司;PL303 电子分析天平 梅特勒托利多仪器有限公司;RS-232C MK3酶标仪 Thermo Labsystems公司;KQ5200DB超声波清洗器 昆山市超声仪器有限公司;Olympus-BX41奥林巴斯显微镜 奥林巴斯公司;IX71IX71倒置荧光显微镜 日本OLYMPUS公司。
1.2 实验方法
1.2.1 鹿鞭醇提物的制备 精密称取梅花鹿鞭和马鹿鞭样品粉末15.000 g,加入80%乙醇150 mL超声提取(功率250 W,频率33 kHz,温度50 ℃)3次[7],每次1 h,合并提取液,浓缩至干,得花鹿鞭醇提物(HC)马鹿鞭醇提物(MC),待用。
1.2.2 培养基的制备 NGM培养基配制:准确称取NaCl 1.50 g、琼脂粉8.50 g、胰蛋白胨1.25 g、5.0 mg/mL胆固醇乙醇溶液500 μL,水定容至500 mL,高压灭菌15 min,室温冷却至55 ℃,加入500 μL 1 mol/L CaCl2、500 μL 1 mol/L MgSO4、12.5 mL 1 mol/L PBS缓冲液,混匀后倒入培养皿中。
1.2.3 线虫的培养及同步化 线虫培养:将线虫接种于含OP50的NGM培养基,20 ℃恒温培养。线虫同步化:采用高氯酸钠裂解法[10],M9缓冲液将线虫从NGM上冲下,置于EP管中静置1 min,弃掉上清液,加入一定量的M9缓冲液,再加入等体积的裂解液(NaClO:NaOH=1:1),震荡约3 min,5500 r/min离心30 s,弃掉上清液,加入1 mL M9缓冲液吹散,离心,重复3次后,沉淀即为线虫卵,置于NGM培养皿上,20 ℃培养。将同步化后的秀丽隐杆线虫转移到含有大肠杆菌OP50的培养基中,空白组滴加蒸馏水,各剂量组分别加入0.5 mg/mL(低剂量组)、1.0 mg/mL(中剂量组)、2.0 mg/mL(高剂量组)鹿鞭醇提物,20 ℃培养。
1.2.4 寿命测定 将L4期线虫分别转移各组NGM培养皿中20 ℃培养。每组3个平行,每个培养皿约33条线虫。从线虫孵化开始记为第0 d,每天转移至新培养皿中,到生殖后期(通常为第5 d)后,每48 h线虫移至新培养皿,每天观察线虫,记录线虫生存、死亡数量[11]。
1.2.5 吐咽能力测定 取L4期线虫于各组培养皿,显微镜下观察其1 min内的吐咽次数,并进行统计,每日转板[12]。
1.2.6 生殖能力测定 每个培养皿2条L4期线虫,各剂量组分别5个平行。每天将线虫移至新培养皿,至线虫基本不再产卵,记录产卵总数,计算各剂量每条线虫产卵量的平均值[13]。
1.2.7 秀丽隐杆线虫急性热应激和氧化应激实验
1.2.7.1 急性热应激实验 采用L4期线虫按“1.2.3”方法进行分组给药后,于20 ℃培养48 h,将培养温度调至35 ℃,此时设为0 h。每组3个平行,每个培养皿约33条线虫。每2 h挑出死亡线虫后继续培养,至全部死亡[14]。
1.2.7.2 氧化损伤实验 将同期化线虫移至相应培养皿中,20 ℃培养48 h(每日转板)后,转移至10 mmoL/L百草枯平板上,建立氧化损伤模型。每组3个平行,每个培养皿约33条线虫。每天统计线虫数量,计算其存活率(存活率(%)=存活条数/总条数×100)[15]。
1.2.8 运动能力测定 在寿命实验的第4、8、12 d观察并记录线虫的运动情况。记录标准:A型:线虫自发运动,不需要触碰刺激;B型:线虫必须受到触碰刺激才运动;C型:线虫受到触碰刺激后只摆动头或尾[16]。
1.2.9 ROS水平测定 将L4期线虫移至含10 mmoL/mL百草枯各培养皿中,20 ℃培养48 h(每日转板),将其转移至浓度为100 μmoL/L H2DCFDA缓冲液中,20 ℃孵育40 min,观察荧光强度(λex=485 nm,λem=528 nm[17]。
1.3 抗氧化酶活力及MDA含量测定
将同期化L4期线虫转移至各培养皿中,培养48 h后,用M9缓冲液冲将线虫冲至离心管。生理盐水洗涤并于液氮中反复冻融3次,离心取上清液用ELISA试剂盒测定SOD、CAT活力及MDA水平[18]。
1.4 统计分析
实验数据以X±SD表示,采用prism8软件作图,SPSS 23.0软件进行数据处理。
2 结果与分析
2.1 鹿鞭提取物对寿命的影响
2种鹿鞭醇提物对线虫寿命影响(图1、表1)结果显示,HC的各剂量组(0.5、1、2 mg/mL)可显著提高线虫寿命且呈浓度依赖性,与空白组相比,平均寿命分别分别提高17.06%、20.08%、35.82%;中位寿命分别提高约2.29、3.23、4.39 d;最大寿命分别提高约2.98、4.55、5.58 d。与空白组相比,MC组中不同浓度醇提物平均寿命分别提高13.39%、17.33%、23.52%;中位寿命分别提高约0.9、2.85、3.3 d;最大寿命分别提高约2.93、3.96、5 d。HC和MC组在0.5、1.0 mg/mL水平,线虫寿命值与空白组相比均具有显著差异(P<0.05),浓度为2.0 mg/mL水平具有极显著差异(P<0.01)。2种鹿鞭均可延长线虫寿命,在同一剂量水平,HC对线虫寿命的影响大于MC。
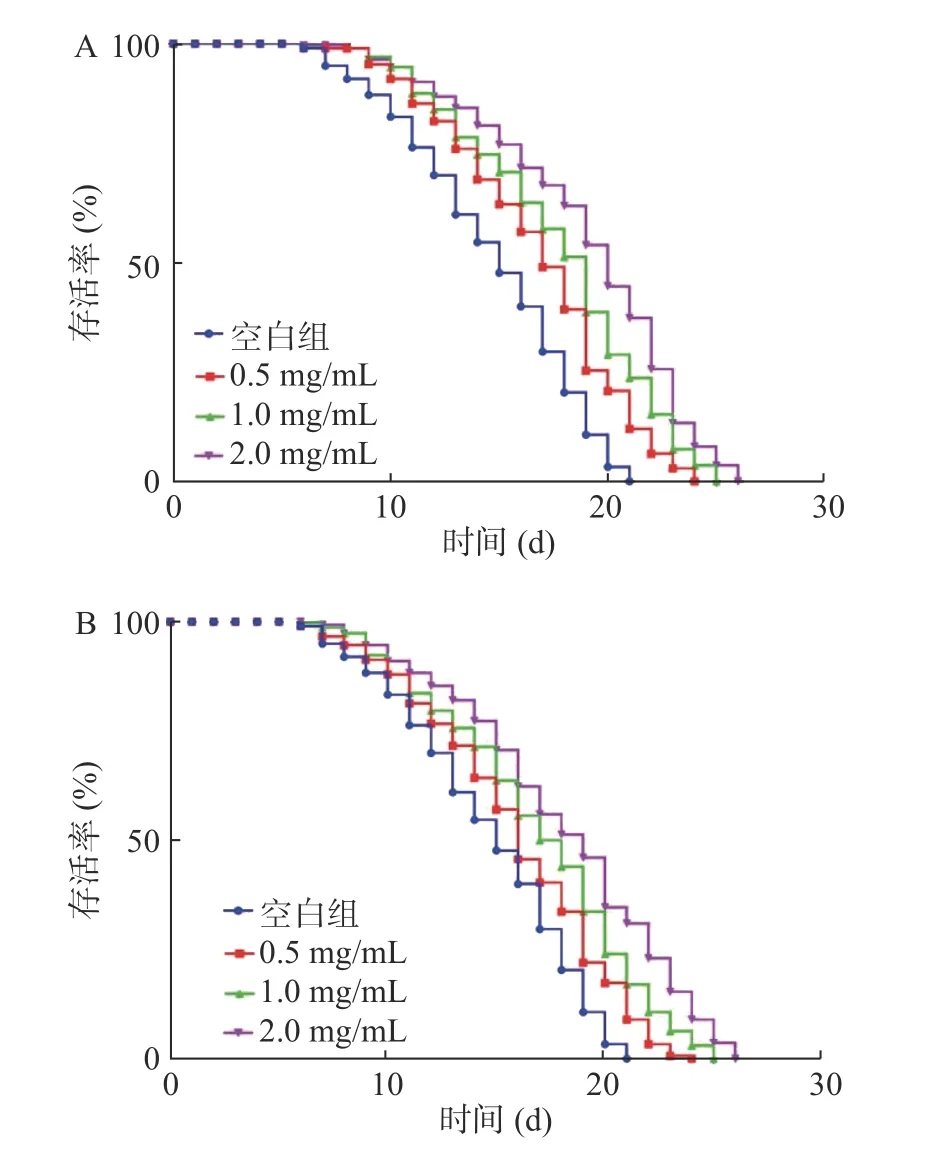
图1 鹿鞭醇提物对线虫寿命的影响Fig.1 Effects of alcohol extract from penis cervi on the life span of C.elegans
2.2 吐咽能力测定
线虫的吐咽频泵频率反应了线虫对药物的摄入情况和活动能力,随着线虫年龄的增长而降低[19]。结果表明(图2、表2),空白组1 min内的平均吐咽频率为128±5.09,HC各剂量组(0.5、1、2 mg/mL)平均吐咽频率为131.93±4.62、143.33±6.18、156.06±8.73次/min;MC组中平均吐咽频率分别为134.33±3.54、141.87±5.21、150.73±3.43 次/min。与空白组相比,2种鹿鞭醇提物在给药浓度为1.0 mg/mL水平可显著提高线虫的吐咽能力(P<0.05),2.0 mg/mL水平极显著提高线虫吐咽能力(P<0.01)。与空白组相比,HC中高剂量组(1.0、2.0 mg/mL)对线虫吐咽频率分别提高11.71%、21.92%;MC中高剂量组对线虫吐咽频率分别提高10.83%、19.95%。在同一剂量水平,HC和MC对线虫吐咽能力均无显著差异(P>0.05)。
2.3 生殖能力测定
如图3所示,线虫在产卵期的第1~3 d产卵能力较强,但随着寿命的增加,生殖能力逐渐下降,直至第5 d,基本不再产卵。根据前5 d内的总子代数统计,与空白组相比,HC和MC各剂量组总子代个数无显著差异,表明鹿鞭在发挥抗衰老活性时,并未损害其生殖能力。

表1 鹿鞭提取物对线虫寿命的影响Table 1 Effect of penis cervi extract on the lifespan of nematodes

图2 鹿鞭醇提物对线虫咽泵频率的影响Fig.2 Effect of alcohol extract from penis cervi on longevity pump frequency of C.elegans
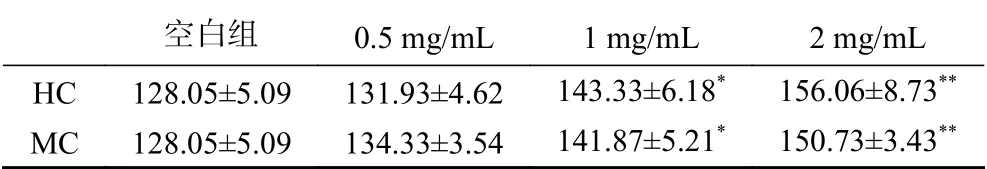
表2 鹿鞭醇提取物平均吐咽频率(次/min)Table 2 Average frequency of vomiting and swallowing of penis cervi alcohol extract (time/min)
2.4 运动能力测试
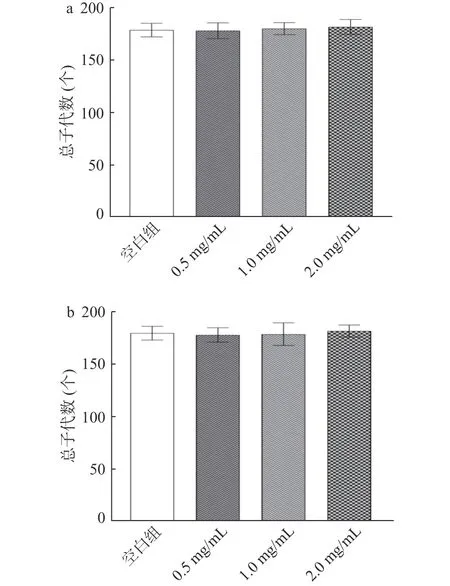
图3 鹿鞭醇提取物对线虫繁殖能力的影响Fig.3 Effect of alcohol extract from penis cervi on the reproduction of C.elegans
衰老可导致肌肉退化,随着年龄的增长运动能力逐渐下降[20]。实验观察了鹿鞭醇提物对第4、8和12 d线虫运动能力的影响(图4~图5)。第4 d,线虫处于生命过程的早期阶段,空白组与鹿鞭醇提物组均有60%以上线虫保持在运动A状态,各组间无差异。第8 d,2种鹿鞭各剂量组与第4 d相比,运动A状态线虫显著减少,而运动B和运动C线虫显著增加(P<0.05)。与空白组相比,HC各剂量组(0.5、1、2 mg/mL)线虫运动A状态显著提高了8.34%、14.03%、29%;HC与MC组相比,分别提高了1.7%、2.8%、8.3%。第12 d,空白组中有25%线虫为运动C状态,而HC高剂量组(2.0 mg/mL)中有71.67%的线虫保持在运动A或B,显著高于对照组;2.0 mg/mL HC组较MC组高7.01%。因此,2种鹿鞭均可显著改善线虫的运动能力,在同一剂量水平,HC对线虫运动状态影响优于MC。
2.5 热应激实验
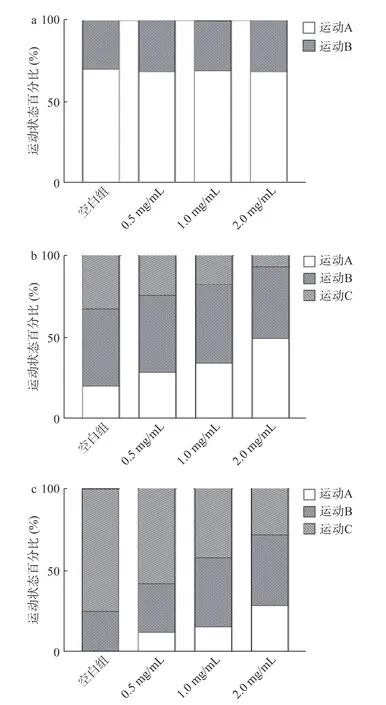
图4 花鹿鞭(HC)醇提取物对线虫运动能力的评估Fig.4 Evaluation of penis cervi alcohol extract on motility of C.elegans
高温可导致生物体内ROS水平增加,破坏自由基稳定,引起氧化应激,进而引起衰老[21]。35 ℃条件下,鹿鞭醇提物对线虫抵抗热应激能力影响(图6、表3)结果显示,不同剂量HC组(0.5、1、2 mg/mL)中线虫的平均生存时间分别较对照组提高了11.97%、26.54%、44.78%,MC组的平均存活时间分别提高12.56%、15.76、25.71%。2种鹿鞭醇提物均显著提高线虫的平均生存时间。2.0 mg/mL水平,HC组平均生存时间为12.22±0.28 h,显著高于MC组10.61±0.17 h(P<0.05)。因此,鹿鞭醇提物可提高对线虫对热应激的保护作用,延长线虫的平均生存时间,在2.0 mg/mL水平,HC对线虫热应激抵御力大于MC。
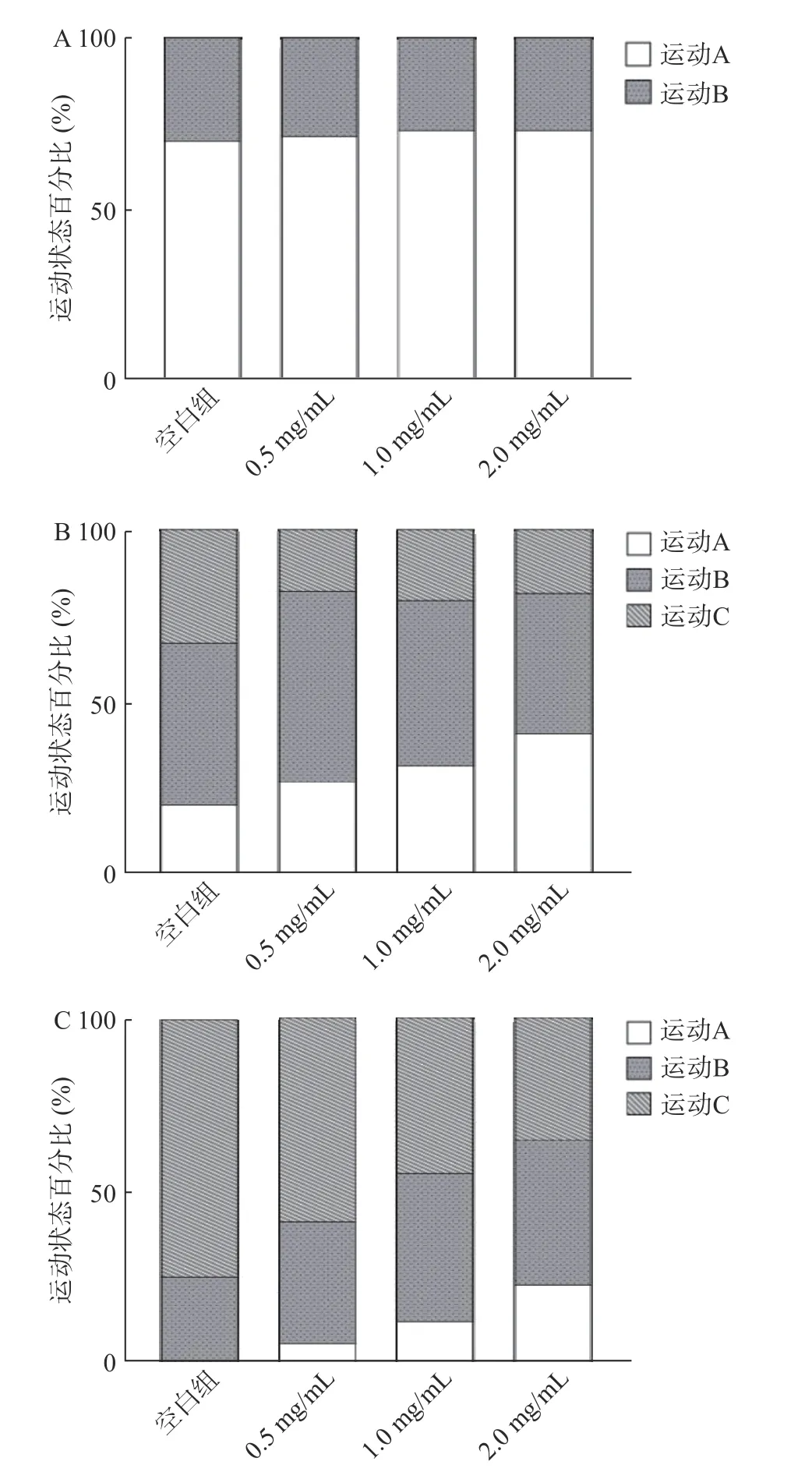
图5 马鹿鞭(MC)醇提取物对线虫运动能力的评估Fig.5 Evaluation of penis cervi alcohol extract on motility of C.elegans

图6 鹿鞭醇提物对线虫热应激的影响Fig.6 Effect of alcohol extract from penis cervi on heat stress of C.elegans
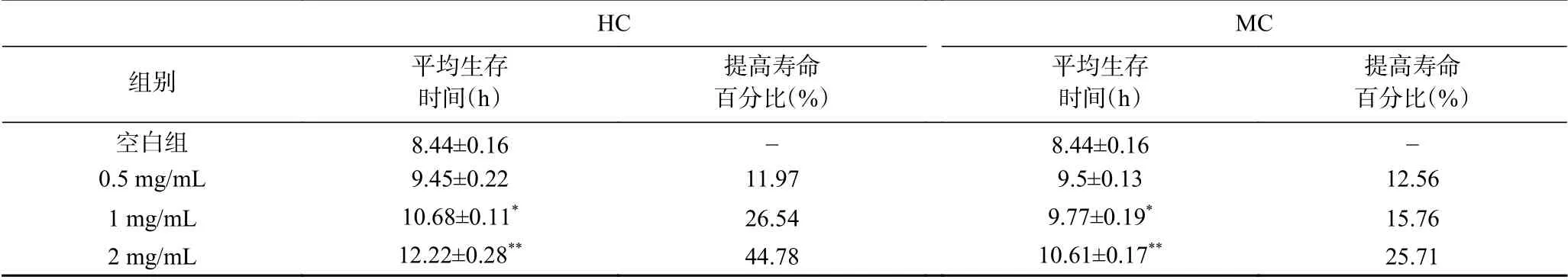
表3 鹿鞭提取物对线虫热应激的影响Table 3 Effect of penis cervi extract on heat stress of C.elegans
2.6 氧化应激实验
在百草枯致氧化损伤模型中,HC和MC低、中剂量组(0.5、1.0 mg/mL)可显著提高线虫的平均生存时间(P<0.05);高剂量组极显著提高线虫平均生存时间,分别提高41.04%和31.45%(P<0.01)(图7和表4)。可见,2种鹿鞭醇提物可增加线虫对百草枯的抵御能力,显著延长寿命,2.0 mg/mL水平,HC对百草枯抵御能力优于MC。
2.7 鹿鞭醇提物线虫体内ROS的影响
活性氧的异常积累可导致机体氧化应激,进而影响线虫寿命。通过2',7'-二氯荧光黄双乙酸盐(DCFH-DA)荧光染色法测定线虫体内ROS水平,结果显示,鹿鞭醇提物呈浓度依赖性抑制线虫体内ROS的形成(图8)。2种鹿鞭在低中剂量组无显著差异,在2.0 mg/mL水平,HC的ROS清除率为28.67%,明显高于MC组(23.34%)。
2.8 鹿鞭醇提物对线虫抗氧化酶活力和MDA含量的影响
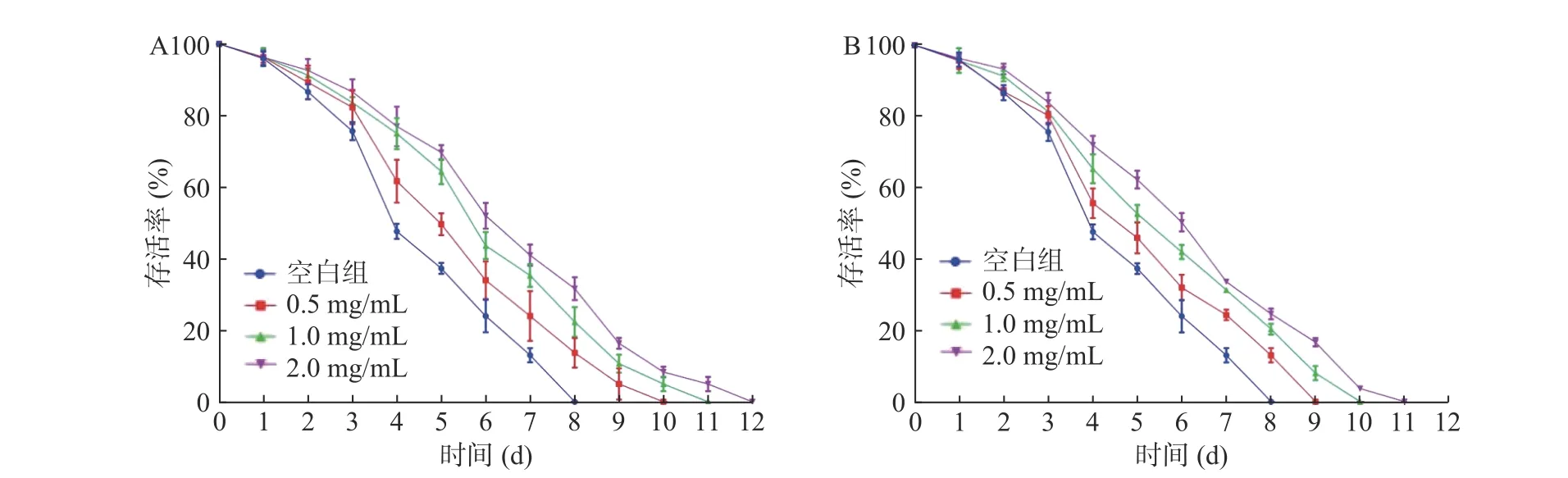
图7 鹿鞭提取物对线虫氧化应激的影响Fig.7 Effects of extracts from penis cervi on oxidative stress of C.elegans
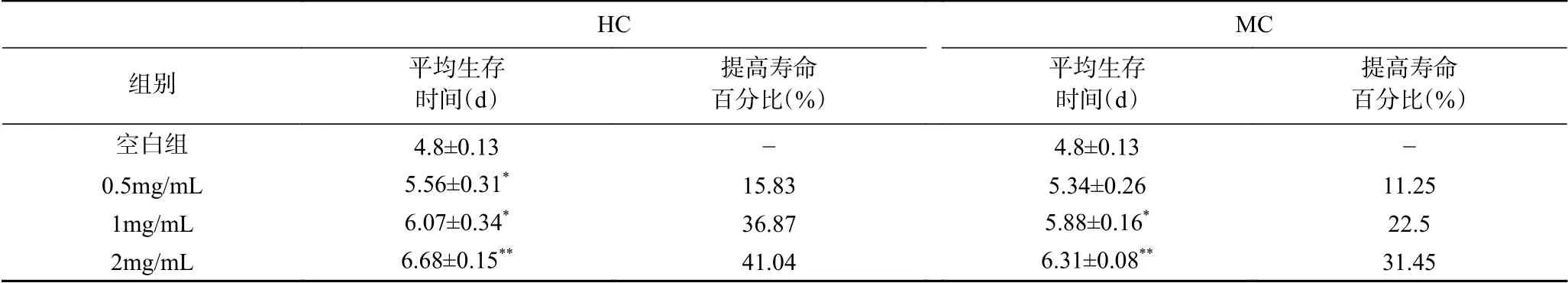
表4 鹿鞭提取物对线虫氧化应激的影响Table 4 Effects of different solvent extracts penis cervi on the oxidative stress of C.elegans

图8 鹿鞭提取物对线虫体内ROS的影响Fig.8 Effect of extracts from penis cervi on ROS in C.elegans
3 结论与讨论
本研究显示,经HC和MC各剂量处理后,线虫寿命值显著提高且呈浓度依赖性;运动能力测试表明,花鹿鞭和马鹿鞭醇提物可显著改善衰老线虫的运动状态,延长热应激和氧化应激状态下线虫平均生存率。因此,2种鹿鞭均可在线虫体内发挥抗衰老活性。
氧自由基理论认为,衰老可能是由于机体正常代谢或受外界环境胁迫时,产生过量活性氧自由基(ROS),导致ROS与抗氧化酶失衡,引起脂质过氧化反应,损伤DAN、蛋白质结构,最终导致细胞凋亡和衰老[23]。经鹿鞭醇提物处理后,线虫可显著改善因百草枯胁迫引起的ROS异常累积,提高SOD、CAT抗氧化酶活力、降低脂质过氧化产物MDA含量。文献报道鹿茸醇取物[24]可显著提高线虫对胡桃醌胁迫的抵御力,提高其抗氧化能力,延长线虫寿命。淫羊藿醇提取物[25]降低衰老小鼠体内ROS水平,提高抗氧化酶活性,其抗衰老机制主要源于抗氧化活性。余甘子提取物[26]可显著提高线虫体内SOD活力,形成氧化保护,提高线虫寿命。因此,鹿鞭醇提物可能是通过提高抗氧化能力,清除活性氧自由基,提高抗氧化酶活性来实现抗衰老活性。这也与鹿鞭醇提物[7]具有提高抗氧化酶活性,降低MDA水平,改善小鼠疲劳状态结果相一致。
2种鹿鞭醇提物可显著提高线虫的寿命值,但对其产卵能力无显著差异,表明鹿鞭在发挥抗衰老作用的同时,对线虫生殖能力无损害,这与橙提取物[27]延长线虫寿命且不损伤生殖能力的结果相一致。饮食限制途经是指保证线虫正常营养状态下,减少多余热量的摄入,通过延迟发育,延缓线虫寿命。吐咽能力为饮食限制途经的常用指标。文献报道海参[28]提取物延长线虫寿命且显著提高其吐咽能力。在本文中,鹿鞭醇提物均未抑制线虫吐咽能力,且在中、高剂量组(1.0、2.0 mg/mL)具有显著促进作用。表明线虫在不断的在摄取含OP50的药物来实现药理活性,而不是由于饮食限制途经。这也与枸杞提取物[29]提高线虫吐咽能力的结果一致。
2种鹿鞭醇提物均可通过提高抗氧化能力,清除线虫体内ROS累积,增强机体应激抵抗力,以实现抗衰老活性的目的,其中2.0 mg/mL HC组线虫在寿命、氧化应激、运动实验测试中均优于MC,表明在一定剂量水平下,花鹿鞭醇提物抗衰老活性大于马鹿鞭醇提物。本研究可为鹿鞭药材的开发利用提供参考,但未对衰老基因相关调控机制深入研究,有待继续探讨。
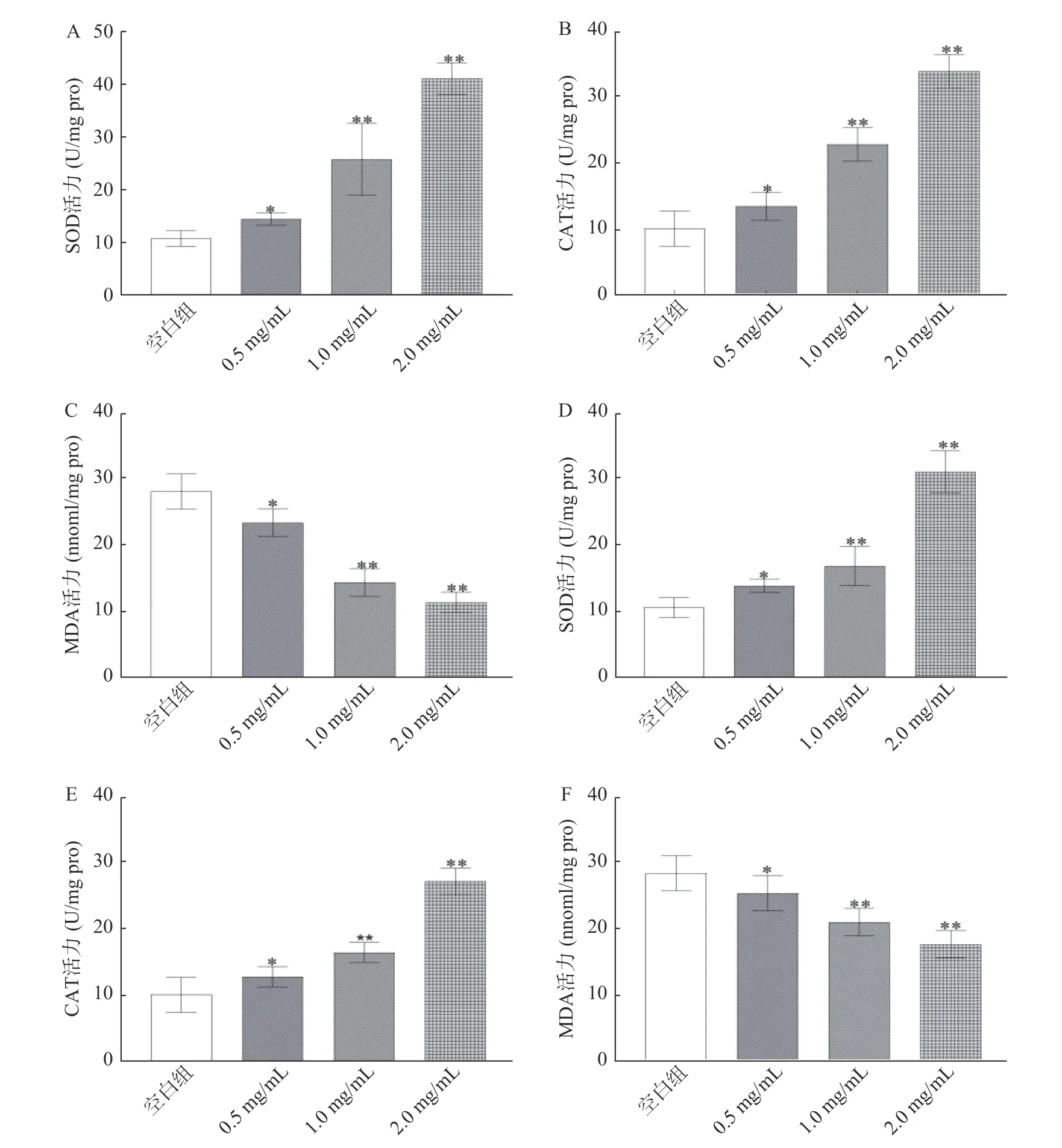
图9 鹿鞭提取物对线虫SOD、CAT活力及MDA含量的影响Fig.9 Effect of extract from penis cervi on SOD, CAT activity and MDA content of C.elegans
