miR-26a对脑梗死大鼠血管生成的调节作用及其机制
2021-06-18王虎清
职 瑾,段 斌,王 静,王 清,王虎清
(1西安市第一医院神经内科,西安 710002;2陕西省人民医院肾病血透中心;3西安交通大学第二附属医院神经内科;*通讯作者,E-mail:Zhijin7911@163.com)
脑梗死是一种高发病率、高残疾率和高死亡率的疾病,严重危害人类健康[1]。研究数据显示,超过90%的脑梗死患者发作后4.5 h内未进行治疗,就无法从早期溶栓治疗中受益[2]。急性脑梗死患者中只有2.4%接受了溶栓治疗,其中只有1.6%接受了重组组织纤溶酶原激活剂(recombinant tissue plasminogen activator,rt-PA)的治疗[3]。其治疗的基本原理是梗死后侧支通道的重建,重建主要取决于血管生成。也有报道称,脑梗死后血管密度与患者的预后有关。因此,研究脑梗死后血管新生的潜在机制,寻找更有效的防治方法具有重要意义[4]。
微小RNA(microRNA,miRNA)是近年发现的一类约20-25个核苷酸大小,具有转录后调节活性的内源性非编码单链小分子RNA,通过与靴基因完全或不完全匹配,直接降解靶基因或抑制靶基因翻译[5]。研究发现,microRNA可调节的基因占人类基因组的1/3以上,参与调控多种信号转导途径包括细胞增殖、分化、凋亡、死亡、免疫调节等多种生命活动,从而与人类多种疾病密切相关已逐渐成为医学领域的研究热点。既往血管再生相关研究[6]着重针对其主要触发因素如血管剪切力改变、缺氧等,近年来有关miRNA调控组织缺血后血管新生的研究逐渐增多,相继发现了一系列与血管生成有关的miRNA,按其生物功能可分为促进血管生成的miRNA[7]和抑制血管生成的miRNA[8]。这些实验成果在体外培育的内皮细胞和或肿瘤、肢体缺血、肾缺血再灌注、缺血性心肌病等动物模型体内得到了相关证实。而近两年开始出现脑缺血后血管新生的相关的研究,有学者提出是脑缺血后血管再生的正调控因子。研究发现[9],miR-296促进大鼠脑缺血梗死后血管新生的过程,通过抑制其靶基因HGS的表达,上调VEGF-VEGFR2信号通路的活性,促进血管新生的过程。
microRNAs参与和调控多种生物学过程[10],据报道,许多microRNA在缺血组织中的表达模式发生了巨大变化[5];然而,在梗死诱导的血管生成中仅研究了少数miRNA功能[11],这使得本实验有必要探索和阐明microRNA-26a(miRNA-26a)在脑梗死中的作用及其对调节脑梗死大鼠血管生成的机制。因此,本研究使用MCAO大鼠模型和体外氧葡萄糖剥夺(oxygen-glucose deprivation,OGD)模型来研究miRNA-26a在大鼠脑梗死中的作用。旨在通过miRNA-26a过表达及其抑制来研究miRNA-26a对血管生成的影响,为临床治疗缺血性脑梗死和血管修复新靶标的确定提供理论参考。
1 材料和方法
1.1 实验材料
16只SPF级Sprague-Dawley(SD)雄性大鼠(250-300 g)由西安交通大学医学部医学实验动物中心(SYXK(陕)2018-001)提供,大鼠的周龄和体质量差异无统计学意义(P>0.05)。大鼠饲养于西安交通大学医学部医学实验动物中心专用饲养室,釆用架式笼养,光照12 h明暗交替,保持饲养稳定为20 ℃左右,湿度为50%-60%,对动物的处理严格遵循《实验动物管理条例》。Ⅱ型胶原酶(Thermo Fisher Scientific),DMEM(Thermo Fisher Scientific,USA),FBS(Gibco,Rockville,USA),TTC(Sigma-Aldrich),RNA提取试剂盒(Invitrogen,USA),RIPA(Roche,Basel,Switzerland),抗VEGF、抗FGF、抗Ang和山羊抗兔IgG抗体(Cell Signaling,Danvers,MA,USA),VEGF抑制剂Sorafenib Tosylate(Selleck Chemicals,USA)大鼠脑微血管内皮细胞(广州吉妮欧生物科技有限公司,JNO17-733)。
1.2 动物模型建立
将16只SPF级雄性SD大鼠随机分为2组,每组8只:假手术组和脑梗死模型组。根据改良的Longa方法建立脑中动脉闭塞(MCAO)大鼠模型[12]。实验组大鼠给予16%水合氯醛以350 mg/kg剂量行腹腔注射麻醉后,仰卧固定于木板上,接着分离颈内、颈外动脉并结扎。假手术组用相同的手术步骤进行但不结扎。所有大鼠术后放置于温暖适宜的环境中,直到从麻醉中苏醒,并在手术后24 h处死大鼠收集样品用于大鼠脑梗死体积检测和miR-26a表达水平的检测。
1.3 细胞体外培养和转染和分组
大鼠脑微血管内皮细胞(BMEC)经胰酶消化且传代达80%融合时,将第4或5代细胞用于实验。将正常BMEC细胞分为正常组、miR-26a mimic组、miR-26a inhibitor组、miR-26a mimic+VEGF inhibitor组和氧葡萄糖剥夺(OGD)模型组。对照组采用正常大鼠脑微血管内皮细胞作为对照;miR-26a mimic组BMEC细胞转染miRNA-26a模拟物;miR-26a inhibitor组BMEC细胞转染miRNA-26a抑制剂;mimic+VEGF inhibitor组BMEC细胞转染miRNA-26a模拟物和添加VEGF抑制剂Sorafenib Tosylate(50 mmol/L);OGD组将培养箱氧气浓度调至1%,并将培养基换为不含葡萄糖的Earle’s平衡盐溶液,分别缺氧缺糖10 h后取出细胞,恢复正常条件继续培养24 h后倒置显微镜下观察细胞形态学变化,构建体外氧葡萄糖剥夺细胞模型。
1.4 脑梗死体积检测
大鼠处死后收集大脑组织,然后进行梗死体积检测;从额叶开始将大脑切成2 mm的冠状切片,并在2% 2,3,5-三苯基四唑氯化物(TTC)中孵育37 min,然后在4%多聚甲醛中固定过夜,用计算机图像分析仪定量梗死体积。
1.5 神经功能评估
按照Garcia等[13]的方法对每只大鼠的神经功能进行评估,本实验中大鼠神经系统缺损按3-18的等级进行评估(3分为最大缺陷评分;18分为正常评分),其中评分越低则代表损伤严重程度越高。
1.6 RNA提取和实时定量聚合酶链反应(RT-PCR)
使用Trizol法RNA提取试剂盒提取大鼠脑组织和体外培养大鼠脑微血管内皮细胞的总RNA,逆转录合成互补脱氧核糖核酸(cDNA)。通过实时定量PCR检测基因表达水平,其引物序列如下。MiR-26a F:5′-TCCGTTGTTTCAAGTAATCCAGG-3′;R:5′-ATCAACCACACGTCATGTGACT-3′;GAPDH F:5′-CCACCCATGGCAAATTCCATGGCA-3′;R:5′-TCTAGACGGCAGGTCAGGTCCACC-3′。
1.7 MTT法检测细胞增殖
取胰蛋白酶消化后转染的大鼠脑微血管内皮细胞,并将其接种于96孔板(5×103/孔)中,每组重复3次。向每孔中加入20 μl MTT溶液(5 mg/ml),然后将细胞在37 ℃下孵育2 h。用酶标仪测定450 nm处的吸光度,实验重复3次。
1.8 倒置显微镜观察血管内皮细胞小管形成情况
取胰蛋白酶消化后转染的大鼠脑微血管内皮细胞,接种到备好的6孔培养板内用含10%胎牛血清的M199培养,显微镜下见细胞成团块状生长,待细胞团长到适当密度时吸入无菌离心管,500 r/min离心5 min。将纤维蛋白胶、M199、NaOH和HEPS(8 ∶1 ∶0.5 ∶0.5)加入上述离心试管内,用吸管吹打混匀,在24孔板内加入混有细胞团的纤维蛋白胶,37 ℃孵育30 min,利用功能倒置相差显微镜观察并记录鼠血管内皮细胞小管形成和细胞增殖情况。
1.9 TUNEL染色检测BMEC细胞凋亡
将大鼠脑微血管内皮细胞用二甲苯脱蜡(5 min,3次),并用100%乙醇、95%乙醇和70%乙醇梯度脱水3次。然后与蛋白激酶K孵育30 min,并用PBS洗涤。然后将切片与末端脱氧核苷酸转移酶和荧光素酶标记的dUTP在37 ℃下反应1 h。加入辣根过氧化物酶标记的特异性抗体,再在37 ℃的培养箱中培养1 h。用DAPI对细胞核染色后,对切片进行拍摄并在荧光显微镜下计数。
1.10 VEGF、FGF和Ang蛋白质免疫印迹分析
通过放射免疫沉淀测定法(RIPA)裂解物提取BMEC细胞中总蛋白。将所有蛋白质样品定量至相同浓度,保存在-80 ℃的冰箱中备用。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)用于分离细胞中提取的总蛋白,并转移到聚偏二氟乙烯(PVDF)膜上,再将膜与以下主要一抗在4 ℃孵育过夜,VEGF、FGF和Ang按1 ∶1 000比例稀释。在Tris缓冲盐水和Tween(TBS-T)中洗涤3次后,将膜与辣根过氧化物酶(HRP)标记的山羊抗兔IgG抗体按1 ∶5 000稀释温育(室温2 h);通过增强化学发光(ECL)成像的成像分析系统(Beyotime)确定蛋白条带并计算灰度值。最后计算蛋白质表达水平,用3-磷酸甘油醛脱氢酶(GAPDH)作内参对照,每组实验均重复5次。
1.11 数据处理与统计分析
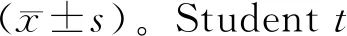
2 结果
2.1 大鼠脑梗死体积、脑神经功能和miR-26a的表达
与假手术组相比,模型组大鼠的脑梗死体积显著增加(P<0.01),脑神经功能损伤评分显著降低(P<0.01)。该结果说明大鼠脑梗死模型建立成功,可用于后续实验研究。与假手术组相比,模型组大鼠脑组织中miR-26a的表达水平显著上调(P<0.01)。体外细胞培养条件下,与正常组相比,OGD组中miR-26a的表达水平显著上调(P<0.01,见图1)。
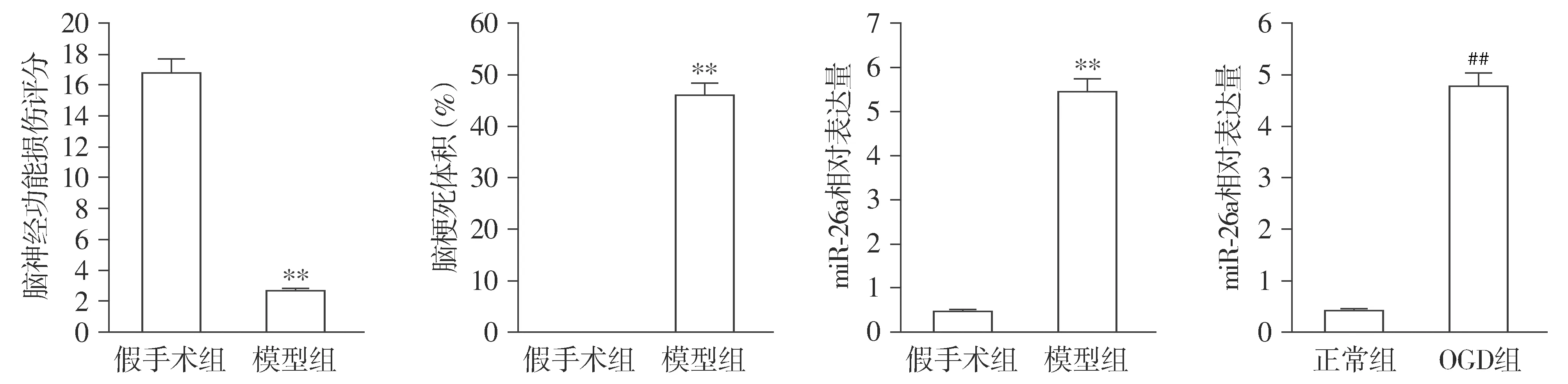
与假手术组比较,**P<0.01;与正常组比较,##P<0.01图1 脑梗死大鼠梗死体积和脑神经功能评估及miR-26a mRNA的表达Figure 1 Rat cerebral infarction volume, brain nerve function assessment and the expression of miR-26a mRNA in cerebral infarction rats
2.2 脑微血管内皮细胞中miR-26a的表达和细胞凋亡
与正常组相比,miR-26a mimic组中miR-26a的表达量显著上调(P<0.01),而miR-26a inhibitor组中的表达量无显著变化(P>0.05)。细胞凋亡检测结果显示,与正常组相比,miR-26a mimic组中脑微血管内皮细胞凋亡率显著降低(P<0.01);与miR-26a mimic组相比,miR-26a inhibitor组中细胞凋亡率显著升高(P<0.01),且与正常组相比无显著差异(P>0.05,见图2)。该结果提示miR-26a可能会抑制大鼠脑微血管内皮细胞的凋亡。
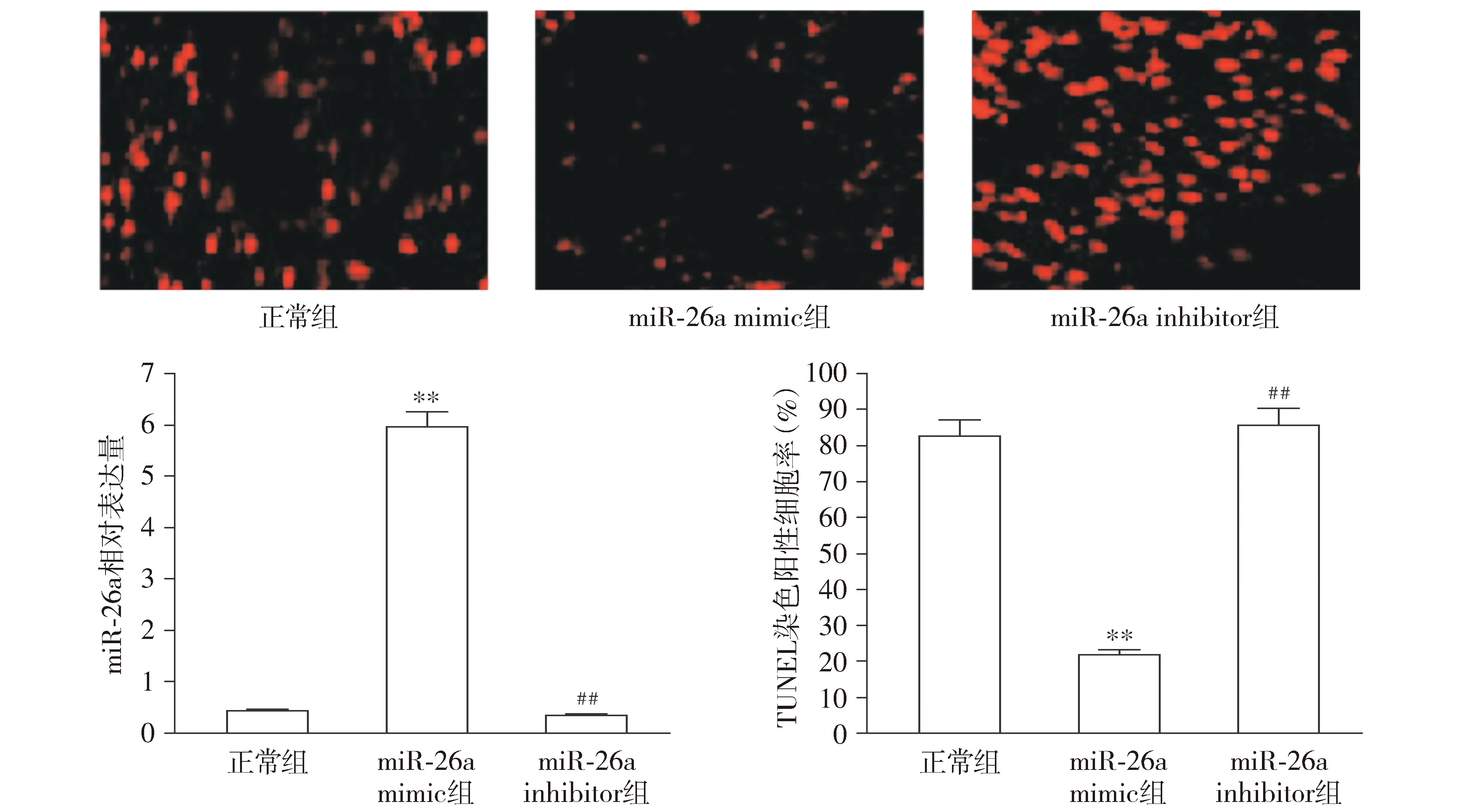
与正常组比较,**P<0.01;与miR-26a mimic组比较,##P<0.01图2 脑微血管内皮细胞中miR-26a表达量变化和细胞凋亡情况 (×200)Figure 2 Expression of miR-26a and apoptosis in brain microvascular endothelial cells
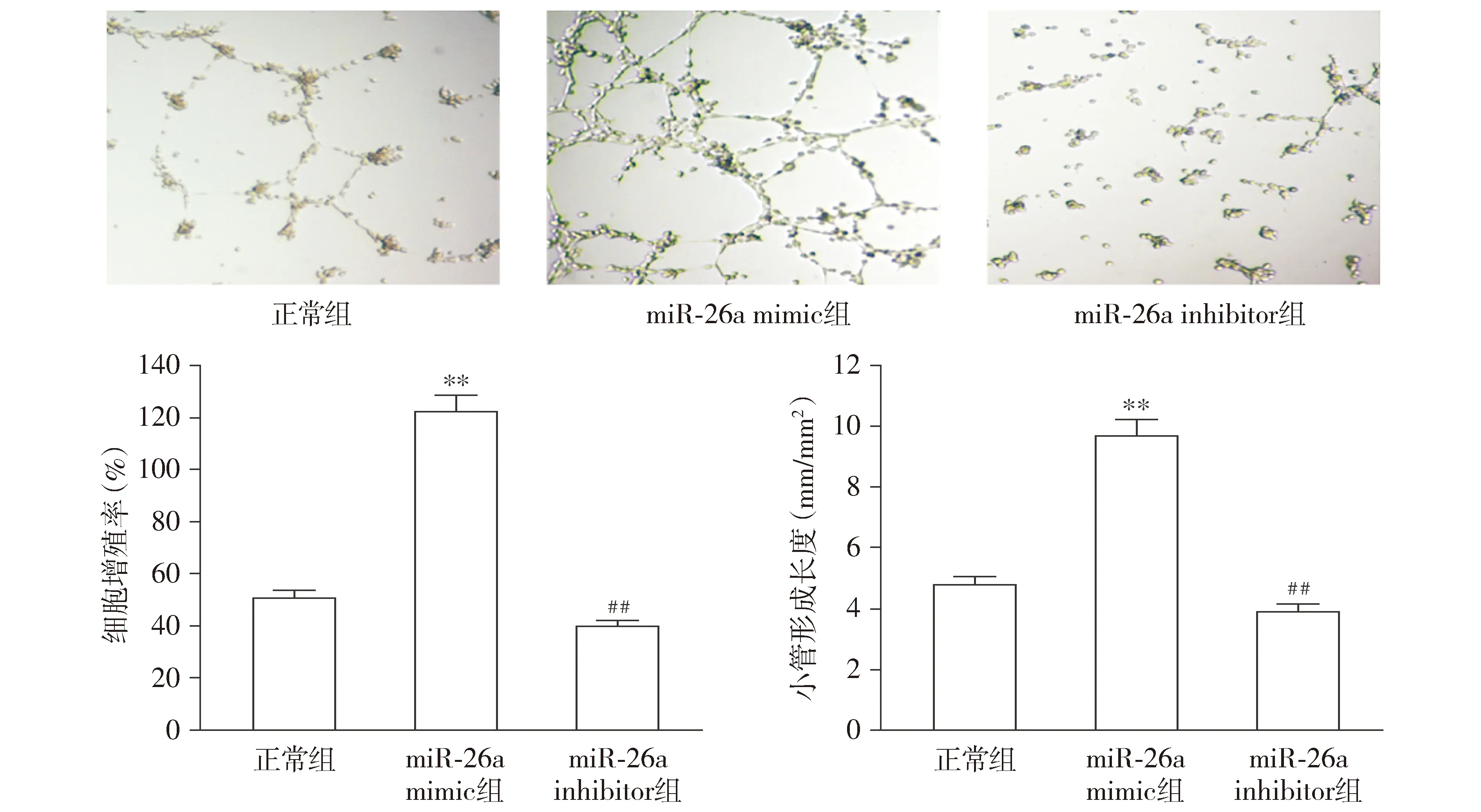
2.3 miR-26a对血管内皮细胞小管形成和细胞增殖的影响
与正常组相比,miR-26a mimic组小管的形成和长度以及细胞增殖率均显著增加(P<0.01);与miR-26a mimic组相比,miR-26a inhibitor组中小管的形成和长度以及细胞增殖率均显著降低(P<0.01,见图3)。该结果表明miR-26a可能对大鼠血管内皮的形成具有调控作用。
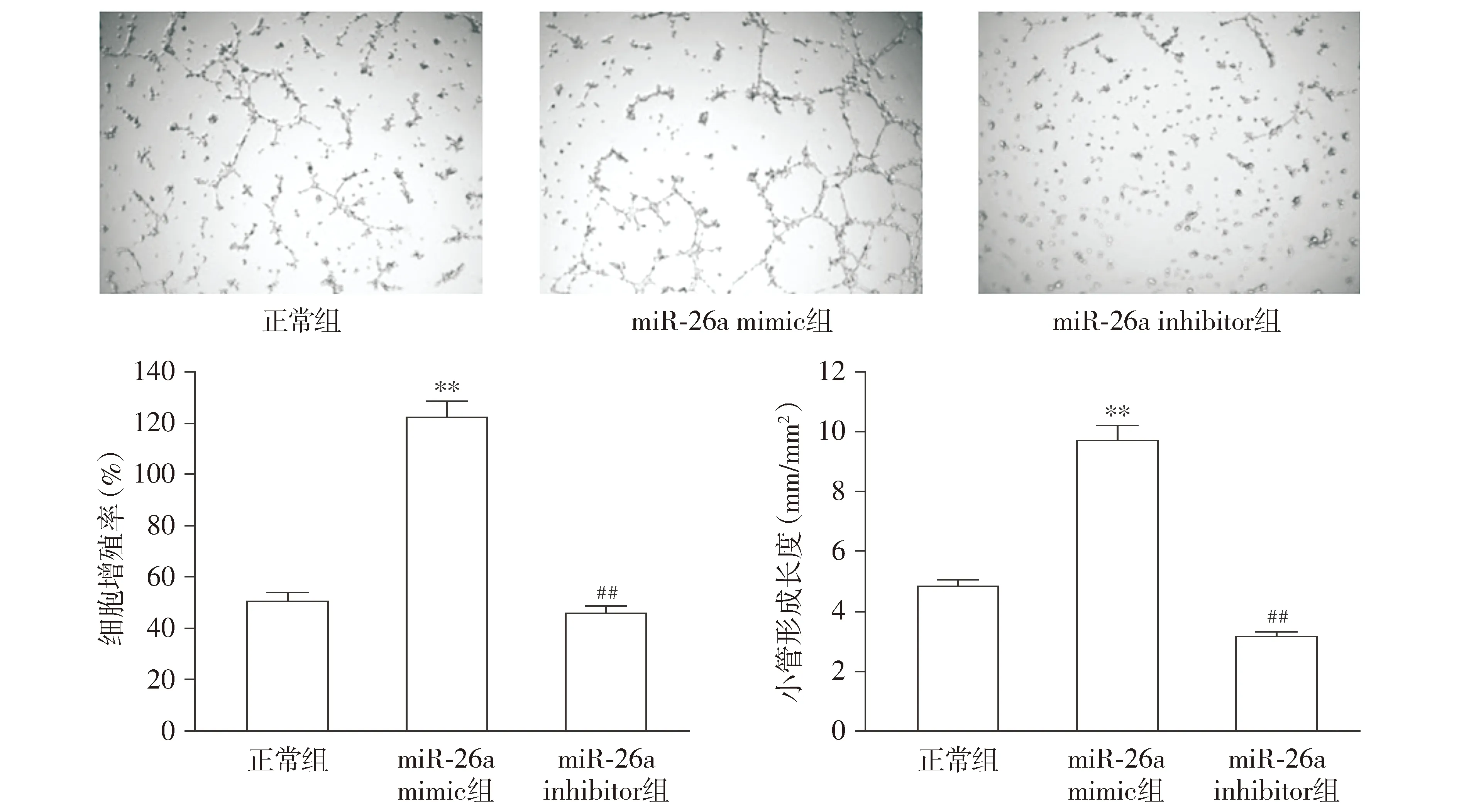
与正常组比较,**P<0.01;与miR-26a mimic组比较,##P<0.01图3 miR-26a对血管内皮细胞小管形成和脑微血管内皮细胞增殖的影响 (×200)Figure 3 The effect of miR-26a on vascular endothelial cell tubule formation and brain microvascular endothelial cell proliferation (×200)
2.4 miR-26a对血管内皮相关因子蛋白表达的影响
与正常组相比,miR-26a mimic组中VEGF、FGF和Ang蛋白的表达水平均显著上调(P<0.01);与miR-26a mimic组相比,miR-26a inhibitor组中VEGF、FGF和Ang蛋白的表达水平显著下调(P<0.01,见图4)。该结果表明miR-26a可能对大鼠血管内皮形成相关的因子或途径具有调节作用。
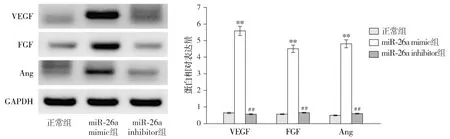
与正常组比较,**P<0.01;与miR-26a mimic组比较,##P<0.01图4 miR-26a对血管内皮相关因子VEGF、FGF和Ang蛋白表达量的影响Figure 4 The effect of miR-26a on the expression of vascular endothelial-related factors VEGF, FGF and Ang protein
2.5 VEGF抑制剂对血管内皮细胞小管形成和细胞增殖的影响
VEGF抑制剂Sorafenib Tosylate对miR-26a过表达细胞血管内皮细胞小管的形成及细胞增殖的影响结果显示,与正常组相比,miR-26a mimic组中小管的长度显著增加(P<0.01);与miR-26a mimic组相比,mimic+VEGF inhibitor组中小管的形成受到显著抑制(P<0.01),mimic+VEGF inhibitor组中细胞的相对数目显著减少(P<0.01,见图5)。该结果表明miR-26a可能是通过调节VEGF来影响大鼠血管内皮功能和细胞的增殖。
与正常组比较,**P<0.01;与miR-26a mimic组比较,##P<0.01图5 VEGF抑制剂对血管内皮细胞小管形成和脑微血管内皮细胞增殖的影响 (×200)Figure 5 The effect of VEGF inhibitor on vascular endothelial cell tubule formation and brain microvascular endothelial cell proliferation (×200)
3 讨论
脑缺血性梗死是一种严重危害人类健康的疾病[14]。目前,促进梗死区域的血运重建是该疾病临床治疗的主要方法。因此,寻找有效治疗方法,以促进缺血区域的血管生成、增加毛细血管数量和改善血液循环至关重要[15]。研究表明,miRNA-26a参与许多肿瘤的形成和发展,其可通过IL-6-Stat3信号通路抑制原发性肝癌的生长和转移[16]。刘琦等[17]证明了miRNA-26a可能参与肿瘤相关的血管生成和细胞周期的调控。但是关于miRNA-26a对脑梗死大鼠血管生成的机制研究较少,因此,本研究着重于研究其对大鼠脑梗死和血管重建作用的调控机制,为脑梗死治疗的靶点研究提供实验依据。本实验研究结果显示,脑梗死损伤可促进miRNA-26a的表达,且miRNA-26a促进了脑微血管内皮细胞管腔的形成和细胞增殖,这表明miRNA-26a可能促进了大鼠脑梗死后脑微血管内皮细胞血管的生成。
血管内皮生长因子(vascular endothelial growth factor,VEGF)在机体内的主要功能是促血管生成[18]。而成纤维细胞生长因子(fibroblast growth factor,FGF)被证实也与血管新生有关[19],其广泛分布于人体组织以及相应的器官中,因组织配体的不同,而其自身的作用也不相同,主要包括促进血管新生、肿瘤形成、组织修复及代谢。血管生成素(angiogenin,Ang)是一种新型的参与血管生成的调节蛋白[20],主要维持血管内皮的稳定,并参与血管及肌肉纤维化进程[21]。主要由4种氨基酸组成,即Ang-1、Ang-2、Ang-3、Ang-4,其中Ang-1和Ang-2的细胞膜受体均为Tie-2,其受体属于VEGF家族[22],高水平Ang会导致动脉粥样硬化的迅速和严重发展。本研究结果也发现miRNA-26a可通过调节VEGF、FGF和Ang蛋白的表达,从而调节大鼠脑梗死后脑微血管内皮细胞血管的生成。血清VEGF、FGF和Ang与急性脑梗死患者颈动脉狭窄相关,且VEGF、FGF和Ang水平的升高可能会增加急性脑梗死患者颈动脉颅外段狭窄出现的风险[23]。FGF水平较高的患者心血管风险增加[24],FGF的高水平也会使得缺血性脑血管病发病率明显增高[25,26]。本结果也与前人的研究结果相一致,我们也发现miRNA-26a可通过调节VEGF、FGF和Ang蛋白的表达,从而调节大鼠脑梗死后脑微血管内皮细胞血管的生成。且进一步的研究表明,抑制或下调VEGF的表达可以逆转脑微血管内皮细胞中miRNA-26a对血管内皮管腔的形成和细胞增殖的促进作用。这一结果证明了miRNA-26a可能通过调节VEGF的表达来影响脑梗死大鼠血管内皮功能及血管的重建。
综上所述,miRNA-26a通过调节血管内皮相关因子(VEGF、FGF和Ang蛋白)的表达影响脑梗死大鼠血管内皮功能及血管的重建和细胞的增殖,从而调节大鼠脑梗死后脑微血管内皮细胞血管的生成。本研究结果可能为脑梗死治疗提供新的见解和参考,以期成为脑梗死治疗的生物靶标之一。
