OPN/CD44通路在缺氧诱导肺动脉平滑肌细胞增殖中的作用及其机制
2021-06-18吴树全王生兰
吴树全,王生兰
(1青海省第五人民医院急诊科,西宁 810000;2青海大学医学院病理生理学教研室)
肺动脉高压(pulmonary arterial hypertension,PAH)是一种弥漫性肺微血管重塑疾病,伴有肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)恶性增殖,导致持续的肺动脉压升高,右心室肥大和死亡[1,2]。血管重塑是PAH的关键病理特征,其中PASMCs异常增殖是肺动脉血管重塑的主要机制,但目前针对肺血管重塑的疗法在逆转PAH方面效果仍不佳[3],因此,积极地探索调控PASMCs增殖的分子机制可能有助于改善PAH的临床治疗效果。骨桥蛋白(osteopontin,OPN)是一种多效性细胞因子,与细胞增殖密切相关[4]。另有研究证实,OPN可能参与特发性和低氧性肺动脉高压的发病机制,其上调可能有助于PASMCs增殖,但其具体分子机制尚不清楚[5]。CD44是一种广泛表达的选择性剪接、翻译后修饰的跨膜糖蛋白,在调节细胞存活、维持功能性血管屏障和血管生成中至关重要[6]。然而,OPN在低氧诱导下对人PASMCs(human PASMCs,HPASMCs)细胞增殖的影响及其作用机制是否与CD44相关未见报道。因此,本研究选择体外培养HPASMCs细胞,模拟低氧环境,探讨OPN/CD44通路对HPASMCs细胞增殖的影响,以期为临床PAH治疗提供新思路。
1 材料与方法
1.1 主要材料与仪器
1.1.1 主要材料 HPASMCs(3110)购自上海中乔新舟生物科技有限公司;SMCM培养基(1101)购自北京裕恒丰科技有限公司;OPN-siRNA及OPN-siRNA阴性对照(negative control-siRNA,NC-siRNA)序列由吉玛基因公司构建。DMEM培养基(11995)、PCR试剂盒(RP1100)、胰酶消化液(T1350)、Trizol试剂盒(R1100)、RIPA裂解液(R0020)、逆转录试剂盒(T2210-200T)、ECL发光液(PE0010)购自北京Solarbio公司;OPN、CD44及β-肌动蛋白(β-actin)引物序列由上海生工生物工程有限公司设计合成;增殖细胞核抗原(proliferation cell nuclear antigen,PCNA)(13-3900)、Cyclin D1(33-3500)、Cyclin E(MA5-14336)、p27(MA5-12835)、OPN(MA5-17180)、CD44小鼠抗人单克隆抗体(MA5-13887)、山羊抗小鼠IgG(H+L)二级抗体(A32723)购自美国Thermo Fisher Scientific公司。
1.1.2 主要仪器 HF160W型CO2细胞培养箱购自上海Heal Force公司;cell+100型低氧细胞培养工作站购自广州市华粤行仪器有限公司;T100型PCR仪、ELX-8081U型酶标仪和Gel DocTMXR+型凝胶成像仪购自美国Bio-Rad公司;CytoFLEX型流式细胞仪购自美国贝克曼公司。
1.2 实验方法
1.2.1 HPASMCs细胞培养 采用SMCM完全培养基(89%SMCM培养基+10%胎牛血清+1%生长因子+100 U/ml双抗),在37 ℃、5%CO2培养箱中培养HPASMCs细胞,待细胞传至3-4代消化收集细胞用于后续实验。
1.2.2 低氧处理HPASMCs细胞 将1.2.1培养的HPASMCs细胞,用DMEM培养基同化12 h,然后更换为SMCM培养基(平滑肌细胞专用培养基,其氨基酸、维生素和生长因子等配比不同于DMEM),置于37 ℃、1% O2低氧培养箱中培养24 h,建立低氧诱导模型。
1.2.3 细胞分组及OPN-siRNA沉默实验 收集1.2.1对数期生长的HPASMCs细胞,铺于6孔板,随机分为常氧组、低氧组、OPN-siRNA+低氧组和NC-siRNA+低氧组。常氧组按照1.2.1方法培养24 h,低氧组、OPN-siRNA+低氧组和NC-siRNA+低氧组根据1.2.2低氧培养方法,使用不含双抗的培养基培养6 h后,按照脂质体转染步骤分别进行不转染、OPN-siRNA转染和NC-siRNA转染6 h,更换为SMCM培养基低氧培养24 h。收集以上各组细胞用于后续实验。
1.2.4 RT-qPCR实验检测OPN和CD44 mRNA表达 使用Trizol试剂盒提取1.2.3各组细胞RNA,并测定RNA浓度,取2 μl RNA反转录为cDNA,进行PCR扩增,完全按照PCR试剂盒说明书配置反应体系,反应程序设置如下:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环。以β-actin为内参,采用2-ΔΔCt法计算OPN mRNA及CD44 mRNA相对表达量,引物序列见表1。

表1 OPN mRNA、CD44 mRNA及β-actin引物序列
1.2.5 CCK-8实验检测各组HPASMCs细胞活性 将1.2.1对数期生长的HPASMCs细胞,按照密度为4.5×104个/孔,接种于96孔板,参照1.2.3方法分组并处理后,弃去上清液,每孔加入10 μl CCK-8溶液,继续培养3 h,充分混匀后酶标仪检测450 nm处各孔吸光值(OD值),以上每组设置6个复孔,计算各组OD均值,计算细胞活性,细胞活性=(实验孔OD值-调零孔OD值)/(对照孔OD值-调零孔OD值)。
1.2.6 凋亡实验检测各组HPASMCs细胞凋亡率 根据凋亡试剂盒说明步骤,收集1.2.3各组HPASMCs细胞,依次加入10 μl Annexin Ⅴ-FITC和5 μl PI,室温孵育20 min,流式细胞仪检测各组细胞凋亡情况。
1.2.7 周期实验检测各组HPASMCs细胞周期变化 根据细胞周期检测试剂盒说明书步骤,收集1.2.3各组HPASMCs细胞,PBS清洗后,加入预冷的70%乙醇固定过夜,收集细胞加入RNA酶,室温孵育30 min后,进行PI单染,避光反应30 min,流式细胞仪检测细胞周期变化情况。
1.2.8 蛋白免疫印迹分析检测OPN、CD44、PCNA、Cyclin D1、Cyclin E和P27蛋白表达 使用RIPA裂解1.2.3各组HPASMCs细胞,提取总蛋白,采用BCA法检测蛋白浓度。取等量蛋白样品,经凝胶电泳分离后,转膜、封闭,加入稀释后的一抗OPN、CD44、PCNA、Cyclin D1、Cyclin E、P27和β-actin(1 ∶1 000)及二抗(1 ∶5 000),发光检测,实验重复3次以上,利用Image J分析各条带灰度值。
1.3 统计学方法

2 结果
2.1 各组HPASMCs细胞增殖变化情况
与常氧组相比,低氧组HPASMCs细胞存活率显著升高,差异有统计学意义(P<0.05);与低氧组和NC-siRNA+低氧组相比,OPN-siRNA+低氧组HPASMCs细胞存活率显著降低,差异有统计学意义(P<0.05,见表2)。
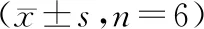
表2 各组HPASMCs细胞存活率变化
2.2 各组HPASMCs细胞凋亡变化情况
与常氧组HPASMCs细胞凋亡率相比,低氧组HPASMCs细胞凋亡率显著降低,差异有统计学意义(P<0.05);与低氧组和NC-siRNA+低氧组相比,OPN-siRNA+低氧组HPASMCs细胞凋亡率显著升高,差异有统计学意义(P<0.05,见表3、图1)。
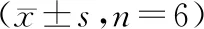
表3 各组HPASMCs细胞凋亡率比较

图1 各组HPASMCs细胞凋亡变化Figure 1 Apoptosis of HPASMCs in each group
2.3 各组HPASMCs细胞周期变化情况
与常氧组相比,低氧组HPASMCs细胞SubG1期、G0/G1期比例显著降低(P<0.05),G2/M期比例显著升高(P<0.05);与低氧组和NC-siRNA+低氧组相比,OPN-siRNA+低氧组HPASMCs细胞SubG1期、G0/G1期比例显著升高(P<0.05),G2/M期比例显著降低(P<0.05,见图2,表4)。
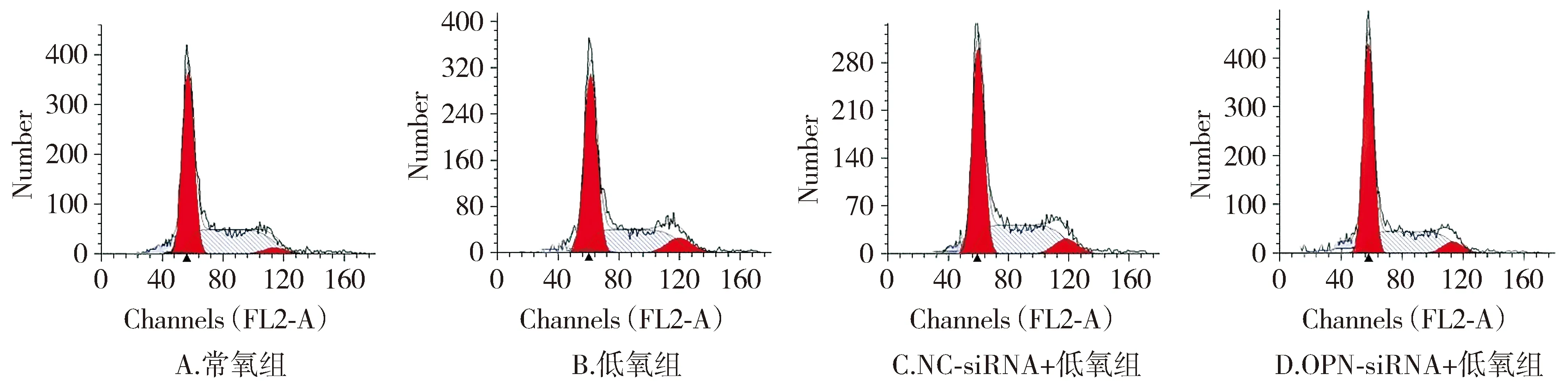
图2 各组HPASMCs细胞周期变化Figure 2 Changes of cell cycle of HPASMCs in each group

表4 各组间HPASMCs细胞SubG1期、G0/G1期、S期和G2/M期细胞百分比比较
2.4 各组HPASMCs细胞PCNA、Cyclin D1、Cyclin E和P27蛋白表达变化
与常氧组相比,低氧组HPASMCs细胞PCNA、Cyclin D1和Cyclin E蛋白表达均显著升高(P<0.05),P27蛋白表达显著降低(P<0.05);与低氧组和NC-siRNA+低氧组相比,OPN-siRNA+低氧组HPASMCs细胞PCNA、Cyclin D1和Cyclin E蛋白表达均显著降低,差异有统计学意义(P<0.05),P27蛋白表达显著降低(P<0.05,见图3,表5)。
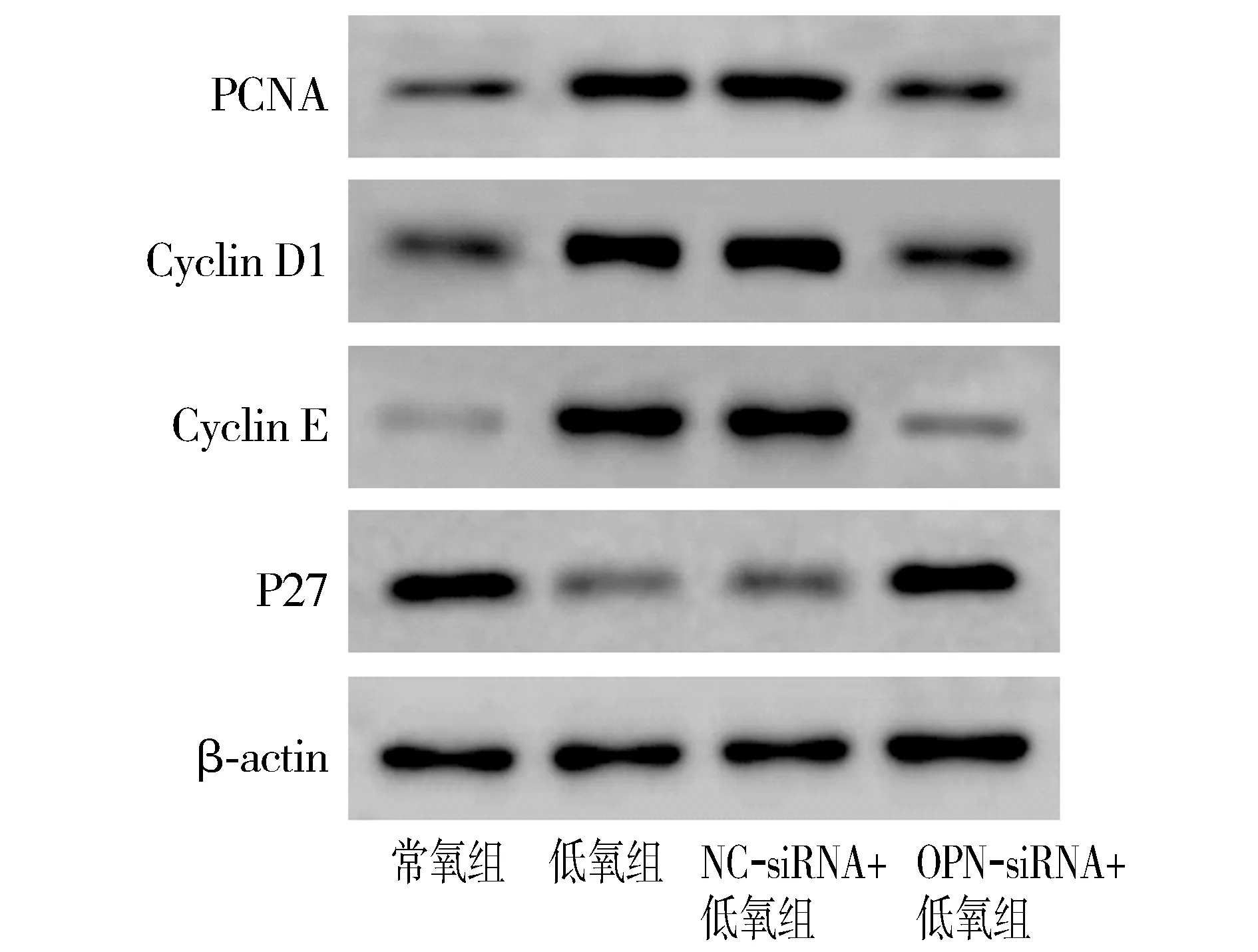
图3 各组HPASMCs细胞中PCNA、Cyclin D1、Cyclin E和P27蛋白的表达Figure 3 Expression of PCNA, Cyclin D1, Cyclin E and P27 proteins in HPASMCs in each group
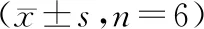
表5 各组间HPASMCs细胞中PCNA、Cyclin D1、Cyclin E和P27蛋白表达比较
2.5 各组HPASMCs细胞OPN和CD44 mRNA表达情况
与常氧组相比,低氧组HPASMCs细胞OPN和CD44 mRNA表达均显著升高,差异有统计学意义(P<0.05);与低氧组和NC-siRNA+低氧组相比,OPN-siRNA+低氧组HPASMCs细胞OPN和CD44 mRNA相对水平均显著降低,差异有统计学意义(P<0.05,见表6)。
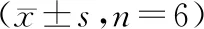
表6 各组间HPASMCs细胞OPN和CD44 mRNA相对水平比较
2.6 各组HPASMCs细胞OPN和CD44蛋白表达变化
与常氧组相比,低氧组HPASMCs细胞OPN和CD44蛋白表达均显著升高,差异有统计学意义(P<0.05);与低氧组和NC-siRNA+低氧组相比,OPN-siRNA+低氧组HPASMCs细胞OPN和CD44蛋白表达均显著降低,差异有统计学意义(P<0.05,见图4,表7)。

图4 各组HPASMCs细胞中OPN、CD44、β-actin蛋白的表达Figure 4 Expression of OPN, CD44, β-actin proteins in HPASMCs

表7 各组间HPASMCs细胞中OPN、CD44蛋白表达比较
3 讨论
PAH发病机制复杂,具有较高的致残率和病死率,严重影响患者的生活质量[7]。随着对PAH病理机制的深入研究,临床上出现的PAH靶向治疗药物改善了PAH的治疗效果,但PAH预后仍较差[8]。PAH作为一种快速进展的疾病,不断完善其分子机制,可能有益于改善PAH临床治疗。此外,在机体低氧刺激下,肺血管会发生过度收缩和结构重塑异常,从而增加肺循环阻力和肺动脉压力,导致不可逆PAH发生[9]。研究显示,体外低氧持续诱导培养HPASMCs细胞是体外模拟肺动脉高压模型的经典模型,能够引起HPASMCs细胞的恶性增殖[10,11],因此本实验选择该模型进行初步探索。
Zhu等[12]发现,缺氧不仅诱导HPASMCs异常增殖,而且抑制凋亡发生。本研究结果显示,持续低氧诱导相较于常氧培养能够增强HPASMCs细胞增殖活性、抑制凋亡发生,提示模型建立成功。另有研究显示,抑制HPASMCs细胞增殖和DNA合成,阻断细胞周期从G0/G1到S期进程,提高凋亡率可能有助于对PAH发挥保护作用[13]。进一步周期检测发现,低氧组HPASMCs细胞SubG1期比例相较于常氧组显著降低,这与凋亡结果一致,而G0/G1期比例显著降低,G2/M期比例显著升高,提示低氧诱导促进HPASMCs细胞中DNA分裂。增殖细胞核抗原是DNA代谢的细胞中心,能够在DNA复制过程中采用环形结构促进DNA合成[14]。此外,周期相关蛋白Cyclin D1、Cyclin E参与调控细胞周期,而细胞周期蛋白依赖性激酶p27能够抑制细胞进入S期,抑制增殖发生[15]。本研究发现,低氧诱导使HPASMCs细胞中PCNA、Cyclin D1和Cyclin E蛋白表达显著升高,P27蛋白表达显著降低,进一步验证低氧条件下HPASMCs细胞异常增殖可能与干预细胞周期、DNA合成异常增加有关,但具体机制尚待明确。
OPN是一种具有酸性特征且富含天冬氨酸的高度磷酸化的多功能糖磷酸蛋白,在心血管疾病、癌症、糖尿病和肾结石疾病以及炎症、生物矿化、细胞增殖和伤口愈合过程中具有重要功能[16,17]。在大鼠成骨细胞中,促进OPN mRNA和蛋白表达可能有利于增强成骨细胞增殖活性[18]。OPN表达于各种细胞中,可以通过抑制细胞凋亡调节细胞存活[19]。CD44是常见的细胞黏附分子,已被公认可作为癌症干细胞标记物,并能够与细胞外基质成分OPN结合在肿瘤发生发展中发挥作用[20]。本研究结果显示,低氧状态下HPASMCs细胞OPN和CD44 mRNA和蛋白表达相较于常氧组显著升高,提示低氧状态下HPASMCs细胞活性增强可能与促进OPN和CD44表达相关。
近年来相关研究发现,OPN可通过整联蛋白和CD44发出信号,在疾病或慢性炎症中高度上调参与病理生理过程,并与新血管生成密切相关[21]。Cao等[22]研究发现,大鼠主动脉平滑肌细胞(rat aortic smooth muscle cells,RASMCs)增殖可能与OPN高表达相关,通过siRNA敲低OPN表达,能够将RASMCs细胞周期阻滞在G0/G1期。本研究通过siRNA介导敲低OPN表达,结果显示,与低氧组和NC-siRNA+低氧组HPASMCs细胞相比,OPN-siRNA+低氧组HPASMCs细胞OPN、CD44 mRNA和蛋白表达、存活率、G2/M期比例、PCNA、Cyclin D1、Cyclin E蛋白表达显著降低,凋亡率、SubG1期、G0/G1期比例、P27蛋白表达显著升高,提示敲低OPN表达水平,能够抑制低氧诱导下HPASMCs细胞中CD44表达及细胞增殖,抑制周期相关蛋白表达,将细胞周期阻滞在G0/G1期,促进细胞凋亡,表明抑制OPN表达,能够抑制低氧诱导下HPASMCs细胞中CD44表达,逆转低氧诱导的细胞异常增殖,推测OPN可能是PAH治疗的潜在分子靶标。
综上所述,敲低OPN表达可能通过抑制CD44表达,将细胞周期阻滞在G0/G1期,抑制低氧诱导的HPASMCs细胞恶性增殖,促进其凋亡,这些发现可能为揭示PAH分子基础及PAH临床治疗干预提供新思路。然而,PAH发病机制复杂,仅凭体外研究,证据尚不充分,还需要进一步联合动物模型和临床试验进行更深入的探索。
