模拟失重对大鼠听功能及耳蜗带状突触的影响
2021-06-18李元超屈昌北李保卫韩浩伦
李元超,吴 玮,3*,王 刚,屈昌北,王 磊,李保卫,韩浩伦,李 丹,刘 钢
(1北京大学解放军306医院教学医院耳鼻咽喉科,北京 100101;2中国人民解放军战略支援部队特色医学中心耳鼻咽喉科;3国家环境保护环境感官应激与健康重点实验室;4首都医科大学公共卫生学院;*通讯作者,E-mail:ent306ww@126.com;#共同通讯作者,E-mail:wanggang306yy@126.com)
内毛细胞带状突触(ribbon synapses,RS),即内毛细胞(inner hair cell,IHC)与Ⅰ型螺旋神经元(spiral ganglion neurons,SGNs)形成的突触,因前膜活化区内锚定有含C末端结合蛋白2(C-terminal binding protein 2,CtBP2)的特定结构——带状体得名,每个IHC可通过带状体与多个SGNs形成RS,由其负责完成声信号的机械-电换能过程并向中枢方向传导,对声音的编码具有决定性作用[1]。RS对多种理化因素都非常敏感,易受噪声、耳毒性药物以及衰老等影响发生损伤且难以恢复[2]。失重可导致航天性听损伤,表现为听性脑干反应(auditory brainstem response,ABR)阈值暂时性、甚至永久性阈移,严重时可增加宇航员执行任务的失败风险、缩短职业寿命[3,4]。有学者在模拟失重大鼠海马组织中观察到突触活动区范围明显减少[5]。但耳蜗RS是否会受到失重影响而发生改变尚不明确。因此,本研究通过观察模拟失重后大鼠听功能及突触带状体数量的变化,探讨失重对听觉器官的损伤机制。
1 材料与方法
1.1 实验动物及分组
48只8周龄雄性SD大鼠(购自斯贝福公司)随机均分为模拟失重组和空白对照组,每组24只;再依据暴露时间随机分为1周、4周组,每组12只24耳。模拟失重组大鼠暴露期间始终保持模拟失重状态;空白对照组常规饲养。在暴露前(B0)、暴露结束后即刻(P0)和脱离暴露环境7 d(P7)进行双耳ABR阈值和畸变产物耳声发射(distortion product otoacoustic emission,DPOAE)检测,并在P0和P7测听结束后分别处死每组6只大鼠,再解剖分离双侧耳蜗。P7时各组测听耳数减半,为12耳。实验前所有大鼠均无噪声及耳毒性药物接触史,双侧耳廓、外耳道及鼓膜未见异常。
1.2 模拟失重方法
采用经典的头低位模拟失重法(Morey Holton法)[6]:大鼠头低位、前肢承受部分重量,后肢离地,身体纵轴与水平面成-30°。悬吊期间大鼠可以自由进食水,头部可自由活动。
1.3 听力学检测
1.3.1 ABR阈值检测 分别于B0、P0、P7时,采用10%水合氯醛溶液4 ml/kg腹腔注射麻醉大鼠,置于37 ℃恒温电热毯上,使用听性脑干反应仪(ICS Chartr EP,Medsen)在隔声静电屏蔽室内检测双耳ABR阈值。刺激声为短声(click),强度为80-5 dB连续测定,衰减间隔10 dB,接近阈值时改为5 dB,以可以重复的Ⅲ波的最低强度为阈值。
1.3.2 DPOAE检测 选择初始纯音的频率f1和f2,频率比f2/f1=1.21;初始音强度L1和L2,强度差L1-L2=10 dB声压级(sound pressure level,SPL)。以两个初始音频率的几何均数f0为测试频率,叠加1 024次,取2f1-f2处声信号幅值与本底噪声差值>6为DPOAE引出,选择f0分别为2,4,8 kHz,测试耳在所有测试频率上的DPOAE全部引出时方可记为DPOAE通过。
1.4 RS免疫荧光染色检测
分离的耳蜗采用4%多聚甲醛固定、10%EDTA脱钙处理后,在解剖显微镜下剥离基底膜。于10%山羊血清37 ℃封闭后,采用兔CtBP2抗体(Abcam公司,稀释比例1 ∶400)4 ℃孵育过夜,山羊抗兔IgG二抗(Abcam公司,稀释比例1 ∶400)室温孵育1 h;DAPI染色,在体视显微镜下铺片,抗荧光猝灭封片剂封片。激光共聚焦显微镜(Leica TCS-SP8)下观察并对突触带状体进行计数,评估RS损伤情况。
1.5 耳蜗RS计数
参考Viberg的方法,在计数时以顶回为0%,底回为100%,整个基底膜从顶回至底回分段计数,按照距顶端平均距离共取10个计数段。每个计数段用40倍(oil)物镜拍摄,然后在其中选取边长145 μm的正方形为计数视野,每个视野计数13-18个相连的IHC细胞核及RS数量,最后依据整个基底膜样本观察到的突触总数和IHC总数计算整个基底膜上平均每个IHC的带状体数量(个/IHC)[7]。
1.6 统计学方法

2 结果
2.1 ABR阈值结果
各实验组在B0、P0、P7时的ABR阈值见表1。B0时空白对照1周组、模拟失重1周组、空白对照4周组和模拟失重4周组间ABR阈值差异无统计学意义;空白对照1周组和空白对照4周组内在B0、P0、P7时ABR阈值差异均无统计学意义(P>0.05)。模拟失重1周和模拟失重4周组在P0时的ABR阈值较B0时显著升高(P=0.001,P<0.001),且模拟失重4周组ABR阈值高于模拟失重1周组(P=0.001)。模拟失重1周和4周组大鼠在P7时的ABR阈值较B0时差异均无统计学意义(P分别为0.833,0.955)。

表1 各组暴露前(B0)、暴露结束后即刻(P0)及脱离暴露环境7 d(P7)ABR阈值
2.2 DPOAE结果
各组间大鼠在B0、P0和P7时的DPOAE引出率差异无统计学意义(P>0.05,见表2)。
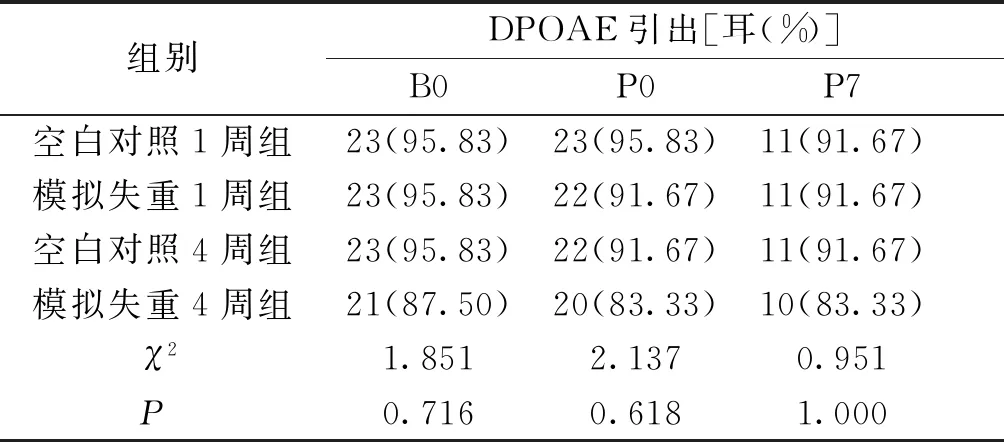
表2 各组暴露前(B0)、暴露结束后即刻(P0)及脱离暴露环境7 d(P7)DPOAE引出情况
2.3 免疫荧光结果
模拟失重后大鼠耳蜗IHC细胞核移位、排列散乱,至P7时有所恢复(见图1)。各组大鼠突触计数结果见表3。模拟失重1周组在P0时带状体数量较空白对照1周组下降53.23%,到P7时该组带状体数量仍比空白对照1周组低31.61%;而模拟失重4周组在P0时的带状体数量较空白对照4周组下降了61.19%,到P7时该组的带状体数量比空白对照4周组低39.12%。空白对照1周组在P0和P7时的带状体数量差异无统计学意义(P=0.074);空白对照4周组在P0和P7时的带状体数量差异也无统计学意义(P=0.295)。在P0时,模拟失重1周组较空白对照1周组、模拟失重4周组较空白对照4周组的突触带状体数量均明显减少(P<0.001),且模拟失重4周组大鼠P0时突触带状体数量减少较失重1周组更明显(P<0.001);模拟失重1周组和模拟失重4周组在P7时突触带状体数量均较P0时数量增多,且差异有统计学意义(P<0.001),但仍分别低于空白对照1周组和空白对照4周组(P<0.001),且模拟失重4周组低于模拟失重1周组(P<0.001)。
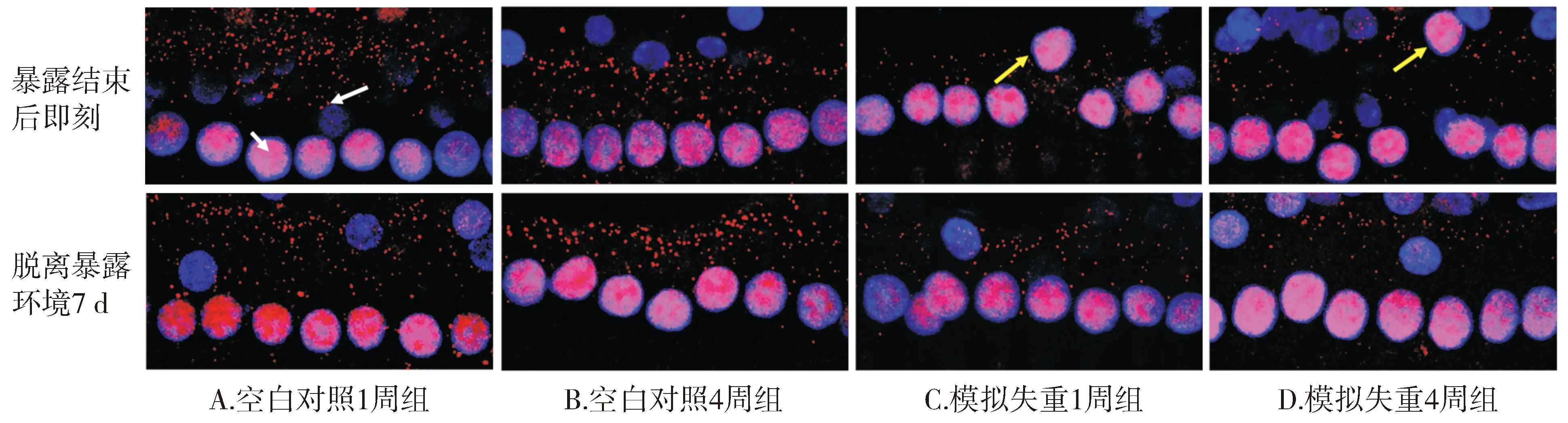
白色短箭头所示为IHC细胞核,白色长箭头表示CtBP2标记的突触带状体,黄色长箭头表示移位的IHC细胞核图1 各组大鼠免疫荧光染色结果Figure 1 Immunofluorescence staining results of rats in each group
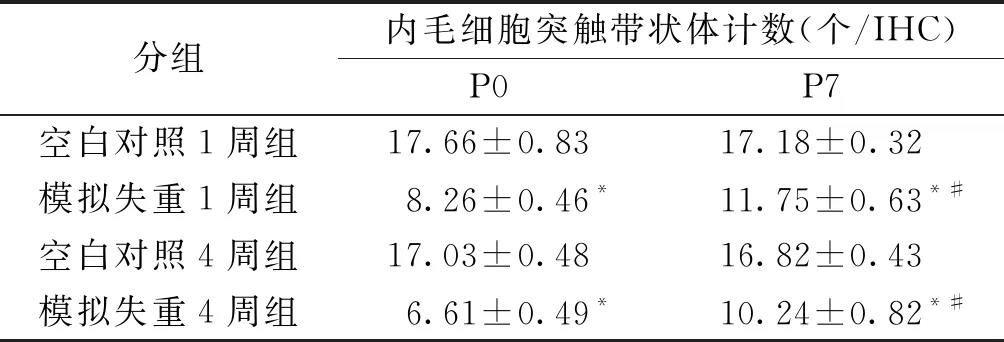
表3 各实验组P0、P7内毛细胞突触带状体计数
2.4 带状体数与ABR阈值相关性分析
对大鼠RS带状体数量与ABR阈值进行相关性分析,结果显示RS带状体数量与ABR阈值负相关(r=-0.759,P=0.029,见图2)。失重组大鼠ABR阈值在暴露结束后即刻最高,脱离暴露环境7 d后恢复至暴露前水平,而突触带状体数量在暴露结束后即刻到达最低水平,脱离暴露环境7 d后部分恢复。
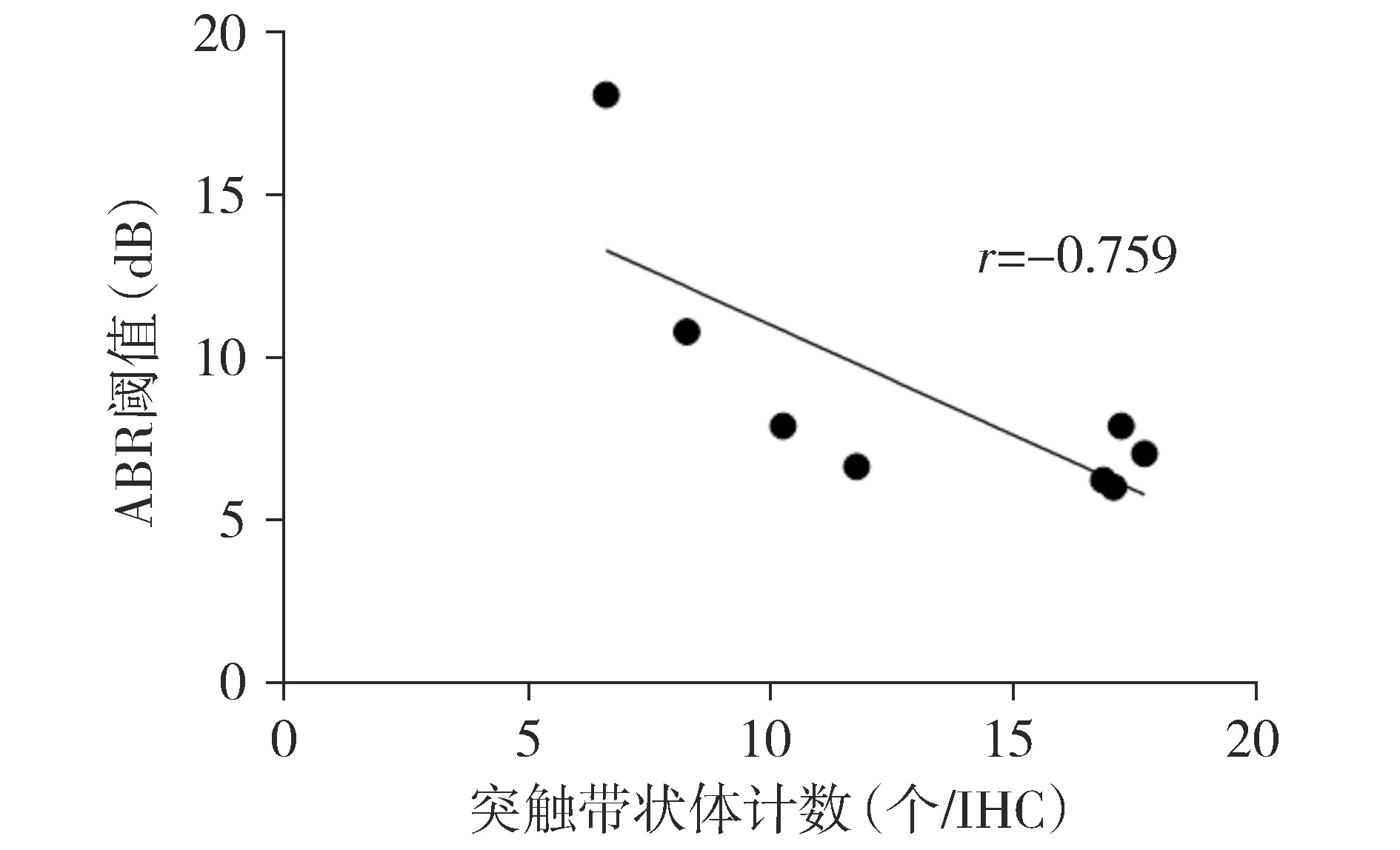
图2 突触带状体数量与ABR阈值相关性分析结果Figure 2 Correlation analysis between RS ribbon count and ABR threshold
3 讨论
天宫二号在轨飞行30 d任务圆满完成标志着中国人在太空的驻留时间记录刷新,较长时间太空飞行潜在的健康问题也受到更多关注。既往研究[8,9]表明模拟失重可引发听觉损伤,表现为ABR阈值升高;而损伤机制的研究主要集中于耳蜗毛细胞纤毛紊乱、凋亡和缺失等形态结构和数量的改变。本研究中模拟失重4周内大鼠ABR阈值随暴露时间延长而提高,且耳蜗IHC表现为核移位、排列散乱,但这些变化均可逆。在以上可逆性损伤之外是否存在听觉传入通路上其他敏感部位的损伤,是本研究重点关注的内容。
耳蜗RS因前膜活化区内锚定有含CtBP2的带状体得名。含神经递质谷氨酸的突触囊泡大量栓系在带状体表面,突触后膜上表达相应受体[1]。外界声音信号经过机械-电转化使突触前膜发生去极化,引起活化区CaV1.3L型钙通道开放、Ca2+内流触发谷氨酸释放,作用于突触后膜上的受体,引起突触后膜去极化,声信号开始在听神经上传导[10]。任何导致RS病变的因素均可造成其后的听神经纤维无法兴奋,损伤听功能。自Liberman等[11]提出噪声暴露原发性损伤耳蜗RS,而毛细胞缺失和SGNs退行性改变继发于RS损伤的观点以来,越来越多的研究[12-14]表明RS是听觉系统中对各种理化因素作用非常敏感的部位,其损伤或丢失常早于内、外毛细胞的损伤。邓子宣等[5]研究表明模拟失重2周大鼠CA1海马神经元的突触间隙和神经元活动区长度显著减少;王婷梅等[15]在尾吊4周大鼠的海马组织中发现突触后膜兴奋性离子型谷氨酸受体的表达明显下调。这些研究均表明失重对神经中枢突触造成损伤,而失重环境对耳蜗RS是否产生损伤及具体损伤表现缺乏报道。
本研究使用免疫荧光染色法,以CtBP2抗体标记耳蜗突触带状体并进行计数,评估模拟失重后的带状突触损伤。结果表明模拟失重可导致RS数量减少:模拟失重1周组突触带状体数量较空白对照组下降53.23%,模拟失重4周组带状体数量进一步减少,较空白对照组下降61.19%。目前认为各种理化因素损伤RS的机制可能有内耳缺血、活性氧、自由基损伤以及突触后Ca2+超载等[2,16]。模拟失重导致RS数量减少可能的机制主要有两方面;一方面,失重引起的体液头向分布可导致颅内压升高、内耳淋巴液容积增大[17],到达一定程度后血流减少,影响氧供和代谢,打破机体正常的氧化与抗氧化的平衡体系[18],在内耳可表现为大量的氧自由基蓄积造成损伤;另一方面,失重也会引起机体内多种细胞Ca2+浓度变化,导致细胞内钙稳态失衡,钙信号异常[19,20]。而耳蜗IHC的L型钙离子通道(CaV1.3)和Ca2+稳态对IHC发育和RS突触前膜的活跃必不可少,内毛细胞RS突触前膜CaV1.3开放、Ca2+内流是诱发突触囊泡与细胞膜融合、神经递质Glu释放的关键步骤[10]。若失重状态下IHC内的Ca2+浓度以及Ca2+通道电流改变,也可能导致RS数量变化。
脱离暴露环境7 d后突触带状体计数显示,模拟失重1周组和模拟失重4周组的带状体数量在P7时均有所恢复,但仍与空白对照组差异有统计学意义,提示模拟失重4周内可能已对RS造成了部分不可逆损伤。目前关于带状突触损伤的研究结果因暴露条件和研究对象而有差异,但均表明耳蜗内毛细胞RS是易损伤、难恢复的敏感结构[11-14,21]。哈佛大学的Liberman等[11]发现成年小鼠单次100 dB SPL噪声暴露2 h导致的ABR阈移虽然可以完全恢复,但带状突触数量却仅能恢复50%,并存在SGN的慢性退行性死亡;Furman等[21]研究表明106 dB SPL白噪声暴露2 h后的豚鼠,2周后ABR和DPOAE阈值完全恢复正常,但内毛细胞上有多达30%的突触缺失。这提示我们失重后RS损伤短期内虽然不伴有ABR阈值的永久性阈移,但其有限的自我修复能力可能对听觉系统造成继发性损伤。本研究显示模拟失重4周内的ABR阈移在脱离失重环境7 d后完全恢复,但RS数量仍存在39.12%的缺失,若RS数量不能随着恢复时间延长进一步增多,可能在远期造成继发性听损伤。
本研究对模拟失重环境后大鼠RS带状体数量变化进行了初步观察研究,明确了模拟失重会导致其数量减少,且脱离暴露环境后RS有一定程度的恢复,但恢复期设定较短,有必要在今后的研究中延长恢复期,明确远期的RS恢复程度及听功能水平。模拟失重导致的RS损伤对听功能影响的具体特点尚不明确,还需在下一步研究中结合反映RS功能的复合动作电位以及ABRⅠ波振幅、潜伏期等检测指标来确定。
