丹参提取物体外协同庆大霉素抗金黄色葡萄球菌的作用
2021-06-17崔玉梅陈峙峰张思琪邹宜诺邓旭明王建锋
崔玉梅,陈峙峰,张思琪,邹宜诺,邓旭明,王建锋*
(1.吉林大学 动物医学学院,吉林 长春 130062;2.长春西诺生物科技有限公司,吉林 长春 130062;3.吉林市丰满区小白山乡畜牧兽医站,吉林 吉林市 132000)
近年来,抗生素耐药性问题在养殖业日趋严重,动物养殖过程中产生的耐药菌的检出率不断增高,我国已经针对养殖业出台“禁抗、限抗和减抗”相关政策[1]。金黄色葡萄球菌简称金葡菌是临床上和动物养殖过程中最常见的多重耐药菌之一,如耐甲氧西林金葡菌(methicillin-resistantStaphylococcusaureus,MRSA)使大多数β-内酰胺类抗生素的治疗作用降低或消失,耐万古霉素金葡菌(vancomycin-resistantStaphylococcusaureus,VRSA)使治疗严重耐药菌感染的“最后一道防线”万古霉素失去疗效[2-3]。因此,临床上急需解决多重耐药金葡菌严重感染的问题。
氨基糖苷类抗生素具有化学性质稳定,易溶于水和口服不易吸收等特性被广泛应用于临床治疗严重细菌感染,该类抗生素抗菌谱广,对需氧型革兰阴性菌和金葡菌具有很好的杀灭作用[4]。庆大霉素作为我国自主研发的氨基糖苷类广谱抗生素已经在临床上使用多年,其可以与包括β-内酰胺类抗生素在内的多种抗生素联合使用治疗多种致病菌混合感染,对MRSA和VRSA等耐药金葡菌同样具有显著的治疗作用[5]。但近年来随着庆大霉素在临床上的大量使用,已经出现部分金葡菌对庆大霉素产生低度耐药[6]。金葡菌对庆大霉素耐药性在逐年增加,解决金葡菌对庆大霉素耐药迫在眉睫[7]。
丹参作为一味常用中药存在于多种处方中,其具有活血化瘀、改善肝肾功能和促进组织修复再生等多种药理学作用[8]。丹参注射液作为治疗心血管疾病的中成药已经在临床使用多年,其主要化学成分包括隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA和丹酚酸B等[9]。但丹参提取物与氨基糖苷类抗生素联合使用是否可以恢复抗生素对耐药金葡菌的抗菌活性至今鲜有报道,因此,开发中药丹参作为氨基糖苷类抗生素增效剂具有重大意义。
1 材料与方法
1.1 菌株本试验所用金葡菌USA300、USA400、ATCC25904、ATCC25923和ATCC29213均购自美国标准菌种保藏管理中心(ATCC),-80℃保存于本实验室。
1.2 药品与试剂丹参提取物由本实验室提取;隐丹参酮等标准品购自上海源叶生物科技有限公司;庆大霉素、链霉素、四环素、多黏菌素B和头孢噻吩等抗生素购自中国药品生物制品检定所;二甲基亚砜(DMSO)购自美国Sigma-Aldrich公司。
1.3 棋盘法最小抑菌浓度检测挑取固体TSB培养基上单个菌落于液体TSB培养基中过夜培养,次日,使用分光光度计将菌液D值调整至D600 nm=0.1,备用。将各受试抗生素、丹参提取物以及有效成分对照品(包括隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA和丹酚酸B)按照2倍连续稀释法在无菌96孔板中用MHB培养基连续倍比稀释,最后将调整后的菌液每孔加入1 μL,于37℃培养箱中静置培养16~24 h后通过肉眼观察各孔的浑浊程度来判定最小抑菌浓度(MIC)值,以抑制细菌生长的最小药物浓度作为该药对本株菌的MIC值[10]。
棋盘法是将2种药物按照横向从左到右,纵向从上至下进行2倍倍比稀释,根据二者联合后各浓度下的MIC来判定丹参提取物或其有效成分是否与抗生素具有协同作用。分级抑菌浓度(fractional inhibitory concentration,FIC) 指数判定标准如下:FIC指数<0.5为协同作用;0.5 ≤ FIC指数<1为相加作用;1
1.4 生长曲线将过夜培养的受试金葡菌培养物扩大培养至100 mL TSB培养基中,于37℃振荡培养至D600 nm值为0.3;将菌液分装至5个50 mL锥形瓶中,分为阳性对照组(菌液不做任何处理)和不同质量浓度药物处理组(32~256 mg/L,需减去药物本身D值)。分装好的培养菌液置于37℃恒温振荡培养箱中连续培养,每隔1 h取出分别测定D600 nm值,记录并绘制成曲线。
1.5 杀菌试验将过夜培养的受试金葡菌培养液调整至菌量为5×l05CFUs/mL (D600 nm=0.1时,1∶200稀释),备用。将调整后的菌液加入无菌96孔培养板中分为阳性对照组(不作处理)、单独抗生素组(1/4 MIC)、单独提取物(1/4 MIC)以及抗生素和提取物联用组,每组10个平行孔。对不同处理组进行菌液连续10倍倍比稀释涂板计数,作为0 h各处理组的菌落数。然后将96孔板置于37℃恒温培养箱中静止培养,在各时间点分别取对应孔内的菌液,涂板计数,绘制时间-杀菌曲线。
1.6 丹参提取物主要成分提取和含量测定
1.6.1丹参主要成分提取条件 丹参药材购自河南省亳州典世堂药业销售有限公司,参照文献[11]方法,取1 kg丹参药材粉碎后过3号筛,准确称取20 g丹参粉末,采用乙醇回流法进行提取,提取条件为80%乙醇体积分数,料液比为1∶10,提取2次,每次2 h。
1.6.2高效液相色谱条件 丹参酮类:色谱柱Agilnt C18,5 μmol/L,250.0 mm×4.6 mm,USA;流动相A为乙腈,B为0.1%磷酸溶液;流速1.0 mL/min;柱温20℃;进样量10 μL;梯度洗脱方法:0~6 min 61% A,6~20 min 61%→90% A,20~20.5 min 90%→61% A,20.5~25 min 61% A;检测波长:270 nm。
丹酚酸B:色谱柱Agilnt C18,5 μmol/L,250.0 mm×4.6 mm,USA;流动相乙腈-0.1%磷酸溶液(22∶78);流速1.2 mL/min;柱温20℃;进样量10 μL;检测波长286 nm。
1.7 丹参提取物对不同细胞毒性检测试验在含有10%胎牛血清的细胞培养液中分别传代培养的A549细胞、J774细胞和RAW264.7细胞通过胰酶消化脱离培养瓶,反复吹打混匀后对细胞进行计数。将100 μL的各细胞(2×104个/孔)分别接种于96孔板中,使每孔终体积为200 μL,然后将96孔板置于细胞培养箱中过夜培养。于次日弃去各孔中的培养基,无菌PBS溶液洗涤3次,然后每孔加入含有不同浓度丹参提取物的DMEM培养基200 μL,其中以含有0.2% Triton孔作为阳性对照,不作任何处理的孔作为阴性对照,置于37℃恒温培养箱中培养8 h。
将上述培养后的细胞1 000 r/min离心10 min,吸取各孔上清100 μL置于新的96孔板中;将配置好的LDH检测试剂按照1∶1加入上清中,避光反应15~30 min至阳性对照孔变成暗红色后,使用酶标仪测定D492 nm值,统计并计算各浓度条件下丹参提取物的细胞毒性。
1.8 丹参提取物对A549细胞由细菌介导损伤的保护作用挑取细菌固体培养基上的单个菌落于TSB肉汤培养基中过夜培养。传代培养至对数生长期,取菌液1 mL于4℃、5 000 r/min离心10 min。无菌PBS洗涤后DMEM培养基稀释菌液至D600 nm=0.1。将不同处理(包括丹参提取物处理组、庆大霉素处理组、联合处理组和阳性对照组)的细胞培养液加入A549细胞中培养6 h,吸出100 μL 上清液用于LDH检测。
弃去各孔中剩余培养基,PBS清洗3次,向96孔板中加入0.2% Triton×100裂解细胞,取20 μL使用10倍倍比稀释的细胞裂解液涂布于TSB固体培养基平板(含有2 mg/L 甲氧西林)上,于37℃条件下培养过夜,记录并统计不同组合处理后细胞裂解液中的菌落数。

2 结果
2.1 丹参提取物显著提高多种抗生素的抗菌作用通过棋盘法MIC测定丹参提取物与不同抗生素之间的协同效果,结果如图1和表1所示,丹参提取物可显著提高庆大霉素(FIC=0.31)、头孢噻吩钠(FIC=0.38)、硫酸多黏菌素B(FIC=0.38)和红霉素(FIC=0.38)对典型MRSA菌株USA300的抗菌作用,即丹参提取物与上述抗生素协同效果显著。而与氯霉素和四环素联合仅有相加作用或无效。
本研究进一步用庆大霉素与丹参提取物联合对多种不同金葡菌进行MIC检测,结果由图2可见,庆大霉素与丹参提取物联合对多种不同金葡菌均具有显著协同作用(FIC<0.5)(表1)。此外,研究发现丹参提取物对金葡菌ATCC25923具有良好的抗菌活性,其MIC值为64 mg/L。

表1 丹参提取物及其有效成分与不同抗生素的FIC值测定
为验证丹参提取物是否与所有氨基糖苷类抗生素具有上述显著协同效果,本试验选择了链霉素、卡那霉素、大观霉素和阿米卡星4种氨基糖苷类抗生素进一步与丹参提取物进行MIC检测,如图2和表1所示,丹参提取物与链霉素和卡那霉素协同效果显著(FIC<0.5),与阿米卡星和大观霉素只有相加作用(FIC=0.5)。

每个组合至少重复4次,各孔中出现肉眼可见细菌生长的次数越多,颜色越深

图2 丹参提取物联合氨基糖苷类抗生素对不同金葡菌的MIC
2.2 丹参提取物显著恢复庆大霉素对MRSA的杀菌作用通过生长曲线试验检测不同浓度的丹参提取物对金葡菌USA300和ATCC25904生长的影响,结果显示,丹参提取物在亚抑菌浓度条件下对受试金葡菌的生长无显著影响(图3A,B)。杀菌试验结果表明,1/4 MIC庆大霉素和1/4 MIC丹参提取物联合后在10 h之内可将培养基中的金葡菌全部杀死,而单独1/4 MIC庆大霉素和1/4 MIC丹参提取物均不能将金葡菌完全杀死(图3C,D)。
2.3 丹参提取物可提高庆大霉素对A549细胞由金葡菌介导损伤的保护作用丹参提取物对A549细胞、J774细胞和RAW264.7细胞毒性检测结果表明,丹参提取物质量浓度在512 mg/L及以下时,LDH释放量均低于25%,且该质量浓度远大于本研究中所使用的有效质量浓度(图4A~C)。如图4D所示,单独庆大霉素和丹参提取物处理后均可降低由金葡菌介导的细胞损伤,而且二者联合后效果更佳。与单独庆大霉素和丹参提取物处理相比,联合后细胞裂解液中细菌数量显著降低(图4E)。

不同质量浓度丹参提取物对金葡菌USA300(A)和ATCC25904(B)生长的影响;以及不同组合对金葡菌USA300(C)和ATCC25904(D)的杀菌效果检测
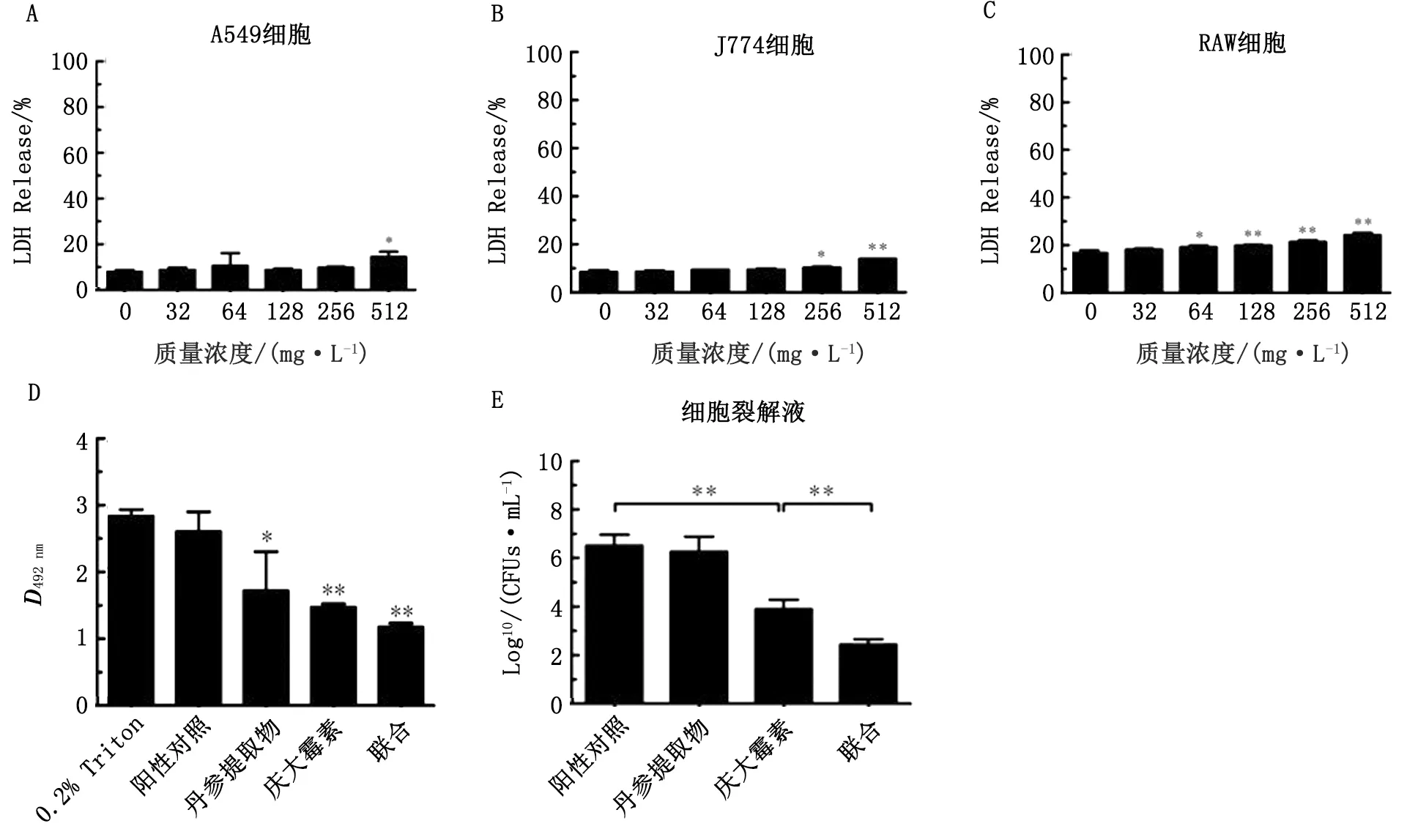
A~C.丹参提取物对不同细胞的细胞毒性检测;D.不同处理后A549细胞LDH释放检测;E.细胞裂解液中的金葡菌数,横线表示相对应的两个处理组进行差异性分析。*P<0.05;**P<0.01
2.4 丹参提取物有效成分与庆大霉素的协同作用对丹参提取物中的主要成分隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA和丹酚酸B进行了高效液相色谱法检测,如图5和表2所示,丹参提取物水溶性成分丹酚酸B的含量较高,而脂溶性成分(隐丹参酮、丹参酮Ⅰ和丹参酮ⅡA)的含量较低,隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA和丹酚酸B的含量分别为0.33%,0.05%,0.44%和9.02%。

图5 丹参提取物有效成分高效液相检测

表2 丹参提取物中主要化合物含量测定
将上述检测的4种有效成分联合庆大霉素进行MIC检测,结果显示,隐丹参酮和丹酚酸B与庆大霉素具有显著的协同效果(FIC<0.5),而丹参酮Ⅰ和丹参酮ⅡA无协同效果(图6)。
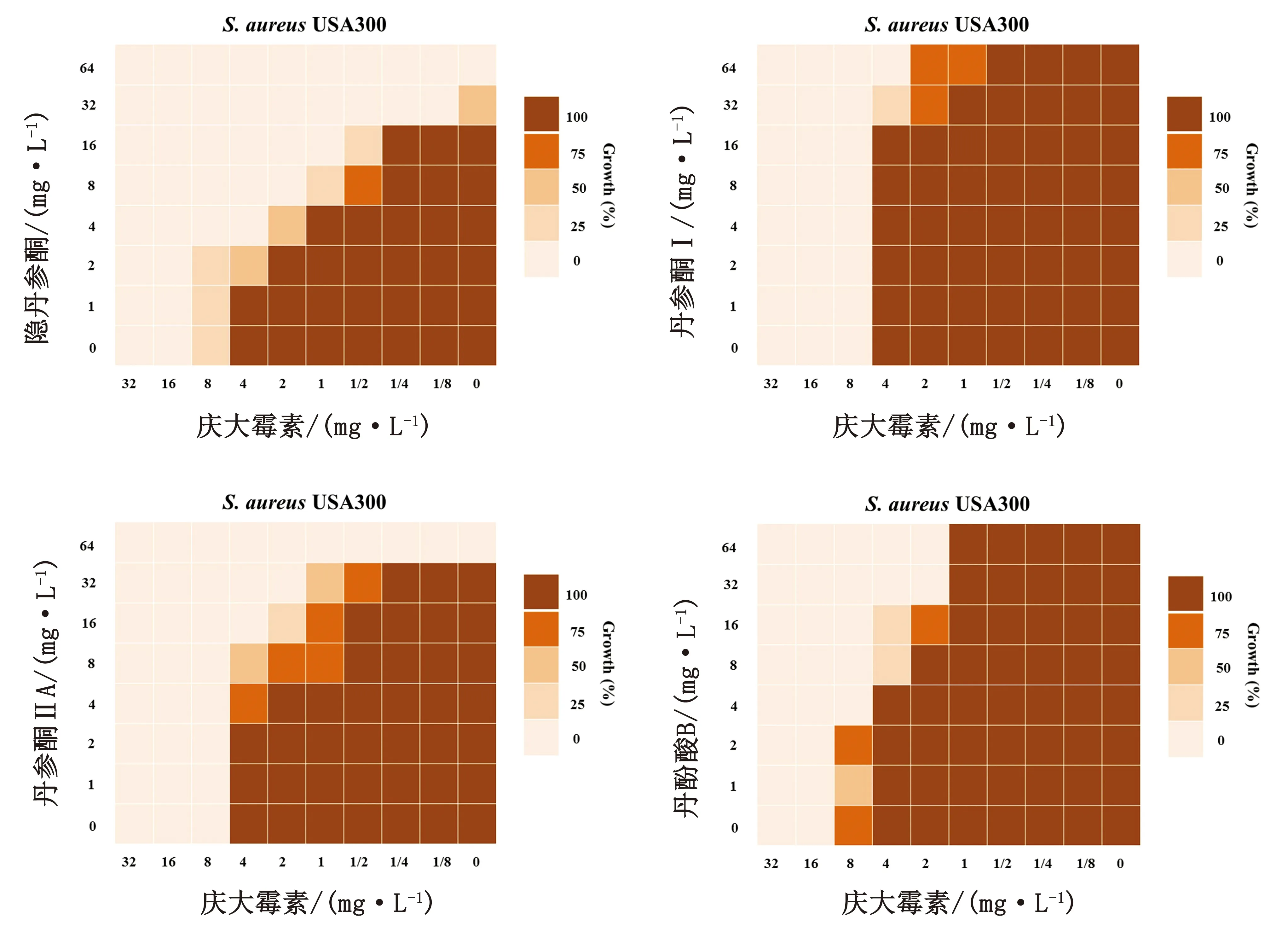
图6 丹参提取物主要成分联合庆大霉素对金葡菌USA300的MIC
3 讨论
目前,“老药新用”是针对临床上出现耐药菌感染的最快捷的策略。因为研发一种新型抗菌药物需要投入大量的时间和资金[12]。研究发现,丹参对部分革兰阳性菌具有潜在的抗菌效果,这主要是因为其所含的如丹参酮ⅡA、隐丹参酮和丹酚酸等多种化学成分具有抗菌作用[13]。这使得研究人员对丹参的有效成分丹参酮ⅡA等进行设计和合成,以期提高其抗菌活性[14]。至今为止,丹参提高氨基糖苷类抗生素对金葡菌的抗菌作用均未见报道。丹参是否可增强庆大霉素等氨基糖苷类抗生素对革兰阴性菌的抗菌作用需进一步验证。因此,本试验结果有助于扩大丹参的药理作用,为丹参增强氨基糖苷类抗生素抗菌作用机制研究奠定基础。
丹参的药理学作用广泛,毒副作用小,其已有注射剂和煎剂等剂型投入临床使用[15-18]。丹参的不同制剂通过不同给药途径进行急性和亚慢性毒性试验,小鼠、大鼠和家兔给予高剂量连续多日给药后均未出现毒性反应,未出现死亡情况,实质性器官未见病变,血液学和血液生化学指标正常,小鼠腹腔注射丹参注射液的半数致死剂量为6.3 g/kg,属于无毒[19-20]。这为丹参作为庆大霉素增效剂的研发奠定了毒理学和制剂研发基础。
本试验结果显示,丹参提取物有效成分隐丹参酮和丹酚酸与庆大霉素的协同效果显著,但略低于丹参提取物,提示这可能是因为丹参中的有效成分之间存在协同作用,或丹参中还有其他含量更低的化合物也同样发挥协同庆大霉素的作用。此外,隐丹参酮对金葡菌ATCC25923的抗菌作用较强(MIC=8 mg/L)。除本研究中检测的有效成分之外,丹参提取物中含有异隐丹参酮、羟基丹参酮ⅡA、丹参新酮、丹参酸甲酯、二氢丹参酮Ⅰ和鼠尾草酚等多种天然化合物,这些化合物是否具有更好的协同效果有待进一步研究[21]。
丹参“活血化瘀,退陈生新”的功效有助于抗生素在体内快速杀灭病原菌和降低庆大霉素等抗生素的毒副作用[22],因此,本研究为治疗临床耐药金葡菌感染提供了方案和策略。
