水貂细小病毒IgG抗体间接ELISA半定量检测方法的初步建立
2021-06-17朱翔宇蔡熙姮鲁荣光朱言柱廉士珍闫喜军
朱翔宇,蔡熙姮,鲁荣光,卜 研,柏 玲,朱言柱,廉士珍,白 雪,闫喜军,胡 博*
(1.中国农业科学院 特产研究所,吉林 长春 130112;2.农业农村部经济动物疫病重点实验室,吉林 长春 130112)
水貂细小病毒(mink enteritis virus,MEV)属于细小病毒科(Parvoviridae)、细小病毒属(Parvovirinae),是引起水貂病毒性肠炎的病原。水貂病毒性肠炎是一种急性、高度接触性,以剧烈腹泻为主要特征的严重危害养貂业的重要传染病之一[1-2]。1981年,姜延秀等[3]首次报道我国发现疑似水貂病毒性肠炎疫情,随后该病在国内各水貂养殖省份逐渐蔓延,给水貂养殖业造成巨大经济损失[4]。流行病学调查结果显示,水貂病毒性肠炎的暴发呈季节性、地方性和周期性等特点,且MEV具有强大的抵抗力,可以在兽笼和土壤中存活1年,病毒传播可通过直接接触感染水貂或间接接触污染饲养器具、工作人员和饲料等,另外还发现昆虫、鼠类和鸟类也可作为机械传播媒介进行传播[5]。水貂病毒性肠炎是养貂业的重点防控传染病之一,尚无特异性治疗方法,定期进行免疫接种是降低发病率和死亡率的有效手段,但是仍有新的MEV变异株的发现和流行,水貂病毒性肠炎的防控依旧面临严峻考验[6-7]。
细小病毒为无囊膜单链负股DNA病毒,基因组全长约5 000 bp,病毒基因组包含2个主要的开放式阅读框(ORF1和ORF2),3′端的为ORF1,编码DNA转录与复制所需的非结构蛋白(non-structure protein)NS1和NS2;另一个开放式阅读框为ORF2位于5′端,编码组成衣壳结构的结构蛋白(structure protein)VP1、VP2[8]。MEV在血清学上与同属的犬细小病毒(canine parvovirus,CPV)和猫泛白细胞减少症病毒(feline panleukopenia virus,FPV)存在交叉反应[9]。细小病毒的中和抗原表位主要位于VP2上,VP2基因全长1 755 bp,编码584个氨基酸,是组成病毒衣壳的主要成分,具有特殊的结构和免疫活性基团,编码细小病毒的主要抗原决定簇能够诱导机体产生中和抗体,可有效保护易感动物免受细小病毒感染[10]。
目前,国内还没有国家批准和市售的MEV血清学检测试剂盒。因此本研究通过引入伴侣蛋白重组载体与含His标签的VP2重组蛋白载体在大肠杆菌中共表达,将表达获得的可溶性目的蛋白作为包被抗原对水貂血清抗MEV抗体进行检测,并制备了阳性参考品作为参考,初步建立了检测水貂血清中特异性MEV IgG抗体水平的半定量间接ELISA方法,为研发相应的血清学诊断试剂奠定了基础,可应用于MEV疫苗免疫后抗体水平的监测和疫苗免疫效力的评价,对隐性感染或发病的动物进行早期、快速确诊及MEV的防控具有重要临床实践意义。
1 材料与方法
1.1 病毒及血清MEV MEVB株(FJ592174,105.5TCID50/0.1 mL)、水貂源MEV阴性抗血清、水貂源MEV阳性抗血清、水貂源犬瘟热病毒(canine distemper virus,CDV)阳性抗血清、水貂源阿留申病毒(Aleutian disease virus,ADV)阳性抗血清、小鼠源抗MEV腹水单抗、pET22b-VP2-Tf16重组表达质粒,均由中国农业科学院特产研究所农业农村部经济动物疫病重点实验室制备并保存。
1.2 主要试剂BCA蛋白定量试剂盒购自Thermo公司;His标签蛋白纯化试剂盒(可溶性蛋白)购自江苏康为世纪生物科技有限公司;Ni-NTA His-Band Resin,0.22 μm滤器购自Millipore公司产品;BL21(DE3)感受态细胞购自宝生物工程(大连)有限公司;IPTG购自北京全式金生物技术有限公司;脱脂乳购自BD公司;酪蛋白,TMB显色液购自Sigma公司;BSA,辣根过氧化酶(HRP)标记羊抗雪貂IgG(H+L)抗体购自KPL公司;氨苄青霉素、氯霉素、L-阿拉伯糖均购自生工生物工程(上海)股份有限公司。
1.3 VP2蛋白的制备将pET22b-VP2-Tf16重组质粒转入到感受态细胞E.coliBL21(DE3)中,以含有氨苄青霉素和氯霉素抗性的平板挑选阳性克隆菌落接种于含氨苄青霉素、氯霉素和L-阿拉伯糖的LB培养基中,37℃,200 r/min培养。当D600nm达到0.5~0.7时,加入IPTG到终浓度为0.2 mmol/L,25℃,160 r/min诱导培养16 h,同时设pET-22b载体空白对照、未加入IPTG的对照及未加入L-阿拉伯糖的对照。4℃、8 000×g离心20 min收集菌体后用PBS重悬,于冰浴上超声破碎菌体,4℃、12 000×g离心15 min,收集上清,经0.22 μm滤器过滤后按照His标签可溶性蛋白纯化试剂盒说明书的步骤进行可溶性蛋白的纯化。最后使用Elution buffer(20 mmol/L Tris-HCl,pH 7.9,500 mmol/L Imidazole)洗脱获得可溶性蛋白,使用BCA蛋白定量试剂盒测定蛋白浓度后-80℃保存。
1.4 MEV重组VP2蛋白间接ELISA检测方法的建立
1.4.1最佳抗原浓度和最佳样品稀释度的确定 采用棋盘滴定法对最佳抗原浓度及待检血清稀释度进行筛选,以pH=9.6的碳酸盐缓冲液作为包被液,稀释抗原至不同质量浓度(5.700,2.850,1.425,0.713,0.356,0.178 mg/L),每孔加入100 μL不同质量浓度的抗原包被酶标板,4℃条件下过夜包被。分别对MEV阳性血清、阴性血清进行梯度稀释(1∶10,1∶20,1∶40,1∶80),加样体积为每孔100 μL,进行ELISA试验以测定各孔D450 nm,设置复孔并以PBS为空白对照。通过计算相同稀释度的阳性血清和阴性血清之间的D450 nm比值(P/N值),选择P/N值最大孔的稀释倍数作为抗原和血清的最佳稀释浓度。
1.4.2最佳酶标抗体稀释度的确定 HRP Goat Anti-Ferret IgG(H+L)抗体分别以1∶500,1∶1 000,1∶2 000,1∶4 000,1∶8 000,1∶16 000进行稀释,测定各孔D450 nm,通过计算P/N值,确定酶标抗体最佳稀释度。
1.4.3最佳抗原包被条件的确定 将抗原分别于4℃ 12 h、37℃ 2 h条件下进行包被,每组设3个重复孔,测定各孔D450 nm,计算P/N值,以确定最佳包被条件。
1.4.4最佳封闭条件的确定 选取30 g/L BSA、1.5 g/L BSA、5 g/L脱脂乳,2.5 g/L脱脂乳、1 g/L酪蛋白和5 g/L羊血清作为封闭液,每孔加入300 μL,封闭时间分别设定为30,60,90,120 min,设置复孔,测定各孔D450 nm,通过计算P/N值,选择封闭最佳条件。
1.4.5待检血清和酶标抗体最佳孵育条件的确定 在室温(约22℃)和37℃条件下分别对待检血清进行孵育,设定时间为30,45,60,90 min,每组设2个重复孔,测定各孔D450 nm,计算P/N值,以确定待检血清的最佳孵育条件;酶标抗体最佳孵育条件的筛选设置同上。
1.4.6TMB显色反应时间的确定 在室温(约22℃)条件下设定不同显色时间,分别为5,10,15,20 min,对阳性血清和阴性血清进行ELISA检测,计算P/N值,以确定底物的最佳反应时间。
1.4.7阳性参考品的制备及阴阳性临界参考值的判定 将收集到的40份免疫后21 d的阳性血清(HI抗体效价为1∶128~1∶256,SN抗体效价为1∶512~1∶1 024)进行混合,采用饱和硫酸铵沉淀法进行抗体纯化[11]。制备阳性参考品,使用BCA试剂盒测得抗体最终浓度。将纯化后的抗体作为ELISA方法的阳性参考品,将其设定为100酶联免疫单位(EIU)。EIU的计算公式[12]如下:


1.4.8特异性试验 利用建立的间接ELISA方法分别对MEV阴阳性抗血清样品、水貂ADV阳性抗血清样品、水貂CDV阳性抗血清样品进行检测,以评估该方法的特异性。
1.4.9敏感性试验 通过检测连续稀释的MEV阳性参考品(约为100 EIU)和阳性血清(SN抗体效价为1∶1 024),将检测结果与阴阳性临界值进行对比,评估该方法的敏感性。连续稀释度分别为1∶40,1∶80,1∶160,1∶320,1∶640,1∶1 280,1∶2 560,1∶5 120,每个稀释倍数设置3个重复,测定各孔D450 nm,计算平均值和各个稀释度的浓度值。
1.4.10重复性试验 使用同一批次纯化的VP2蛋白包被的酶标板,随机选择5份水貂血清样品,重复测定3次,评价该方法的板内重复性;使用3个批次纯化的VP2蛋白包被的酶标板,随机选择5份水貂血清样品进行检测,重复测定3次,评价该方法的板间重复性。变异系数(CV)计算公式如下:

1.5 特异性IgG抗体水平与血清对MEV中和活性的比较参照文献[13]所述方法,应用微量中和试验(固定病毒-稀释血清法)检测免疫后不同时间采集的水貂血清对MEV的中和活性,利用Reed-Muench方法计算抗体中和效价,同时用建立的ELISA方法检测血清特异性IgG水平。x轴为血清中和抗体效价的对数(log2),y轴为ELISA方法检测结果计算所得的EIU水平,使用IBM SPSS Statistics 19.0软件通过回归分析法分析ELISA-IgG抗体水平与中和抗体水平之间的相关性。
2 结果
2.1 MEV抗体间接ELISA检测方法的优化
2.1.1抗原最佳包被质量浓度与血清最佳稀释倍数 如表1所示,随着抗原包被质量浓度的降低以及血清稀释倍数的增大,阳性血清的D450 nm不断降低,当抗原包被质量浓度为0.713,1.425 mg/L,血清稀释倍数为1∶80时,P/N值均处于峰值,考虑到包被蛋白在保存过程中可能会降解的问题,因此选择1.425 mg/L 作为抗原最佳包被质量浓度,血清最佳稀释倍数为1∶80。
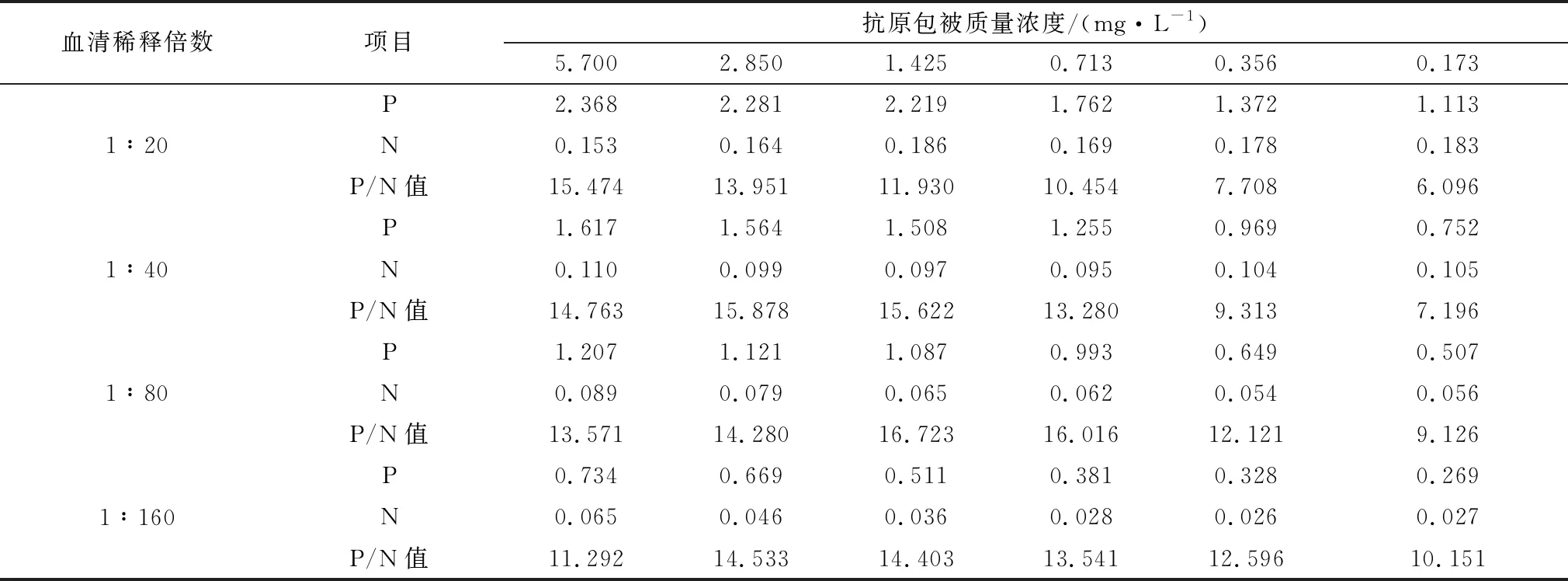
表1 最适包被质量浓度与血清稀释倍数的确定
2.1.2最佳酶标抗体稀释度的确定 选择不同质量浓度的包被抗原和不同稀释度的酶标抗体分别对阳性和阴性血清进行检测,结果如表2所示,在不同抗原包被质量浓度的条件下,酶标抗体稀释度为1∶2 000 时,P/N值均为峰值,因此酶标抗体最佳稀释度为1∶2 000。

表2 最佳酶标抗体稀释度的确定
2.1.3最佳抗原包被条件的确定 选择不同的包被条件对抗原进行包被,检测阳性和阴性血清D450 nm,计算P/N值。结果如表3所示,包被条件为4℃ 12 h时,P/N值最大,因此选择4℃ 12 h作为最佳包被条件。

表3 最佳抗原包被条件的确定
2.1.4最佳封闭条件的确定 选择不同的封闭液和封闭时间对包被的ELISA板进行封闭,并对阳性和阴性血清进行检测,结果如表4,当封闭液为50 g/L 脱脂奶粉,封闭90 min时P/N值最大,因此确定该ELISA检测方法中最佳封闭条件为50 g/L脱脂奶粉封闭90 min。

表4 最适封闭条件的确定
2.1.5待检血清和酶标抗体最佳孵育条件 在室温(约22℃)和37℃条件下分别对待检血清进行孵育,设定时间为30,45,60,90 min,对阳性血清和阴性血清进行ELISA检测。结果如表5所示,当待检血清于37℃孵育45 min时,P/N值最高,因此确定待检血清最佳孵育条件为37℃孵育45 min。
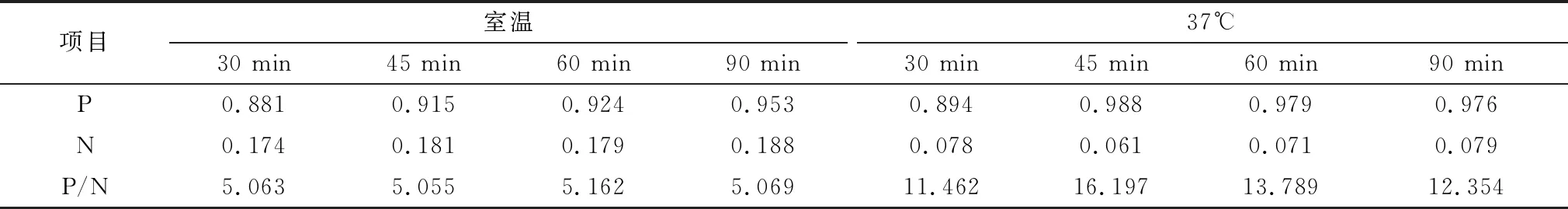
表5 待检血清最佳孵育条件的确定
在室温(约22℃)和37℃条件下分别对酶标抗体进行孵育,设定时间为30,45,60,90 min,对阳性血清和阴性血清进行ELISA检测。结果如表6所示,当酶标抗体于37℃条件下孵育45 min时,P/N值最高,因此确定酶标抗体最佳孵育条件为37℃孵育45 min。

表6 酶标抗体最佳孵育条件的确定
2.1.6TMB显色时间的确定 在室温(约22℃)条件下设定不同显色时间,分别为5,10,15,20 min,对阳性血清和阴性血清进行ELISA检测。结果如表7所示,当底物于室温条件下反应10 min时,P/N值最高,因此确定底物的最佳反应时间为10 min。
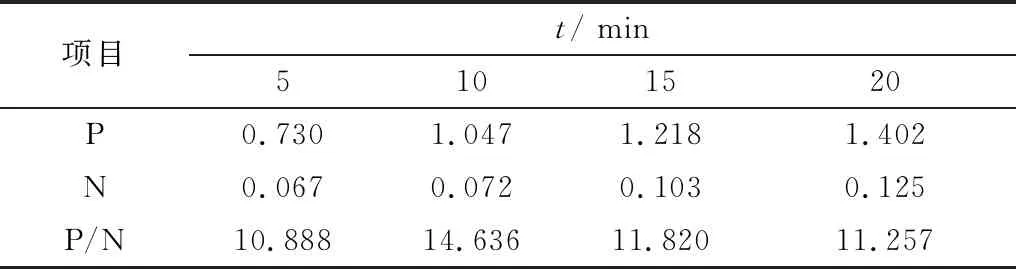
表7 TMB显色时间的确定
2.1.7优化后的间接ELISA操作步骤 MEV VP2蛋白抗原包被质量浓度为1.425 mg/L,包被条件为4℃ 12 h,包被液为0.05 mol/L的碳酸盐缓冲液(pH=9.6);洗板液为含1 mL/L吐温20的TBS缓冲液,洗板程序为350 μL/孔,静置1 min,洗板3次;封闭液为50 g/L的脱脂乳,300 μL/孔;封闭条件为37℃封闭1.5 h,洗板;待检血清样品1∶80稀释,100 μL/孔,37℃孵育45 min,洗板;酶标抗体1∶2 000 稀释,100 μL/孔,37℃孵育45 min,洗板;加入100 μL/孔TMB显色液,室温避光作用10 min;终止液为1 mol/L H2SO4100 μL/孔终止反应,在15 min内用酶标仪测定D450nm值。

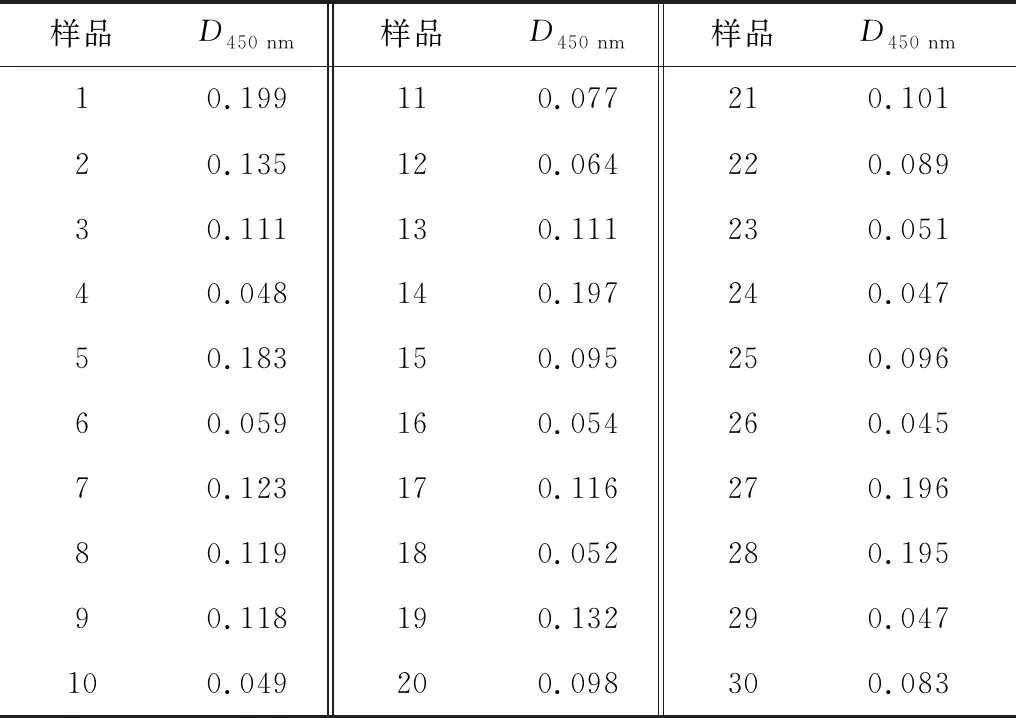
表8 阴性血清检测结果
2.3 间接ELISA的特异性试验利用建立的间接ELISA方法对水貂源CDV、ADV、MEV阳性抗血清及MEV阴性抗血清进行检测,结果显示,D450 nm值均低于14 EIU,说明该间接ELISA方法具有良好的特异性,与其他几种病毒阳性抗血清之间未产生交叉反应(图1)。

图1 间接ELISA的特异性试验
2.4 间接ELISA的敏感性试验利用建立的间接ELISA方法对连续稀释的阳性参考品和阳性血清进行检测,结果如图2所示,当阳性参考品和阳性血清经2 560倍稀释后D450 nm值大于14 EIU,判定为阳性,说明该间接ELISA方法具有良好的敏感性。

图2 间接ELISA的敏感性试验
2.5 间接ELISA的重复性试验利用建立的间接ELISA方法,随机选取5份水貂血清分别进行批内和批间重复性试验,对结果进行统计学分析。结果显示,批内和批间重复CV均小于5%(表9),表明该间接ELISA方法具有良好的重复性。

表9 间接ELISA重复性试验(n=5)
2.6 MEV特异性IgG抗体水平与血清HI效价的相关性使用IBM SPSS Statistics 19.0软件通过回归分析法分析ELISA-IgG抗体水平与中和抗体效价之间的相关性,可知ELISA-IgG抗体检测结果与中和抗体效价之间存在线性关系,呈显著性正相关(r=0.946 1,P<0.001)(图3)。

图3 血清中和抗体水平与IgG抗体水平相关性分析
3 讨论
用于包被固相载体的抗原按其来源不同可分为天然抗原、重组抗原和合成多肽抗原三大类。天然抗原可取自动物组织、微生物培养物等,须经提取纯化才能作包被用;重组抗原是抗原基因在质粒中表达的蛋白质抗原;合成多肽抗原是根据蛋白质抗原分子的某一抗原决定簇的氨基酸序列人工合成的多肽片段[14]。目前已建立的病毒抗体ELISA检测方法中,若以病毒作为包被抗原,需要大量细胞培养病毒并对病毒颗粒进行纯化,存在着病毒纯化操作复杂、制备成本较高、散毒风险、产率低且批次间病毒含量不稳定等问题。与细胞培养病毒和真核表达系统相比,原核表达系统在蛋白的融合表达中具有操作简单、成本低廉、表达量高、纯度高、纯化方式简易、可短时间大量制备且不易散毒等优点。
近年来,已有报道通过不同表达系统成功对MEV VP2蛋白进行表达[15-21]。有研究发现,在适宜的条件下,大肠杆菌表达系统获得的VP2蛋白能够通过自组装形成直径、结构与天然病毒粒子相似的VLPs,因此大肠杆菌表达系统表达的VP2蛋白具有广泛的应用价值[22],但完整的VP2基因难以在大肠杆菌表达系统中获得可溶性表达,目的蛋白多以包涵体形式存在[20,23]。分子伴侣可以通过抑制新生肽链不恰当的聚集,保证蛋白质形成正确构象,从而减少包涵体的形成[24]。分子伴侣蛋白可防止蛋白质在密集细胞环境中发生错误折叠和聚集,在健康和应激细胞中与蛋白质结合从而使其稳定折叠,并在发挥作用后自行离开目的蛋白[23],这些因素促使其成为了增加原核表达蛋白可溶性的重要手段。
分子伴侣质粒pTf16显著促进MEV VP2蛋白的可溶性表达[25],但是通过分子伴侣pTf16与目的蛋白共表达得到的可溶性蛋白量仍低于酵母表达系统的表达量[26-27]。因此,本研究选取分子伴侣pTf16与表达VP2基因的大肠杆菌载体融合共表达获得的可溶性重组VP2蛋白作为包被抗原,并成功建立了检测MEV IgG抗体的间接ELISA方法,与2009年陈涛等[15]建立的以截短VP2基因片段原核表达的包涵体蛋白为抗原的ELISA方法相比较,抗原的免疫原性更好,制备抗原的成本更低、方式更便捷,所建立的检测方法敏感性更高,更加适合成果转化。
本研究对建立的间接ELISA检测方法通过EIU的计算对样品中MEV ELISA-IgG抗体水平进行评估,并确定阴性和阳性临界参考值为14 EIU,当检测结果<14 EIU为抗体阴性,检测结果≥14 EIU为抗体阳性;若以MEV中和抗体为1∶32为保护临界值,当检测结果≥27.52 EIU时,免疫合格;当检测结果≥14 EIU且<27.52 EIU时,抗体没有达到免疫保护标准;特异性试验显示该间接ELISA方法对CDV、ADV阳性抗血清没有交叉反应,以重组VP2蛋白为诊断抗原具有良好的特异性;对标准品血清倍比稀释后进行检测,结果表明,阳性参考品经2 560倍稀释后仍为阳性,说明建立的间接ELISA方法敏感性良好;在批内和批间重复性试验中,CV均低于5%,说明该方法重复性良好。ELISA-IgG抗体检测结果与血清中MEV的中和抗体效价之间存在线性关系,呈显著性正相关(r=0.946 1,P<0.001),为ELISA方法替代HI试验和SN试验提供了数据支持,为养殖场动物群体的抗体长期监测工作及疫苗效价的评估等研究提供重要的技术方法。
近年来,随着科学技术的迅速发展,电化学发光免疫检测技术开始在定量免疫分析技术领域崭露头角,是一种结合经典免疫学与高科技电化学的第3代免疫分析技术,具有更广泛的研究和应用用途。Meso Scale Discovery公司研发的基于微孔板的ECL技术已经逐渐被应用于多价疫苗效价评估、中和抗体测定和免疫原性评估等方向[28-32]。
综上所述,本研究正确表达了具有生物学活性的可溶性MEV VP2蛋白,并成功建立了基于MEV VP2蛋白为检测抗原的间接ELISA检测方法,建立的MEV抗体ELISA方法可对疫苗免疫后的抗体水平进行半定量,可替代SN抗体水平评价疫苗的免疫效果。下一步可进行试剂盒组装和评价,应用于MEV免疫效果监测及MEV抗体的流行病学调查。
