河南省猪伪狂犬病病毒gC、gE基因组的克隆与遗传变异分析
2021-06-17孔令昊苗信永赵士杰徐朋丽孙杨扬崔志莹夏平安张宜娜
孔令昊,苗信永,赵士杰,李 闻,徐朋丽,孙杨扬,崔志莹,夏平安*,张宜娜*,吴 斌
(1.河南农业大学 动物医学学院,河南 郑州450002;2.华中农业大学 动物医学学院,湖北 武汉430070)
猪伪狂犬病(pseudorabies,PR)是由猪伪狂犬病病毒(pseudorabies virus,PRV)引起的一种猪急性、多种动物共患的接触性传染病,主要临床症状为发热、奇痒(猪除外)、神经症状;母猪出现不孕、流产、死胎等繁殖障碍;哺乳仔猪出现神经症状、麻痹、腹泻,最终引起死亡,死亡率高达100%,给我国养猪业造成了巨大的经济损失[1]。PRV只有1个血清型,但是不同毒株之间的毒力差异很大,其原因是毒力由多个基因控制[2]。PRV基因组全长约150 kb,GC含量高达73%。目前已经测定功能的PRV的糖蛋白主要有11种:gB(UL27)、gC(UL44)、gD(US6)、gE(US8)、gG(US4)、gH(UL22)、gK(UL53)、gI、gL(UL1)、gM、gN(UL49.5)。在病毒进入细胞的过程中,糖基化蛋白gB、gC、gD、gH和gL负责病毒附着于宿主细胞的表面和病毒的囊膜与细胞膜的融合。糖基化蛋白作为病毒粒子和被感染细胞的表面组成部分,是宿主免疫的主要靶标。其中gC糖蛋白可以与宿主细胞表面的硫酸乙酰肝素受体结合[3],而且能够激起宿主产生细胞免疫,是重要的中和抗原,也是亚单位疫苗的首选抗原之一[4-5]。gE糖蛋白属于囊膜蛋白,该蛋白可以显著影响病毒的毒力,与gI糖蛋白以非共价键的形式存在于感染细胞表面[6-7],在促进细胞间的融合,介导病毒在细胞之间的扩散以及病毒粒子的释放都发挥着巨大的作用。1947年在猫体内分离出PRV,证明我国存在该病毒[8],之后PRV在我国的报道越来越多。在20世纪70年代,我国引入Bartha-K61株疫苗后,我国的PRV得到了有效地控制[9],但在2011年末,我国使用PRV基因缺失苗免疫大部分地区的规模化养猪场出现大量疑似PRV病例,后续研究表明此次PR的暴发是由PRV变异毒株引起[10]。本研究通过双重PCR技术对河南省部分养猪场的PR流行情况进行调查,以及gC、gE遗传进化及序列分析比对,以期分析阐明我省不同地区PRV流行株的分子特征,为PRV的分子流行病学调查及病原学研究奠定基础。
1 材料与方法
1.1 主要试剂及病料样品来源胶回收试剂盒、柱式DNA提取试剂盒购自生工生物工程(上海)股份有限公司;DH-5α感受态细胞及质粒提取试剂盒购自北京康为世纪生物科技有限公司;pMD18-T载体购自宝生物工程(大连)有限公司;此次试验所用的2018-2020年期间河南省7个地区的307份病料样品由实验室保存及现场采集(表1)。

表1 河南省7个地区疑似病料来源信息
1.2 PRV的双重PCR检测参照GenBank收录的gB、gE全基因序列设计了2对检测引物P1/P2和P3/P4(引物序列及预计扩增长度如表2)。按照病毒DNA抽提试剂盒提取说明书提取组织DNA,建立双重PCR检测方法检测上述DNA。优化后反应程序为:95℃ 5 min;95℃ 1 min、56℃ 1 min、72℃ 30 s,35个循环;72℃ 5 min。
1.3 PRVgC/gE全基因组的克隆及测序参照GenBank收录的PRV全基因序列设计了PRV-gC/gE全基因引物P5/P6和P7/P8(引物序列及预计扩增长度如表2)。按照1.2的方法提取病毒DNA,PCR扩增反应程序为94℃ 5 min;98℃ 30 s、58℃ 30 s、68℃ 100 s,35个循环;68℃ 10 min。纯化回收PCR产物克隆于pMD18-T载体中,将重组的质粒送于生工生物工程(上海)股份有限公司进行测序。

表2 引物序列及预计扩增长度
1.4 PRVgC/gE全基因序列分析利用DNAStar软件对克隆的PRV-gC/gE基因序列和GenBank中选取的PRV代表株基因序列进行比较与分析。用MEGA 7.0软件进行遗传进化树的构建,采用Neighbor-Joining法,bootstrap值设为1 000。
2 结果
2.1 PRV-gC/gE全基因克隆结果分析使用表2的PRV-gC/gE全基因引物(P5/P6和P7/P8)对14株PRV进行PCR扩增,电泳结果显示,分别扩增出1 791,1 862 bp的特异性条带,与预期扩增片段长度一致(图1,2),测序结果表明已经成功克隆出PRV-gC/gE全基因。
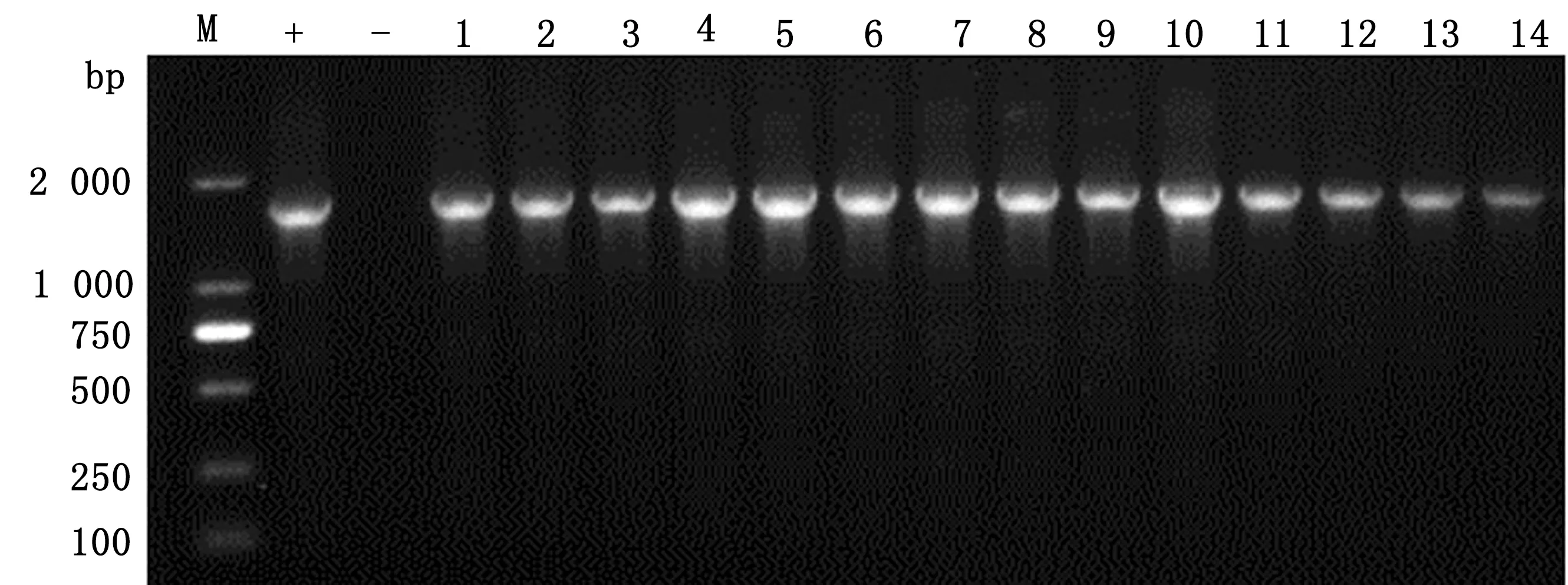
M.DL2000 DNA Marker;+.阳性对照;-.阴性对照;1~14.样品

M.DL2000 DNA Marker;1~14.样品;-.阴性对照
2.2 病毒分离株gC全基因序列遗传进化分析对分离得到的14株PRV以及25株来自国内外不同年代的PRV进行遗传进化分析,结果表明所有的PRV基因型分为2种:Group 1型主要为亚洲毒株;而Group 2型主要为欧洲和美洲毒株,也包括部分我国的HLJ-2013、NIA-2013毒株、19世纪90年代YamagataS-81日本毒株和19世纪90年代韩国分离测序的NYJ-1987毒株。Group1型还可以进一步分为3种基因亚型,以HN-2012毒株为代表的变异毒株组成了基因亚型Group 1.1;以Ea-1995毒株为代表的经典毒株组成了基因亚型Group 1.2;以Fa-1993毒株和马来西亚毒株P-Prv毒株组成了基因亚型Group 1.3。本研究分离得到的14株PRV中都位于基因亚型Group1.1(图3)。核苷酸序列分析结果表明,所分离的14株PRV之间的同源性为99.6%~100.0%,与国内变异毒株HeN1-2012、AnH1-2015、HB1201、DJY-2020同源性为99.8%~100.0%,与Ea-1995国内经典株的同源性为99.5%~99.7%,与马来西亚P-Prv-Budr7同源性为98.8%~99.0%;与国外经典毒株Bartha毒株同源性为94.7%~95.8%。其中国内4株变异毒株HN-2012、AnH1-2015、HB1201、DJY-2020的同源性为100%。氨基酸序列对比分析表明,与国内经典毒株Ea等毒株只有3处变异:N34T、K99E、E194G;与国内变异代表HN-2012毒株相比没有氨基酸变异或缺失;与国外经典毒株Bartha等经典毒株相比,本研究测序14株PRV均存在第63氨基酸位点处连续插入7个氨基酸(AAASTPA),并且gC全基因序列中存在30处氨基酸的替换。

注:▼为本研究分离的PRV。下同
2.3 病毒分离株gE全基因序列遗传进化分析为研究本研究测序的14株PRV的gE基因主要功能区的变异情况,与不同年代国内外分离的24株PRV的gE基因进行遗传进化分析及氨基酸序列对比分析。结果表明,所有PRV毒株表现2种基因型:Group1型也是主要为亚洲毒株,包括马来西亚的P-Prv-2008毒株;而Group 2型主要为欧洲和美洲毒株。Group 1型亚洲毒株又可以分为2种基因亚型,Group 1.1由HeN1-2012株为代表的变异毒株以及韩国YangSan-2003毒株组成,Group 1.2是以Ea-China、HUBEI-2016、GuangDong-2008等经典毒株以及马来西亚的P-Prv-2008毒株组成(图4)。本研究测序的14株PRV核苷酸序列分析结果表明,14株PRV之间核苷酸序列同源性为98.7%~100.0%,HN-619与另外13株PRV毒株同源性为98.7%~99.0%,其余13株为99.5%~100.0%;与国内变异毒株HeN1-2012、ANHUI2-2018同源性为98.7%~99.9%;与国外经典毒株Kaplan同源性为96.6%~97.7%。氨基酸序列比对分析结果表明:本研究的14株猪伪狂犬病毒中J32、J33 2株PRV毒株中在第169氨基酸位点处均存在4个氨基酸(DLNG)的连续缺失,且HN-619毒株在第823位氨基酸位点处存在(CL)2位氨基酸连续缺失。与国内经典毒株HeN1-2012、ANHUI2-2018相比本研究的14株PRV毒株存在自6处氨基酸突变:G54D、P403A、V450I、496D(插入)、G510S、S518P。与国外经典毒株Kaplan相比,本研究分离得到的14株PRV毒株存在23处氨基酸变异位点:48D(插入)、D54G、D63N、L106V、S122A、M149R、S179T、L181Q、A215L、D216A、A447G、I448V、R471G、H473R、496D(插入)、I502A、A507S、S510G、A520V、P524A、N751S、M575N、S576A。

图4 PRV-gE遗传进化树
3 讨论
PR是危害养猪业的最重要的传染病之一,给我国乃至世界养猪业造成了巨大的经济损失。猪PR主要引起母猪流产、死胎、木乃伊胎、尤其死胎最为严重[11]。研究表明,猪不仅是原发感染宿主,也是长期的病毒携带者和排毒者,对于病毒的传播起到了至关重要的作用[12]。Bartha-K61株基因缺失疫苗是目前市场上应用最广泛的基因缺失疫苗[13]。陈焕春等[14]研制出全病毒油乳灭活疫苗,又有人研制出基因缺失疫苗,为我国的PRV防控做出了突出的贡献[15-17]。然而在2011年,我国不同省份的多个猪场依然出现了PRV暴发的情况,主要表现为母猪流产和仔猪高死亡率,许多猪场的新生仔猪的死亡率高达100%,后续研究证明此次暴发为PRV变异毒株引起[18]。为掌握我省的伪狂犬当前的流行情况以及遗传关系,本研究对2018-2020年河南省部分地区的307份病料样品进行检测,共检测出14株PRV阳性病料,测序并进行遗传进化及序列对比分析。分析结果表明,本研究所分离的14株PRV之间gC、gE全基因核苷酸序列同源性为99.6%~100.0%和98.7%~100.0%,与国内变异毒株HeN1-2012核苷酸序列同源性为99.8%~100.0% 和98.7%~99.9%,与国外经典毒株的核苷酸序列同源性为94.7%~95.8%和96.6%~97.7%。结果显示,PRV与变异毒株HeN1-2012等属于同一基因亚型,且亲缘关系最为接近,与国内经典毒株Ea等株属同一分支,可以推测均来自国内最早的流行株,与国外经典毒株的亲缘关系相对较远。
本研究所测序的14株PRV在gC、gE蛋白氨基酸序列上均存在特征性变异位点。gC蛋白质是猪体免疫应答的主要靶目标,可诱导机体产生中和抗体[4],本研究测序的14株PRV与HeN1-2012等变异毒株的gC氨基酸序列相比,没有明显的变异,且与国内经典毒株Ea等的gC氨基酸序列相比只有3处变异:N34T、K99E、E194G。资料显示,病毒中和抗体的结合位点位于N端的65~99位氨基酸,且该区域存在2个肝素结合区域(76~81位、96~100位),特别是第1个位点,是介导体液免疫的潜在位点[19],在上述区域中,只有第99位氨基酸由谷氨酸变为赖氨酸;与国外经典毒株Bartha、Kaplan等经典毒株相比,本试验所测序的14株PRV的gC氨基酸序列上均存在第63位氨基酸位点处连续插入7个氨基酸(AAASTPA),并且存在30处氨基酸的替换,至于这些氨基酸的缺失/插入及突变对毒力的影响,还有待进一步研究。gE基因是PRV主要的毒力基因,该基因编码病毒的囊膜糖蛋白质,对病毒神经嗜性及神经毒性有重要影响[6]。其中,第125位的V和第126位的C被认为是决定病毒毒力的关键位点,缺失这2个位点对病毒毒力的影响与缺失整个gE蛋白质无异[20]。本研究测序的14株PRV与HeN1-2012等变异毒株的gE蛋白氨基酸序列相比,J32、J33 2株PRV毒株中在169氨基酸位点处均存在4个氨基酸(DLNG)的连续缺失。且HN-619毒株在第823位氨基酸位点处存在(CL)2位氨基酸连续缺失;gE蛋白质共有6个抗原表位区,其中5个位于N端胞外区的52~238位氨基酸[20]。已有研究表明,感染PRV后,猪体内产生的抗体大多数是针对E抗原表位区[21]。与国内经典毒株Ea等毒株相比,本研究测序的14株PRV毒株在gE氨基酸序列上存在6处氨基酸突变:G54D、P403A、V448I、497D(插入)、G510S、S518P,第448位氨基酸(V448I)的一致变异,但是对gE蛋白抗原表位并未产生影响[22],其中第54位氨基酸处于JACOBS等[20]预测的抗原表位区中,对蛋白的空间结构和功能影响不大,但是该位点甘氨酸突变为天冬氨酸和第497位天冬氨酸的插入,特别是第497位天冬氨酸的插入,可作为鉴定PRV变异株的分子特征,与遇秀玲等[10]和赵鸿远等[23]分离PRV毒株,在gE蛋白这2个位点附近也存在天冬氨酸的突变和插入的表述一致。与国外经典毒株Bartha、Kaplan等经典毒株相比,在gE蛋白氨基酸序列上,存在23处氨基酸变异位点。本试验的14株PRV中,HN-JZ45病毒拷贝数较其他毒株最高,在氨基酸序列分析中,只有第286,309位氨基酸变异;至于这些缺失/插入及突变对各毒力蛋白结构和功能的影响,还有待进一步研究。通过与国内流行变异毒株和国内外经典毒株氨基酸序列分析表明,PRV在gC、gE都有不同程度的氨基酸位点变异情况,这也能从分子水平上说明经典毒株的疫苗在临床上不能对猪群提供完全的免疫保护提供了参考。
同时本研究分离得到的14株PRV毒株分别来自河南省不同地区的不同猪场,PRV-gC全基因分析也能推测出河南省的PRV在gC、gE全蛋白氨基酸序列整体变异程度较小,也能为河南省在PRV的防控上提供理论基础。
