双侧肾上腺髓样脂肪瘤合并21α-羟化酶缺陷症1例
2021-06-17孟玫,焦健,刘洁,张鹏
孟 玫,焦 健,刘 洁,张 鹏
肾上腺髓样脂肪瘤(adrenal myelolipoma,AML)是来源于肾上腺皮质的罕见良性肿瘤,通常无分泌功能,其内主要包含成熟的脂肪细胞和造血组织。发病多为单侧,双侧发病且伴内分泌功能紊乱极少[1]。我院收治1例双侧巨大AML,本例伴有女性假两性畸形,实验室证实为单纯男性化型21α-羟化酶缺陷症(21α-hydroxylase deficiency,21-OHD)[2],临床极罕见,影像学检查和激素代谢检查对本病的临床诊治具有重要参考价值。
1 病例报告
1.1 一般资料 患者,女,45岁,2018年3月外院检查发现双侧肾上腺肿瘤,左侧瘤体较大(8 cm×7 cm×6 cm),行左侧肾上腺肿瘤全切,术后病理AML。右侧瘤体(7 cm×5 cm×3 cm)未行处理。2020-11-01因右腰部不适来我院入院诊治, CT检查示右肾上腺肿瘤,大小为11 cm×9 cm×8 cm,初步诊断为AML。体格检查:乳房Tanner分期3期,阴蒂明显增生肥大,阴唇融合,无尿道下裂,无月经来潮,余未见特殊。
1.2 实验室检查 术前血浆ACTH 50.54 pg/ml、血浆皮质醇102.20 nmol/l、血清睾酮128.79 ng/ml、ACTH激发实验17α-羟孕酮436.39 nmol/l、空腹血糖8~12 mmol/l,术后第2天,血浆ACTH 125.00 pg/ml、血浆皮质醇62.68 nmol/l、醛固酮(卧位)76.40 ng/l。
1.3 影像学检查 入院当天(11月1日)超声示右侧肾上腺11 cm×9 cm×8 cm较强回声包块,边界清,形态较规则,内回声不均,边缘见不规则低回声区。其内及周边未见明显血流信号,左侧肾上腺无显示(图1A)。11月5日CT平扫轴位,CT值-100~40 Hu,示右侧肾上腺区见椭圆形混杂密度肿块,以脂肪成份为主,其间有软组织样密度间隔,与右肾上腺关系密切,周围未见受侵征象,邻近腹腔无肿大淋巴结。左肾上腺因外院AML切除术后无显示。CT腹部增强检查斜冠状位图示右肾上腺肿块最大横径11 cm,肿块与右肾分界清楚,后者上极略受压,肿块内间隔明显强化,脂肪成份未强化,右肾上腺结构不规整(图1B、C)。CT三维成像清晰显示供血动脉(图1D、E)。
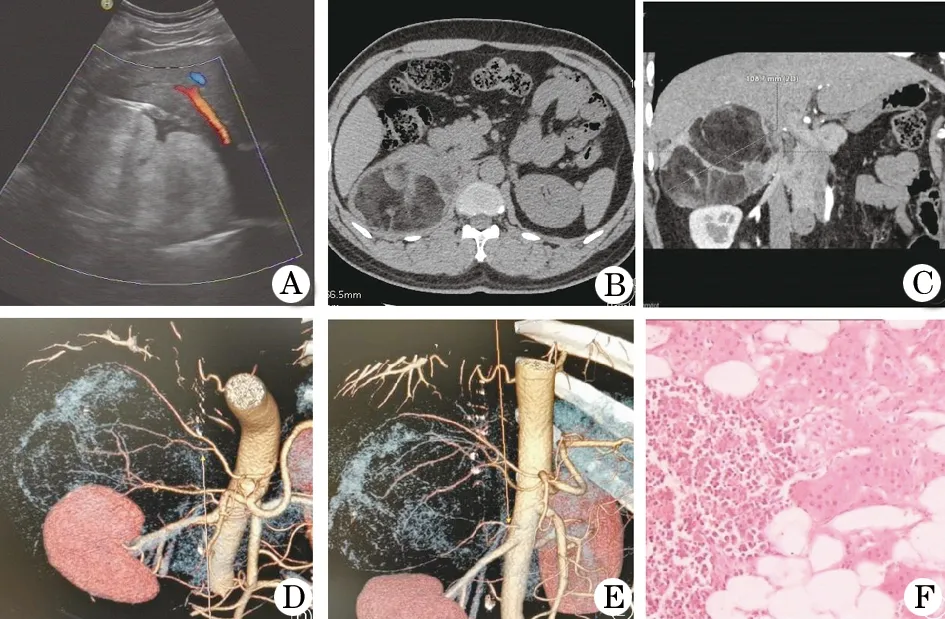
图1 双侧肾上腺髓样脂肪瘤合并21α-羟化酶缺陷症
1.4 治疗方法 因本例患者瘤体较大,有自发性出血风险,择期于11月12日行腹腔镜下右肾上腺肿瘤切除术。患者麻醉后取右侧卧位,腰垫起,术区消毒,取左腋中线髂骨上横切口,长约3 cm,切开皮肤,建立气腹,穿刺A、B、C三孔,进入器械,分离肾与肾周筋膜,显露右肾上极,暴露右肾上腺肿物10 cm×6 cm×6 cm,肿物周围与膈肌、腹膜黏连,超声刀分离肿物与周围组织,结扎夹切断肿瘤供血血管,完整切除肿物,保留部分正常肾上腺组织。右肾上腺渗血区填塞明胶海绵,检查后解除气腹。行右腰部斜切口10 cm,逐层切开腹壁,取出肿物,清点器械,放置引流管,缝合各切口,结束手术。术后病理显示AML(图1F)。术后患者血浆ACTH升高,合理激素替代治疗(氢化可的松注射液从150 mg逐渐减量至2 mg)并适当补钾(10%氯化钾注射液15 ml)、补充多种微量元素等积极应对治疗,血浆皮质醇、醛固酮(卧位)趋于正常范围,患者状态平稳。术后7 d出院。
2 讨 论
AML起源不清,推测发病机制是髓外造血、红细胞增多、骨髓栓塞、肾上腺毛细血管网状内皮细胞上皮化生(感染、慢性应激、炎性反应和坏死)和肾上腺皮质细胞变性[3]。最近细胞遗传学研究发现,AML是一种基于X染色体非随机失活的克隆肿瘤[4]。有报道AML常合并高血压、肥胖、糖尿病、动脉粥样硬化和恶性肿瘤[2],近年合并先天性肾上腺皮质增生的报道增加,而21-OHD是先天性肾上腺皮质增生的主要原因。21-OHD是由编码21α-羟化酶的CYP21A2基因突变造成此种酶缺乏而引起一系列内分泌紊乱的综合征。它是先天性肾上腺皮质增生的主要病因,按照酶活性损害程度,可分为典型和非典型,其中典型21-OHD根据醛固酮缺乏程度分为失盐型和单纯男性化型,单纯男性化型是女性假两性畸形最常见原因。临床多通过定量检测人血清中17α-羟孕酮的含量作为筛查21-OHD的敏感指标,一般将30 nmol/l作为阳性界值,但结果影响因素较多,行ACTH激发试验更准确。一般典型21-OHD的17α-羟孕酮超过300 nmol/l。2009年美国内分泌学会指南提出17α-羟孕酮升高是21-OHD的特异性诊断指标[5]。单纯男性化型21-OHD的21α-羟化酶不完全缺乏,体外活性可保留1%~2%。本例患者体格检查具有女性假两性畸形的特征表现,且实验室血清睾酮和17α-羟孕酮升高,无失盐表现,仅空腹血糖指标高,符合单纯男性化型21-OHD的表现。AML伴有内分泌紊乱的原因目前没有科学定论,近年偶有报道,虽机制未明确,但肿瘤切除后患者激素水平趋于正常[1,6]。AML的代谢性检查在2009年的指南[5]中没有提及,因此,有理由怀疑合并内分泌功能障碍的患者仅在AML患者中占7%[3]是被严重低估。美国放射学协会[7]和美国临床内分泌医师协会[8]分别在2017年和2019年将肾上腺偶发瘤的激素代谢检查作为常规检查内容。
大多数AML病例可通过影像学方法诊断[9],超声检查根据肿瘤内脂肪含量不同而表现为脂肪含量越高回声越强的声像学特点。MRI检查表现为高、低不等信号,依据肿瘤内脂肪和造血组织成份含量,表现不同的T1和T2加权信号。但CT对肿瘤内脂肪和造血成份的显示分辨率高,对肿块形态、毗邻及周围邻近组织情况了解全面,增强检查能明确显示供血动脉,所以对下一步手术治疗具有重要指导意义[4]。AML的CT影像特点以脂肪和造血组织混合比例不等的混杂密度肿块为主,无恶性肿瘤表现,偶伴钙化[10]。AML需要与肾上腺区其他含脂肪的肿块相鉴别,如肾上腺血管平滑肌脂肪瘤、腹膜后脂肪瘤、脂肪肉瘤、畸胎瘤、错构瘤、低密度肾上腺腺瘤等。鉴别关键在正确定位,再结合AML混杂密度且无恶性肿瘤表现及临床化验检查,一般不难区别。
对于肿瘤较小且无明显相关内分泌功能紊乱发生的AML多采取非手术治疗,但肿瘤较大,且有明显自觉症状,考虑肿瘤自发出血和潜在进行性生长的可能,建议行外科手术治疗[11]。本例患者双侧AML均较大,分别行手术治疗。右侧AML切除术采取腹腔镜切除,采用经腹膜后腔路径,该术式对腹腔脏器干扰小,脏器损伤风险低[12],手术获得成功。
总之,AML属于肾上腺偶发瘤,无症状者临床罕见,而CT或超声对肾上腺偶发瘤检出和定性具有关键作用[13]。本例患者双侧AML伴或不伴有内分泌代谢紊乱,影像学检查和激素代谢检查对本病的临床诊治具有重要参考价值。
