cN0期甲状腺乳头状癌中央区淋巴结转移的危险因素分析
2021-06-17张雪鹤高璐滢赵瑞娜黄雪培刘睿峰史新龙
张雪鹤,高璐滢,赵瑞娜,黄雪培,刘睿峰,史新龙,夏 宇
甲状腺癌是发病率最高的内分泌肿瘤,其中甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是最常见的病理类型,占70%~80%[1]。临床淋巴结阴性(clinical lymph node negative,cN0)PTC指的是临床医生在术前触诊或影像学检查(包括超声或CT等)中未发现异常肿大淋巴结,而这部分患者中有相当一部分在术后病理确认为中央区淋巴结转移(central lymph node metastasis,CLNM)[2]。目前对于存在CLNM的PTC患者,常规行中央区淋巴结清扫(central lymph node dissection,CND)得到国内外普遍认可,而对于cN0期的PTC患者,是否行预防性的中央区淋巴结清扫(prophylactic central lymph node dissection,PCND)还存在一定争议[3]。2015年美国甲状腺协会(American thyroid association,ATA)指南指出,超声检查是诊断甲状腺结节及区域淋巴结性质的首选方法[4]。但超声对于中央区转移淋巴结检出的敏感度为38%[5],主要原因为中央区淋巴结体积较小,位置较深,受气管以及食管内气体的影响较大,增加了超声医师的探查难度。所以,临床上单纯依靠超声检查评估中央区淋巴结转移情况是片面的。
能否找到有效的术前预测指标,减少不必要的清扫,降低并发症的发生,是超声医师及外科医师共同面临的难题。本研究选择2013-01至2015-12在北京协和医院术后病理确诊为PTC的患者4265例,通过回顾性分析cN0期PTC患者术前超声图像特征,结合临床资料,探讨中央区淋巴结转移的相关危险因素,以期为临床手术方式的选择提供参考。
1 资料与方法
1.1 一般资料 4265例中行双侧中央区淋巴结清扫且术前临床未发现淋巴结转移(cN0)的患者570例,男125例,女445例,年龄20~70岁,平均(44.1±1.6)岁;以手术病理结果是否发生CLNM为依据进行分组,发生CLNM的为CLNM组,未发生CLNM的为对照组,分析两组相关超声指标及临床资料的差异。纳入标准:(1)初次就诊为北京协和医院,且术后病理证实为PTC的患者;(2)术前未发现淋巴结转移,即符合cN0诊断标准;(3)手术切除范围为双侧腺体全切或次全切除+双侧中央区淋巴结清扫。排除标准:(1)临床资料不全者;(2)合并其它恶性肿瘤者。
1.2 仪器与方法
1.2.1 仪器 采用GE Logiq 9、Philips iU22 超声诊断仪,探头采用10~12 MHz的高频线阵探头。
1.2.2 超声诊断 患者平卧位,颈部略后仰,充分暴露颈部,多切面扫查甲状腺左、右叶及峡部,随时调节增益、深度、图像聚焦等相关参数,获取最佳成像效果,并用彩色多普勒技术观察结节内部及周边血流情况。具体观察内容包括:结节大小、数目、内部回声、是否存在微钙化、被膜侵犯、慢性淋巴细胞性甲状腺炎以及血流情况。着重观察可疑淋巴结所在的颈部分区、内部回声、淋巴门结构是否存在、血流及周边组织情况。
由2名经验丰富的医师对超声图像进行回顾,若二者意见不一致时讨论协商出最终判断。颈部淋巴结分区采用专家共识[6]提出的意见,中央区淋巴结为Ⅵ区和Ⅶ区,范围包括:上界为舌骨水平,下界为无名动脉上缘,两侧界为颈总动脉内侧缘。cN0的诊断标准参照文献[7]。
1.3 统计学处理 使用SPSS23.0进行数据分析,对超声图像特征与临床病理资料中可疑危险因素进行单因素分析,对具有统计学意义的变量进行二元Logistic回归分析方程;P<0.05为差异有统计学意义。
2 结 果
2.1 cN0期PTC患者发生CLNM的单因素分析 570例cN0患者中282例发生CLNM,转移率为49.5%(282/570)。单因素分析显示,男性组的CLNM发生率高于女性,年龄<45岁组CLNM发生率高于年龄≥45岁,肿瘤最大直径>1 cm组CLNM发生率高于肿瘤最大直径≤1 cm组,多发病灶组CLNM发生率高于单发病灶组,有微钙化组CLNM发生率高于无微钙化组,有被膜侵犯组CLNM发生率高于无被膜侵犯组,血流丰富组CLNM发生率高于少量血流组和无血流组,差异均有统计学意义(P<0.05)。而恶性肿瘤回声、囊实性、慢甲炎无统计学差异(表1)。

表1 cN0期 PTC患者发生CLNM的单因素分析 (n;%)
2.2 cN0期PTC患者发生CLNM的独立危险因素 将CLNM作为因变量,将上述单因素分析中具有统计学意义的变量纳入Logistic 回归模型。结果表明,男性、年龄<45岁、肿瘤最大径>1 cm、多发病灶、伴有微钙化(图1)、有被膜侵犯是cN0期PTC患者发生CLNM的独立危险因素(P<0.05),见表2。
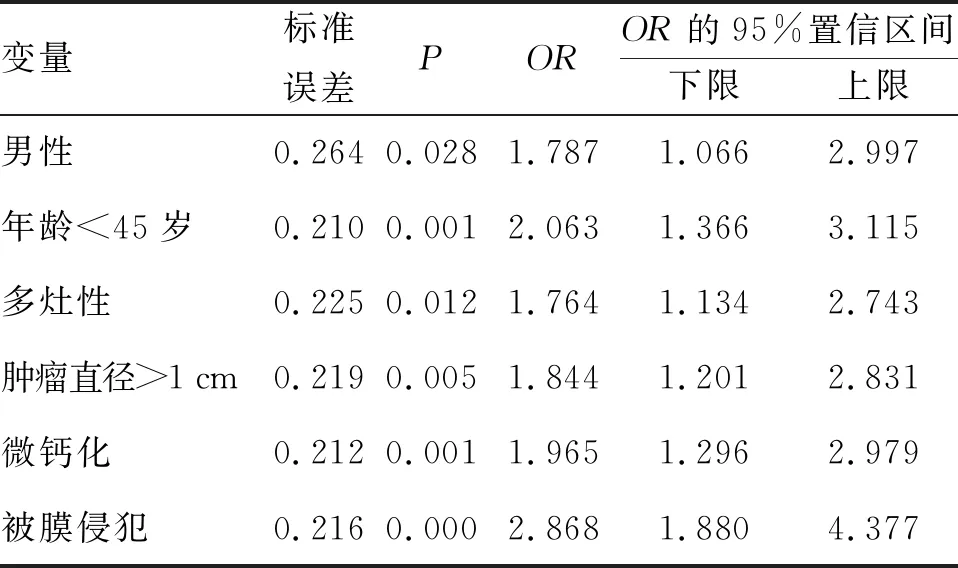
表2 cN0期 PTC患者发生CLNM 的独立危险因素
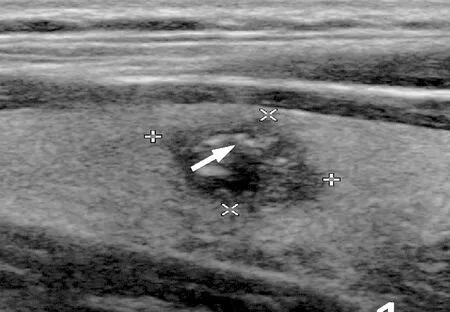
图1 甲状腺乳头状癌病灶微小钙化二维超声图像
3 讨 论
近年来,临床中有部分研究针对PTC患者发生CLNM的危险因素进行分析,但是诸多研究的结果并不十分一致[8]。本研究结果提示,cN0期PTC患者发生CLNM的相关独立危险因素包括:性别(男性)、年龄<45岁、肿瘤直径>1 cm、微钙化、被膜侵犯及病灶肿瘤数目(多发灶)。
研究表明,女性PTC发病率高于男性,但男性的CLNM发生率却高于女性[9],与本研究结果一致。预测CLNM的方法很多,而超声测量肿瘤的大小是最容易获得的预测方法[10]。但是不同研究得出不同的阈值[11]。本研究团队前期结果表明,肿瘤直径>7 mm更容易发生CLNM,特别是大量淋巴结转移[12]。还有相关研究指出,肿瘤病灶直径>1 cm跟PTC患者发生CLNM之间存在着明确的联系[13],与本研究结果一致。上述研究表明,CLNM的发生与肿瘤病灶直径之间存在关系,分析可能的原因为当肿瘤直径更大时,肿瘤的负荷就更大[14],肿瘤细胞越多,生长越活跃,也就越容易发生转移。
CLNM的发生与年龄之间存在关系。相关研究指出,cN0期PTC患者中约61%接受了PCND,结果提示年龄<45岁的PTC患者更易合并CLNM[15]。由于绝大部分的临床研究都将年龄45岁当作截点年龄[16,17],因此,本研究同样选取了45岁。还有研究指出,年轻患者当中存在着大量的CLNM,特别是年龄<40岁者,发生CLNM的比率更高,所以针对年龄较小的PTC患者需要常规防治CLNM[18]。而第八版美国癌症联合委员会(American Joint Committee on Cancer,AJCC)发布的甲状腺癌TNM 分期系统将年龄切点值由45岁调至55岁,认为这样可以将10%较高TNM分期(Ⅲ期/Ⅳ期)的患者降至较低分期(Ⅰ期/Ⅱ期),避免了激进的、不必要的治疗或随访方式[19]。目前研究缺乏后期随访资料,未来可行进一步前瞻性研究进行验证。
PTC患者的一种重要生物学特性就是多灶性,但是针对其起源病因为多克隆还是单克隆依旧存在争议。部分研究指出,甲状腺组织当中存在着十分丰富的淋巴通道,便于其转移[20]。而随着不断深入的分子学检测手段的应用,揭示了PTC的多灶性可能是由多个起源的可能[21]。国内学者认为,cN0期PTC患者中多灶性患者更易发生CLNM[22],与本研究结果一致。
本研究结果显示,伴有微钙化的PTC中央区淋巴结转移率为60.60% (P<0.05),是CLNM的独立危险因素。而Lee等[23]研究指出超声图像中的微钙化与PTC发生中央区淋巴结转移无明显相关,这可能与超声仪器分辨力、选择偏倚或超声医师对微钙化的图像辨识存在差异等有关。病灶突破腺体被膜后,具有较高的侵袭性,可侵及周围组织,包括颈前带状肌、血管、淋巴管等。本研究中有被膜侵犯的PTC患者中央区淋巴结转移阳性率为(65.60%,126/192),是CLNM的独立危险因素(OR=2.868、P=0.000),与2015版美国ATA指南一致[4]。本研究团队前期研究也表明,被膜侵犯不仅影响肿瘤的TNM分期,也决定了外科手术方式的选择,同时也是衡量PTC患者术后复发转移的重要因素[12]。
综上所述,患者的基本情况及超声特征有可能反映cN0期PTC患者发生中央区淋巴结转移的情况,可以为外科医师制定手术计划提供参考。本文不足之处在于为回顾性研究,非多中心、大样本量研究,结果可能存在偏倚,期待后期多中心,大样本量的研究,以提高术前影像学检查诊断PTC患者中央区淋巴结转移的可靠性,为临床医师对cN0 患者中央区淋巴结清扫方案的制定、选择恰当的术式提供参考信息,减少术后并发症的发生。
