采前水杨酸处理对红地球葡萄潜伏侵染及采后灰霉病的防控效果
2021-06-16郑素慧秦南南
郑素慧,何 庆,张 健,秦南南,吴 斌,*
(1.新疆农业科学院农产品贮藏加工研究所,新疆乌鲁木齐 830091; 2.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)
葡萄(VitisviniferaL.)果实味甜多汁,果肉硬脆,营养丰富,深受人们青睐。但葡萄果实皮薄其组织娇嫩,在采摘、运输和贮藏过程中易受损伤,为病原菌通过伤口进行侵染提供了有利条件。葡萄采后病害主要是由灰葡萄孢菌(Botrytiscinerea)引起的灰霉病和青霉菌(Peniciliumspp)引起的青霉病[1],这些病原菌具有潜伏侵染性,难以预测和控制,对果蔬贮藏构成了严重威胁。目前能有效控制葡萄采后病害的方法是使用化学杀菌剂,如SO2制剂、仲丁胺、苯并咪唑类等[2],但由于存在农药残留问题,所以病害绿色防控技术的研发对于减少采后葡萄果实损耗和维持食品安全意义重大。
水杨酸(Salicylic acid,SA)是一种广泛存在于高等植物中的一种内源物质,在植物逆境应答过程中发挥着重要的信号传导作用,是已经被证明并被广泛认可的抗性诱导物质[3-4]。外源水杨酸采前喷施甜樱桃[5]、甜瓜[6]、杏[7]和采后浸泡处理均能够维持品质,诱导柑橘[8]、桃[9]、枸杞[10]、苹果[11]、杏[12]、芒果[13]和龙眼[14]等果实的抗病相关酶系的表达,抵御病原菌的侵染,降低贮藏期果实的腐烂率。外源水杨酸采前处理,可减少采后处理环节,对于维持硬度与品质,抵御病害的侵入具有一定的作用[15]。近年来,关于SA应用于采后果蔬贮藏保鲜的研究报告不断增多,对其机理的研究也逐渐深入,但关于SA采前处理诱导葡萄果实发育过程中潜伏侵染真菌的控制鲜有报道。本试验以新疆红地球葡萄为材料,在果实膨大期、转色期和采收期喷施不同浓度SA处理,分析果实不同时期不同部位的潜伏带菌率及潜伏侵染真菌种类情况,探讨采前SA处理控制葡萄采后主要病害的可能性及对葡萄潜伏侵染的影响,为SA在葡萄采后病害的防治和保鲜中的应用提供理论及技术参考。
1 材料与方法
1.1 材料与仪器
红地球葡萄 采集于昌吉州三工镇种植园,选择生长势一致、照光良好的果穗进行喷施处理,采收后挑选大小均一、色泽相近、果形端正、无机械损伤和病虫害的果穗,采后当日运回实验室冷库(0±1) ℃进行预冷,预冷12 h后待用;SA 美国Sigma-Aldrich公司;马铃薯琼脂(Potato dextrose agar,PDA)培养基 天津光复精细化工研究所;多糖多酚植物总RNA提取试剂盒 天根DP411;Prime Script RT reagent Kit With gDNA Eraser反转录试剂盒、TB GreenTMPremix Ex TaqTMII试剂盒 TaKaRa公司。
SW-CJ-2FD型无菌操作台 苏净集团;LDZX-50KBS型立式蒸汽灭菌锅 上海申安医疗器械厂;ML204型分析天平:德国梅特勒-托利多公司;BPH-9042恒温培养箱 上海一恒;ABI PRISM 7500型实时定量荧光PCR仪 美国ABI。
1.2 实验方法
1.2.1 采前SA处理的时期与方法 选择长势一致,光照良好的葡萄果穗,2017年7月下旬(膨大期)、8月下旬(转色期)和9月中旬(采收前2 d)分别对葡萄果穗进行喷施SA处理,通过预实验选择设置0(对照组)、0.5、1.0、2.0 mmol/L(含体积分数0.05% Tween-80)4个处理浓度。均匀喷施果面数次,每串果穗喷施药液约为200 mL,自然晾干。
1.2.2 果实潜伏侵染率统计 采用0.5、1.0、2.0 mmol/L SA(含体积分数0.05% Tween-80)分别在葡萄膨大期、转色期和采收前2 d(预收期)喷施处理,每次喷施处理7 d后取样。
参考秦士维等[16]方法。将采集的葡萄果实用蒸馏水冲洗干净,自然晾干后,分别切取顶端、中部、底端、果梗和果蒂等部位组织。先用75%酒精浸泡30 s,再用1%的次氯酸钠溶液浸泡1 min,然后用无菌水淋洗3次,灭菌条件下将洗净的组织块下置于PDA平板上,在28 ℃条件下培养5~7 d,检查带菌组织块数量,计算带菌率。每部位分离10块组织,重复3次。
潜伏侵染率(%)=Σ每区分离组织侵染数/总分离组织块数×100
1.2.3 果实病原真菌的鉴定 待PDA培养基上长出菌落,用接种环挑取菌落边缘的菌丝,平板划线法反复分离、纯化,直至菌落的生长状态和形态特征表现一致,纯化的菌落于4 ℃保存。将病原真菌在PDA培养基上培养7~10 d,观察菌落形态。挑取少量孢子或菌丝,显微镜下观察各菌株分生孢子、孢子梗的形状和孢子纵横隔膜数目等,形态学特征参照《真菌鉴定手册》与《真菌病害诊断》,初步鉴定病原菌的种属。
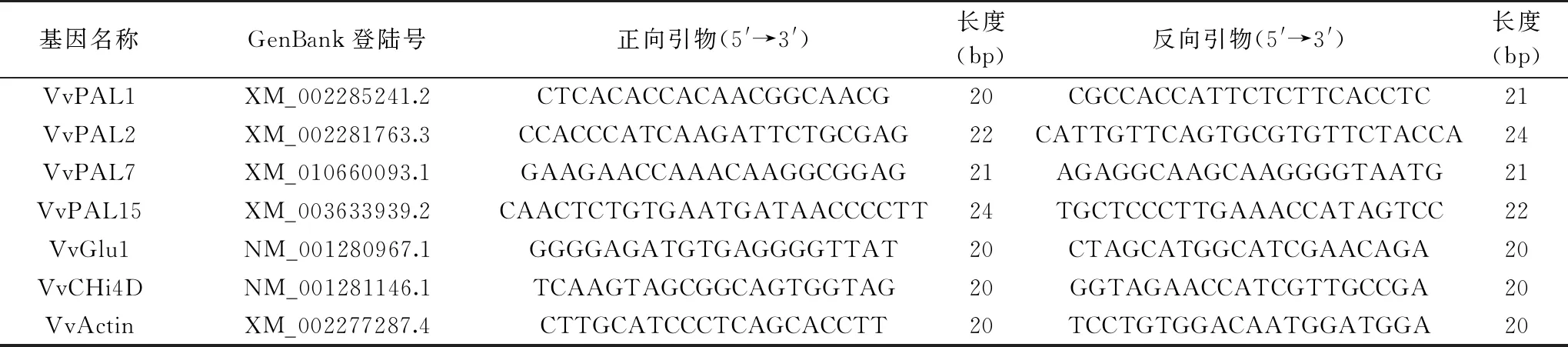
表1 相关基因引物序列Table 1 Sequences of primers of related genes
委托生工生物工程(上海)股份有限公司进行ITS菌种鉴定。将所得序列在NCBI数据库(http://www.ncbi.nlm.nih.gov/)中进行BLAST同源性检索,采用MEGA 5.1软件对同源序列与目的序列进行比对,构建系统进化树,分析同源性关系。
1.2.4 病原真菌孢子悬浮液的制作 参考邓惠文[17]的方法进行孢子悬浮液的配制。将已长出菌丝的菌株转接到新的PDA培养基上,25 ℃培养7 d,用体积分数为0.05%的Tween-80无菌水冲洗平板、收集孢子悬液,并用血球计数板计数,最终将孢子悬浮液浓度稀释至1×106个/mL。
1.2.5 损伤接种处理 参照Yao[18]的方法并稍作修改。无菌条件下,先用75%(v/v)的酒精擦拭果实表面,然后在果实赤道部位用灭菌竹签刺1个孔(直径2 mm,深度2 mm),待伤口表面晾干后,用微量进样器向孔内注入10 μL浓度为1×106个/mL的孢子悬浮液。待菌液完全吸收后将果粒装入塑料盒中(175 mm×135 mm×76 mm,盒盖上有6个孔,直径1 cm),接种面向上,置于室温(25±1 ℃),相对湿度为60%~65%的环境中贮藏7 d。每24 h取样,收集葡萄病斑周围0.50 cm处健康果肉组织,液氮速冻后,于-80 ℃冰箱中保存。
在统计发病情况时将病斑直径超过穿刺孔径2 mm的记为病果;病斑直径利用游标卡尺进行十字交叉法测定,每个病斑测量3次,计算平均值。
发病率(%)=发病果实个数/果实总个数×100
1.2.6 相关抗性基因的表达分析
1.2.6.1 总RNA提取 取葡萄果肉液氮研磨,按照多糖多酚植物总RNA提取试剂盒(天根,DP411)说明书提取总RNA。提取的RNA经Biospectrometer(Eppendorf,Germany)测定OD值以及电泳检测合格后-80 ℃保存备用。
1.2.6.2 cDNA合成 参照Prime Script RT reagent Kit With gDNA Eraser反转录试剂盒(Takara)说明书进行。反应体系及反应程序按照程玉豆[19]的方法进行。
1.2.6.3 mRNA定量分析 VvPAL1、VvPAL2、VvPAL7、VvPAL15、VvGlu1、VvCHi4D和VvActin基因定量分析引物参考已报道文献[20-22],引物序列见表1。参照TB GreenTMPremix Ex TaqTMII试剂盒(Takara)说明书进行,定量PCR反应体系和反应件按照程玉豆[19]的方法进行。每个处理设3次重复,以VvActin基因作为内参,采用ABI7500分析软件中2-ΔΔCt法计算各基因相对表达量。
1.3 数据处理
采用Excel 2010计算数据,利用SPSS 20.0进行统计分析,使用Duncan多重比较检验法进行显著性分析(P<0.05为差异显著,P<0.01为差异极显著)。
2 结果与分析
2.1 采前SA处理对葡萄果实不同部位带菌率的影响
由图1可知,采前SA处理可以显著降低果实生长发育期间潜伏侵染的真菌带菌率,在经SA处理的果实在膨大期、转色期和采收期时,葡萄果蒂和果实底部的潜伏侵染率高于果粒顶部和果粒中部,这也进一步证实果蒂和果实底部带菌量高更易染病。
葡萄果实在生长发育过程中,潜伏侵染率呈逐渐上升趋势。采前用SA处理可有效降低葡萄果实生长发育期间的潜伏侵染率,随着SA处理次数的增多,潜伏侵染率逐渐降低。如图1A所示,在膨大期和采收期时,0.5~2.0 mmol/L SA处理组较对照组均可显著降低同时期的果顶潜伏侵染率(P<0.05),其中采收期时0.5、1.0和2.0 mmol/L SA处理组在果顶潜伏侵染率分别为同期对照组的70.58%、47.06%和64.71%,1.0 mmol/L处理与各处理组之间差异显著(P<0.05);如图1B所示,在不同时期,1.0 mmol/L SA处理组的果中潜伏侵染率较同时期对照组均显著降低(P<0.05);如图1C所示,在转色期和采收期时,1.0 mmol/L SA处理组的果底潜伏侵染率(16.67%、20%)较同时期对照组(43.33%、43.33%)均显著降低(P<0.05),其中采收期时0.5、1.0和2.0 mmol/L SA处理组潜伏侵染率均显著低于同期对照(P<0.05),各处理组之间差异不显著;如图1D所示,在不同时期,0.5~2.0 mmol/L SA处理组果梗潜伏侵染率较对照组均降低;其中在膨大期时,各处理组果梗潜伏侵染率分别为1.33%、0和1.33%,与对照组相比,差异显著(P<0.05),其中1.0 mmol/L SA处理与各处理组之间差异显著(P<0.05);如图1E所示,在不同时期,0.5~2.0 mmol/L SA处理组果蒂潜伏侵染率较对照组均显著降低(P<0.05),其中在采收期时,各处理组果蒂潜伏侵染率分别是同期对照组的57.90%、31.58%和36.86%,与对照组相比,差异显著(P<0.05)。

图1 采前SA处理对葡萄不同发育时期果顶(A)、果中(B)、果底(C)、果梗(D)和果蒂(E)潜伏侵染率的影响Fig.1 Effect of preharvest SA treatment on latent infection rate of grape top(A),middle(B),base(C),stalk(D)and pedicle(E)注:不同小写字母表示处理间差异显著(P<0.05),不同大写字母表示处理间差异极显著(P<0.01);图4、图5同。

图2 采前SA处理对膨大期(A)、转色期(B)和采收期(C)葡萄果实不同部位潜伏侵染率的影响Fig.2 Effect of preharvest SA treatment on latent infection rate of grape in the expansion period(A),color transformation period(B)and harvest period(C)注:不同小写字母表示不同果实部位间差异显著(P<0.05)。
不同浓度SA采前处理分析表明,采前SA处理对葡萄果实不同部位的潜伏侵染有着不同的控制效果,其中1.0 mmol/L SA处理效果最好,其对果实底部、中部和果蒂潜伏侵染的控制效果优于果实顶部和果梗,经3次SA处理在采收期时对果实底部和果蒂的潜伏侵染控制效果最佳。从果实的部位来看,不同部位的带菌率存在显著差异。如图2A所示,膨大期时各处理组果实果底和果蒂的潜伏侵染率均显著高于果顶、果中和果梗(P<0.05),其中1.0 mmol/L SA处理的果实底部和果蒂侵染率(16.67%和11.33%)显著高于果实顶部、中部和果梗的侵染率(0%、0%和0%)(P<0.05)。如图2B所示,转色期时1.0和2.0 mmol/L SA处理果实果底和果蒂的潜伏侵染率均显著高于果顶、果中和果梗(P<0.05),其中1.0 mmol/L SA处理的果实顶部、中部、底部、果梗和果蒂潜伏侵染率分别是同部位对照组的50%、15.39%、38.47%、28.59%和22.22%,果实底部和果蒂侵染率显著高于果实顶部、中部和果梗的侵染率(P<0.05)。如图2C所示,采收期时,各处理组的果顶和果蒂的侵染率均显著高于果中、果底和果梗(P<0.05),其中经1.0 mmol/L SA处理果实的顶部、中部、底部、果梗和果蒂潜伏侵染率分别是同部位对照组的47.06%、55.72%、46.16%、50%和31.58%,果实顶部侵染率显著高于果实中部、底部、果梗和果蒂的侵染率(P<0.05),但果底和果蒂之间没有显著差异,果底、果蒂和果实、果梗之间差异显著(P<0.05)。

表2 分离菌株形态特征Table 2 Morphological characteristics of isolates
2.2 葡萄潜伏侵染真菌的分离鉴定
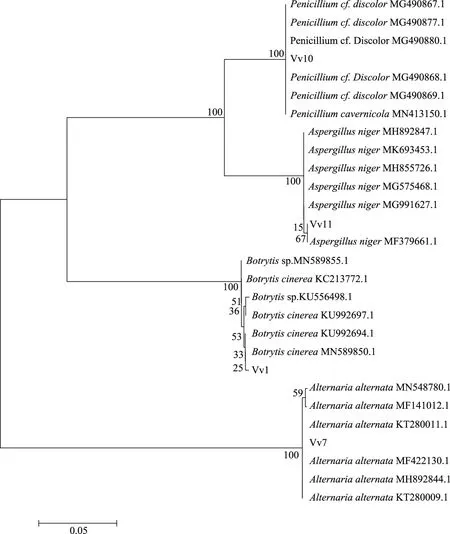
图3 以ITS-rDNA基因序列为分子标记的真菌菌株系统进化树Fig.3 Phylogenetic analysis of fungi based on ITS-rDNA sequence
从生长期的葡萄果实中分离纯化出形态差别比较明显的主要真菌,经致病性测定,根据柯赫法则,比较发病葡萄上分离的菌株与所接种菌株的菌落形态是否一致,依据菌株的菌落形态、菌丝特征,并制作水压片观察菌丝或分生孢子形态,根据《真菌鉴定手册》和相关文献[16,23]对病原菌进行形态学初步鉴定,共鉴定出4种主要潜伏侵染真菌,结果如表2所示。
经ITS菌种鉴定后,将所得序列在NCBI数据库中进行核酸序列比对,得到与目标序列同源性和覆盖率较高的相似序列,用软件MEGA 5.1以Neighbor-Joining分析法构建系统发育进化树。
系统进化树分析结果显示,菌株Vv-1与灰葡萄孢菌(Botrytiscinerea)位于同一分支,且菌株Vv-1形态特征与灰葡萄孢菌基本一致,因此确定菌株Vv-1为灰葡萄孢菌;菌株 Vv-7与互隔交链孢霉(Alternariaalternata)位于同一分支,结合形态学特征,确定菌株Vv-7为互隔交链孢霉;菌株Vv-10与变色青霉(Penicilliumcf.discolor)在进化树上属同一分支,结合形态学特征,判断为变色青霉;菌株Vv-11与黑曲霉(Aspergillusniger)属同一分支,结合形态学鉴定结果,确定其为黑曲霉(Aspergillusniger)。
2.3 SA采前处理对葡萄果实采后损伤接种Botrytis cinerea发病率和病斑直径的影响
如图4A所示,不同浓度SA采前喷施处理采后损伤接种的果实,在25 ℃条件下贮藏至第6 d时,1.0 mmol/L SA处理组和对照组葡萄果实的发病率分别为59.97%和80.00%,1.0 mmol/L SA处理组发病率较对照组降低了25.04%,1.0 mmol/L SA处理组与对照组差异显著(P<0.05);而0.5和2.0 mmol/L SA处理组果实发病率与对照组相比,无显著差异(P>0.05)。如图4B所示,在25 ℃条件下贮藏至第6 d时,0.5和1.0 mmol/L SA处理组葡萄果实的病斑直径分别为2.27和2.12 mm,与对照组相比,病斑直径分别降低了40.89%和44.79%,差异显著(P<0.05),而2.0 mmol/L SA处理组果实发病率与对照组无显著差异(P>0.05)。由此可见,1.0 mmol/L SA处理能够有效抑制发病率上升和果实病斑扩大,能提高葡萄果实对灰葡萄孢的抗性,对灰霉病害的控制效果显著。
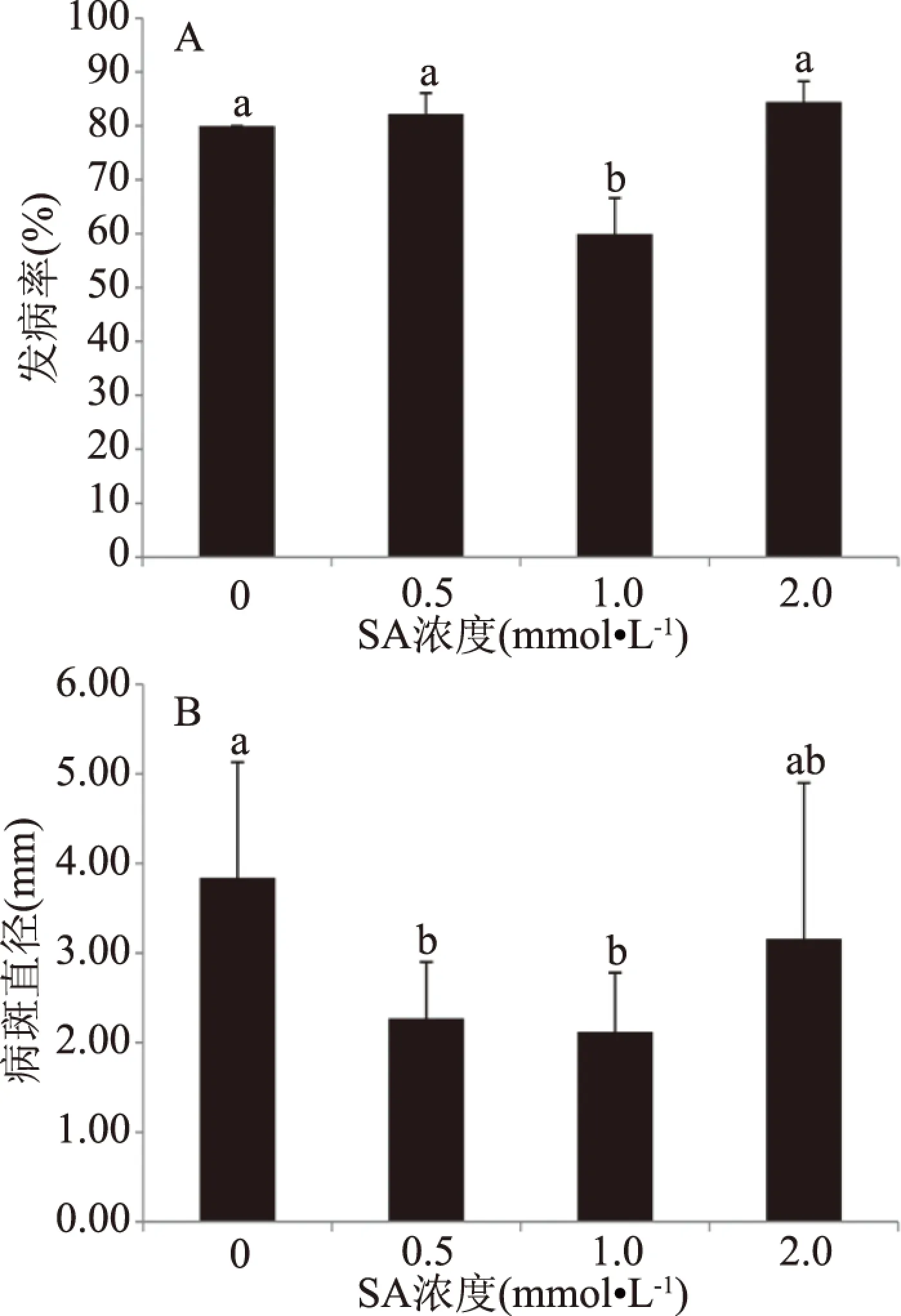
图4 不同浓度SA对葡萄果实发病率(A) 和病斑直径(B)的影响Fig.4 Effects of different SA concentrations treatment on grape incidence(A)and lesion diameter(B)
2.4 1.0 mmol/L SA采前处理对葡萄果实采后损伤接种Botrytis cinerea相关抗性基因的表达分析
如图5A所示,VvPAL1基因表达量在贮藏第1 d时,在SA处理和对照果实中均迅速上升,之后均呈下降趋势。但整个贮藏期间,SA处理果实中VvPAL1基因表达量均显著高于对照组(P<0.05),其中第0、1、3、4 d的SA处理果实中VvPAL1基因表达量均极显著高于对照组(P<0.01),说明SA处理的VvPAL1基因在整个贮藏期间都表达上调。如图5B所示,VvChi4D基因表达量在贮藏第1 d时,在SA处理和对照果实中均迅速上升,之后均呈下降趋势。第0~2 d时,SA处理组VvChi4D基因的相对表达量极显著高于对照组(P<0.01)。贮藏至3~5 d时,对照组VvChi4D基因的相对表达量与SA处理组无明显差异。贮藏至第6 d 时,SA处理组VvChi4D基因的相对表达量显著高于对照组(P<0.05),可见SA处理组VvChi4D基因在贮藏前期表达上调,对前期抵御病害有一定的调控作用。如图5C所示,整个贮藏期间,两处理组VvGlu1基因的表达量均呈上升趋势,SA处理组VvGlu1基因的表达量始终高于对照组,说明SA处理诱导了VvGlu1基因的表达上调。如图5D所示,贮藏第0~3 d时,对照组葡萄果实中VvPAL2基因相对表达量极显著高于SA处理组(P<0.01)。贮藏至第4 d时,对照组VvPAL2基因的相对表达量与SA处理组无明显差异。贮藏至5~6 d时,SA处理组VvPAL2基因的相对表达量极显著高于对照组(P<0.01)。可见SA处理对葡萄VvPAL2基因调控效果在贮藏前期并不明显,在贮藏后期有一定上调表达。如图5E所示,整个贮藏期间,SA处理组VvPAL7基因的表达量始终高于对照组,贮藏至第0、3、4 d 时,SA 处理组VvPAL7基因的表达量极显著高于对照组(P<0.01),可见SA处理对葡萄VvPAL7基因在贮藏中期有一定的表达上调。如图5F所示,贮藏0~3 d 时,对照组葡萄果实中 VvPAL15基因相对表达量极显著高于SA处理组(P<0.01)。贮藏至4~5d 时,SA处理组VvPAL15基因的相对表达量显著高于对照组(P<0.05),贮藏至6 d时,对照组VvPAL15基因的相对表达量与SA处理组无明显差异。可见SA处理对葡萄VvPAL15基因调控效果在贮藏中后期有一定的表达上调。

图5 1.0 mmol/L SA采前处理对葡萄VvPAL1(A)、VvChi4D(B)、VvGlu1(C)、 VvPAL2(D)、VvPAL7(E)和VvPAL15(F)基因荧光表达量的影响Fig.5 Effect of 1.0 mmol/L SA treatment on the fluorescence expression of VvPAL1(A),VvChi4D(B), VvGlu1(C),VvPAL2(D),VvPAL7(E)and VvPAL15(F)genes in grape
3 讨论与结论
采前SA处理可以显著降低果实生长发育期间潜伏侵染的真菌带菌率,1.0 mmol/L SA处理对果实底部、中部和果蒂潜伏侵染的控制效果优于果实顶部和果梗,经3次SA处理在采收期时对果实底部和果蒂的潜伏侵染控制效果最佳。生长期果实共鉴定出4种主要潜伏病原真菌,分别为灰葡萄孢菌(Botrytiscinerea)、互隔交链孢霉(Alternariaalternate)、变色青霉(Penicilliumdiscolor)和黑曲霉(Aspergillusniger)。
SA作为植物中的天然成分,能充当信号分子调控多种果实抗逆性反应和次生代谢产物的合成,是植物获得诱导抗性的重要诱导因子,可诱导果实多种防御酶活性及其基因表达丰度的上升来抑制采后病害的侵染[24]。本实验中,经不同浓度SA采前喷施处理并经采收后损伤接种的果实,1.0 mmol/L SA处理的发病率和病斑直径较对照组分别降低了25.04%和44.79%,可见1.0 mmol/L SA处理诱导葡萄果实对Botrytis cinerea侵染的抵抗能力增强,SA处理能够有效抑制发病率上升和果实病斑扩大。这验证了采前或采后一定浓度外源SA处理能在一定程度上维持果实品质与控制病害发生[25],与SA处理可有效抑制甜樱桃果实褐腐病[18]和柑橘绿霉病的发生[27]结论相一致,特别是甜樱桃果实,采前处理的防病效果比采后处理的要好[21]相一致。在Botrytiscinerea侵染期间,VvPAL1、VvChi4D、VvGlu1、VvPAL2、VvPAL7和VvPAL15表达规律不同,贮藏前期VvPAL1、VvChi4D和VvGlu1相对表达量较高,推测VvPAL1、VvChi4D和VvGlu1起主要的抗病性作用;贮藏中期和后期VvPAL2、VvPAL7和VvPAL15相对表达量较高,推测VvPAL2、VvPAL7和VvPAL15起主要的抗病性作用。与对照组相比较,Botrytis cinerea侵染处理VvPAL1、VvChi4D、VvGlu1、VvPAL2、VvPAL7和VvPAL15相对表达量显著提高。PAL、CHI和GLU是重要的防御酶系,与植物受病原菌侵染或抗病诱导密切相关,在植物体被病菌侵染后迅速诱导表达[27],葡萄果实在Botrytiscinerea侵染期间PAL、CHT和GLU基因相对表达量显著提高,表明葡萄组织对病原菌的侵染产生了响应,SA诱导了葡萄抗病相关基因的表达,从而提高了果实抗病性。本研究充分表明,采前SA处理对红地球葡萄潜伏侵染及采后灰霉病有一定防控效果,可提高鲜食葡萄采后鲜销贮运过程中的食用安全性和货架期,为鲜食葡萄采后安全保鲜和品质维持提供了理论依据与技术方法。
