葡萄采后果梗抗氧化系统与褐变的关系
2021-10-09张琼琼魏佳李杰张健温春马先花吴斌
张琼琼,魏佳,李杰,张健,温春,马先花,吴斌*
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)(2.新疆农业科学院农产品贮藏加工研究所,新疆乌鲁木齐 830091)(3.新疆农业大学林学与园艺学院,新疆乌鲁木齐 830052)
新疆作为中国最大的葡萄产区,2019 年葡萄产量达到3.13×106t,位居全国第一[1]。红提和木纳格葡萄是新疆主栽的晚熟鲜食葡萄品种。在贮运过程中,果实易发生脱粒、褐变及腐烂等现象;果梗易失水和褐变,导致葡萄新鲜度下降,严重影响葡萄的感官品质和外运销售[2,3]。果梗是连接果粒的部分,是果实的生理活跃部位,也是采后营养物质消耗、水分大量散失的主要部位[4]。在贮藏过程中,果梗易受交链孢霉、根霉、黑霉及芽枝霉的侵染,导致果梗干缩。葡萄贮藏中发生的一系列生理变化,首先从果梗开始,引起葡萄萎蔫、褐变和腐烂等现象的发生,直接影响葡萄的商品性和耐贮性。果梗颜色的变化可以判断果实新鲜度[5],通常消费者认为果梗褐变代表葡萄不新鲜,往往会选择果梗新鲜的葡萄,这可能导致葡萄浪费,给种植户造成经济损失。因此,研究果梗褐变的原因,对于减少葡萄浪费和种植户经济损失非常关键。近年来,葡萄采后保鲜的研究多集中在果实品质劣变方面,但对果梗褐变进程与抗氧化系统相关性的研究报道较少。
鲜食葡萄采后果梗褐变主要与生物及非生物胁迫引起的酶促褐变有关[6]。酚类、类黄酮类等植物次生代谢产物,与褐变关系密切。多酚类化合物作为酶促褐变的底物,具有较强的抗氧化性以及清除自由基的能力,是影响果实采后褐变的主要因素之一[7]。植物组织中含有大量的多酚类化合物,多分布在细胞液泡中,催化多酚类物质氧化的酶则分布在细胞壁、细胞质、细胞膜中,正常情况下,不发生反应;当细胞区域化分布被打破,这些多酚类化合物在酶的催化作用下,发生氧化作用,引起酶促反应,导致组织褐变,降低商品价值[8]。苯丙氨酸解氨酶(phenylalamine ammonia lyase,PAL)是苯丙烷途径多种酚类化合物合成的关键酶[9]。过氧化物酶(peroxidase,POD)作为褐变相关酶,参与酚类物质的合成。多酚氧化酶(polyphenol oxidase,PPO)能催化多种简单酚类物质氧化形成醌类化合物,醌类化合物进一步聚合形成呈现褐色、棕色或黑色的聚合物。研究表明,果梗褐变与多酚氧化酶相关[3]。贮藏过程中,往往伴随着活性氧的积累。活性氧的积累可能破坏细胞膜结构完整性,导致脂质的氧化损伤,形成有毒的产物,如MDA,加速褐变[10]。采后清除活性氧的积累尤为重要。活性氧的清除与抗氧化系统密切相关[11]。因此,抗氧化系统可能参与了葡萄果梗褐变过程。
因此,本试验以新疆红提、木纳格葡萄为研究试材,通过测定抗氧化相关指标,研究活性氧及酚类物质代谢与不同品种葡萄果梗褐变差异的关系,旨在阐明抗氧化系统在采后葡萄品种果梗褐变发生中的作用机制,为葡萄采后保鲜技术的研究提供理论依据。
1 材料与方法
1.1 材料与试剂
红提葡萄(可溶性固形物TSS≥18%)于2019 年9月8 日采自于新疆乌鲁木齐市昌吉三工镇葡萄种植园;木纳格葡萄(TSS≥18%)于2019 年10 月10 日在新疆阿图什市阿扎克乡采收。挑选无机械损伤,无病害,果梗新鲜的两种葡萄,采后均用冷链车立即运往新疆农业科学院农产品贮藏加工研究所冷库,在0±0.5℃预冷24 h。
三氯乙酸、硫代巴比妥酸、冰醋酸、聚乙烯吡咯烷酮、Triton X-100、愈创木酚、30% H2O2溶液、盐酸羟胺、对氨基苯磺酸、α-萘胺、亚硝酸钾、丙酮、四氯化钛、氮蓝四唑、核黄素、乙二胺四乙酸(EDTA)、抗坏血酸,天津市北联精细化学品开发有限公司。以上试剂均为分析纯。
1.2 仪器与设备
DELTA320 型分析天平,梅特勒-托利多仪器(上海)有限公司;SIM-F140ADL 型制冰机,日本松下电器;DW-86L626 型超低温冰箱,青岛海尔特种电器有限公司;DK-8D 型电热恒温水浴锅,北京市永光明医疗仪器厂;UV-2600 型紫外分光光度计,岛津仪器苏州有限公司。
1.3 实验方法
1.3.1 原料处理
将预冷后的两种葡萄分别随机分成42 份,每份约重0.50 kg,放入带有6 个直径1 cm 孔的PE 包装盒(175×135×76 mm 石家庄市鑫亿达塑料制品有限公司)内,盒内上下衬有吸水纸。6 份一组,再放进PE 保鲜袋(厚0.03 mm)后扎紧袋口,模拟冷链物流温度,于冷库10±0.5℃、相对湿度(RH)95%条件下贮藏7 d,每天测定果梗的褐变指数、相对电导率等,需鲜样测定的相关指标;同时把整个果梗剪碎混匀,每个取样点取100 g 样品,用液氮速冻并置于-80℃保存,待测其它指标。每组重复3 次。
1.3.2 指标测定
1.3.2.1 果梗褐变指数的测定
参考李志文等[12]人的方法。将穗轴褐变面积分为5 级,无褐变的为0 级;褐变面积0~1/4 为1 级;褐变1/4~1/2 为2 级;褐变1/2~3/4 为3 级;褐变3/4以上为4 级。

1.3.2.2 超氧阴离子自由基(O2-·)产生速率和过氧化氢(H2O2)含量的测定
超氧阴离子自由基(O2-·)产生速率的测定,参考曹建康的方法[13]。结果以每分钟每克鲜重(FW)果蔬组织产生的超氧阴离子的纳摩尔数作为O2-·的产生速率表示,即nmol/(min·g)。过氧化氢(H2O2)含量的测定,参考袁梦麒等[14]的方法。结果以μmol/g FW 表示。
1.3.2.3 相对电导率、丙二醛含量的测定
相对电导率的测定参照集贤等[15]的方法,略有改动。称取0.25 g 葡萄果梗,剪成长度为0.10 cm 左右的细段,放于100 mL 烧杯中,向其加入50 mL 蒸馏水,震荡1 min,立即测定此时电导率,记为P0;测完后,用保鲜膜盖上烧杯,静止30 min 后,测定电导率,记为P1,然后放入沸水浴中15 min,待冷却后,测电导率,记为P2。
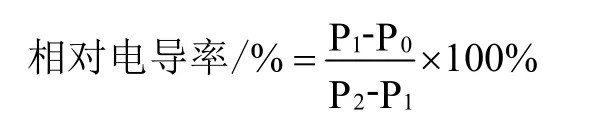
丙二醛(malondialdehyde,MDA)含量的测定参考Endo[16]等的方法,略作修改。称取1.0 g 果梗,加入5.0 mL 预冷的10%三氯乙酸(TCA),研磨匀浆后,于4℃、10000×g 离心20 min,收集上清液。取2.0 mL上清液,加入2.0 mL 0.67%硫代巴比妥酸(TBA),混合后在沸水浴中煮沸20 min,冷却后再离心一次。分别测定上清液在450、532 和600 nm 波长处的吸光度值。重复三次。结果以µmol/g FW 表示。
1.3.2.4 总酚、类黄酮含量的测定
参照李灿婴等[17]的方法。总酚含量用A280nm/g表示;类黄酮含量用A325nm/g 表示。
1.3.2.5 PPO、POD、PAL 的测定
PPO 的测定采用邻苯二酚法[13]。以每克鲜重(FW)果蔬样品每分钟在420 nm 处的吸光度变化值增加1 时为1 个PPO 活性单位(U),结果以U/g表示。
POD 的测定采用愈创木酚法[13];以每克鲜重(FW)果蔬样品每分钟在470 nm 处的吸光度变化值增加1 时为1 个过氧化物酶活性单位(U),结果以U/g 表示。
PAL 的测定参考曹建康[13]的方法。结果以每小时每克鲜重(FW)果蔬组织反应体系吸光度值增加0.01 时为1 个PAL 活性单位(U),结果以U/g 表示。
1.3.2.6 SOD、CAT、APX 活性的测定
超氧化物歧化酶(superoxide dismutase,SOD)的测定参考Lo’ay 等[18]的方法,略作修改。以每分钟每克鲜重(FW)果蔬组织的反应体系对氮蓝四唑(NBT)光化还原的抑制为50%时为一个SOD 活性单位(U),结果以U/g 表示。
过氧化氢酶(catalase,CAT)的测定参考Zhang等[19]的方法。以每克鲜重(FW)果蔬样品每分钟在240 nm 处的吸光度变化值增加0.01 时为1 个过氧化物酶活性单位(U)表示,结果以U/g 表示。
抗坏血酸过氧化物酶(ascorbate peroxidase,APX)的测定参考Wang 等[20]的方法。以每克鲜重(FW)果蔬样品每分钟吸光度变化值增加0.01 时为1 个过氧化物酶活性单位(U),结果以U/g 表示。
1.4 数据处理
使用Sigma Plot 12.0 软件作图,SPSS 19.5 进行数据方差分析并利用Duncan 法进行均值比较。p<0.05 表示差异显著,p<0.01 表示差异极显著。
2 结果与分析
2.1 葡萄果梗褐变指数的变化
果梗褐变是影响葡萄果实品质和商品价值的主要因素之一[21]。由图1 可知,葡萄果梗褐变指数随着贮藏时间的延长,逐渐增加。这与邓冰等[22]对木纳格葡萄中的研究结果相同。木纳格葡萄果梗褐变指数高于红提葡萄。在贮藏至第3、4 d 时,木纳格葡萄果梗褐变指数极显著(p<0.01)高于红提葡萄,分别高42.13%和29.41%。可能是由于木纳格葡萄果梗比红提葡萄果梗细,气孔较多,失水速率快,导致木纳格葡萄果梗褐变速度比红提葡萄果梗褐变快。

图1 葡萄果梗褐变指数的变化 Fig.1 Changes in browning index of grape rachis
2.2 葡萄果梗超氧阴离子自由基(O2-·)产生速率、H2O2 含量的变化
如图2a 所示,贮藏期间,随着果梗褐变指数的增加,葡萄果梗的O2-·产生速率呈现先上升后下降的趋势。贮藏期间,红提葡萄果梗的O2-·产生速率显著低于木纳格葡萄果梗(p<0.05)。贮藏至第6 d,红提葡萄果梗的O2-·产生速率是1078.70 nmol/(min·g),木纳格葡萄果梗的 O2-·产生速率是 1898.15 nmol/(min·g),红提葡萄果梗的O2-·产生速率比木纳格葡萄果梗低43.17%。说明木纳格葡萄果梗对氧化损伤的抗性低于红提葡萄果梗,致使细胞结构严重受损。
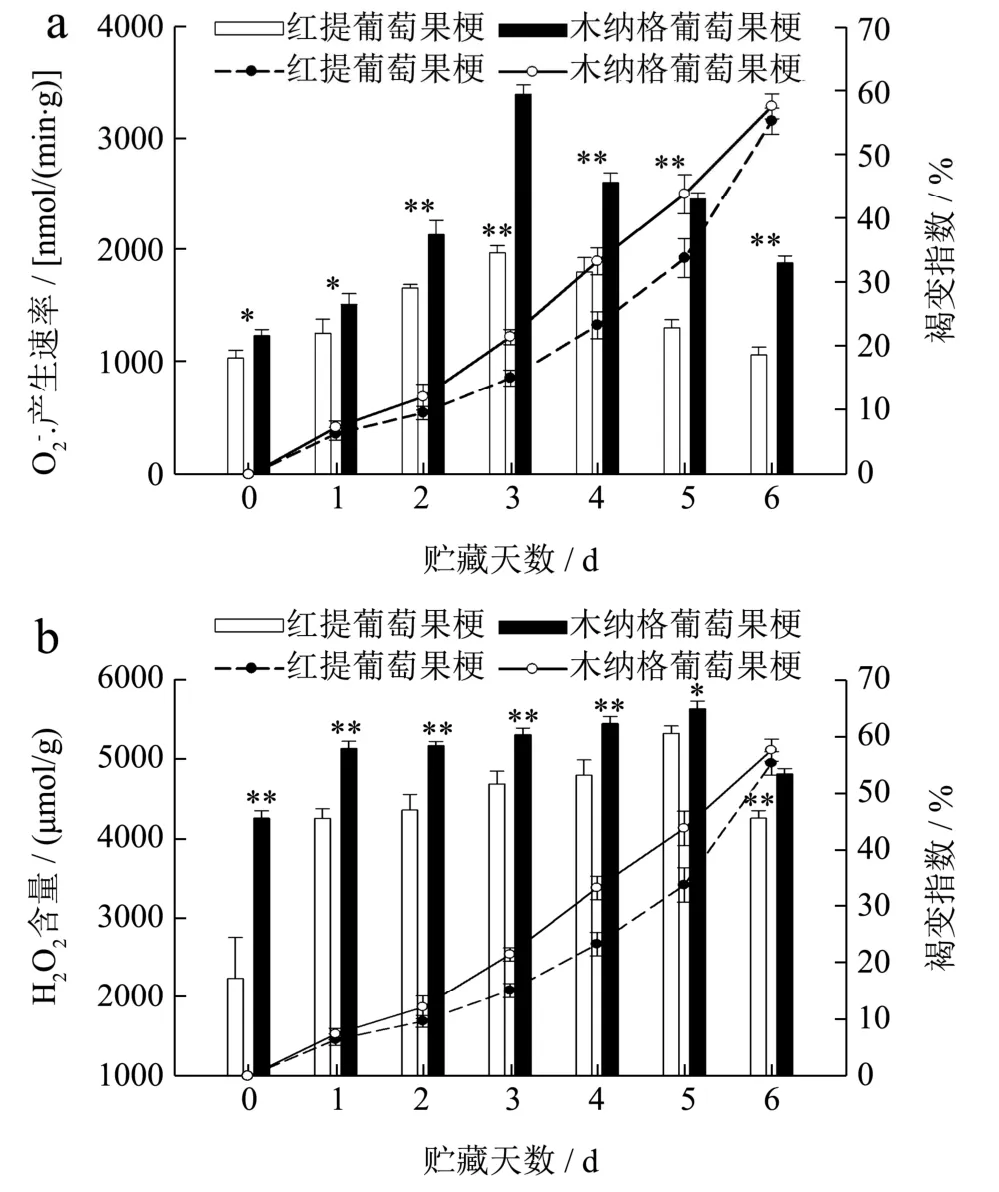
图2 葡萄果梗超氧阴离子自由基(O2-·)产生速率(a)、H2O2含量(b)的变化 Fig.2 Changes between the rate of generation of superoxide anion radicals (O2-·)、hydrogen peroxide of grape rachis
在图2b 中,当果梗褐变指数增加时,红提葡萄果梗H2O2的含量呈现先上升后下降的趋势,木纳格葡萄果梗H2O2含量始终高于红提葡萄果梗。贮藏结束,木纳格葡萄果梗的H2O2含量比红提葡萄高13.06%。可能是由于木纳格葡萄果梗过氧化氢积累的过多,导致其积累位点的代谢功能被破坏,细胞完整性丧失,加重植物组织的氧化损伤,造成木纳格葡萄果梗比红提葡萄果梗褐变快[23]。
2.3 葡萄果梗相对电导率、丙二醛含量的变化
褐变与膜脂过氧化程度的加强及膜结构的破坏程度密切相关[24]。如图3a 所示,在贮藏期间,葡萄果梗的相对电导率呈现逐渐上升的趋势,此趋势与巨峰葡萄果梗保鲜的研究结果类似[17]。本研究发现,木纳格葡萄果梗的相对电导率始终极显著高于红提葡萄(p<0.01)。贮藏至结束,红提葡萄果梗的相对电导率是19.69%,木纳格葡萄果梗的相对电导率是34.73%,红提葡萄果梗的相对电导率比木纳格葡萄低43.32%。细胞壁主要由果胶和纤维素组成。贮藏期间,木纳格葡萄果梗的相对电导率始终极显著高于红提葡萄果梗,可能是由于红提葡萄果梗细胞壁的纤维素含量较多,纤维素自身的微纤丝结构与其他组分相互结合,构成的细胞壁结构更加牢固和完整,不易受到破坏,对细胞膜损伤较小[25];细胞组织间隙相对较小,导致细胞渗透率较低,延缓相对电导率的增加,减慢褐变速度。
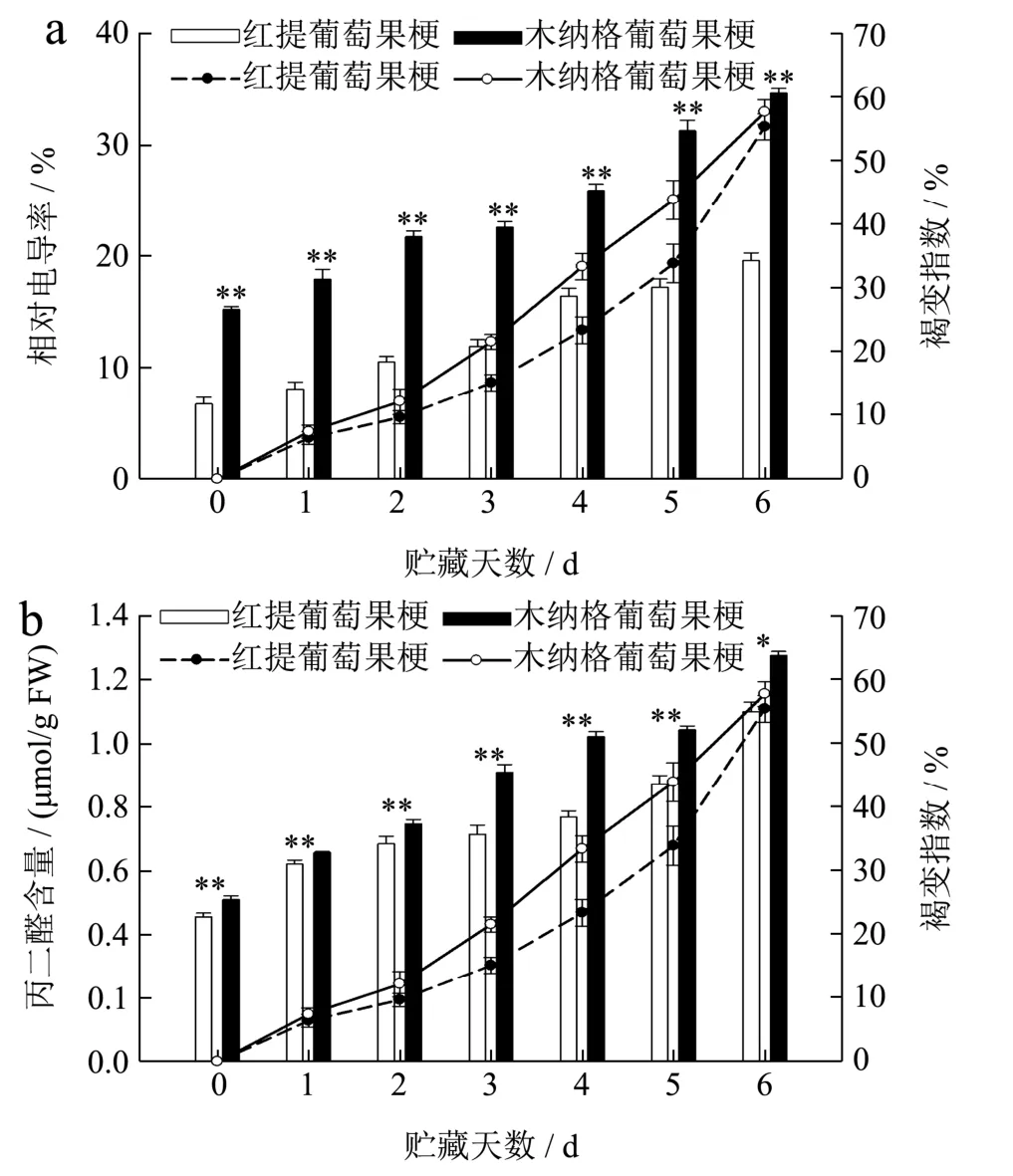
图3 葡萄果梗相对电导率(a)、丙二醛(b)含量的变化 Fig.3 Changes of relative conductivity of grape rachis,malondialdehyde content
如图3b 所示,葡萄果梗中MDA 含量随着贮藏时间的延长,呈逐渐上升趋势,且褐变指数随着MDA含量的增加而增加。与孙杨杨[26]在基于膜脂代谢的常温贮藏南果梨果心褐变机理及调控研究的结果相类似。贮藏期间,木纳格葡萄果梗MDA 含量显著高于红提葡萄(p<0.05)。贮藏至第6 d,红提葡萄果梗的MDA 含量是1.10 µmol/g,木纳格葡萄果梗的MDA 含量是1.28 µmol/g,木纳格葡萄果梗的MDA含量比红提葡萄高15.99%。由于木纳格葡萄果梗中较高的活性氧积累,促进膜脂过氧化进程,从而破坏细胞膜的结构和完整性,导致MDA 含量的增加,引起褐变[27]。通过以上数据分析可知,相对电导率和MDA 的含量越高,果梗褐变速度越快。
2.4 葡萄果梗总酚、类黄酮含量的变化
总酚作为酶促褐变的底物,其含量的高低可以反应抗褐变的能力[28]。由图4a 可知,仅在第0 d 和第4 d 时,红提葡萄果梗的总酚含量显著高于木纳格葡萄(p<0.05),分别高0.60%和0.87%,但木纳格葡萄果梗褐变程度高于红提葡萄。通过相关性分析发现,红提和木纳格葡萄果梗的总酚含量与果梗褐变指数呈极显著相关,相关系数分别为0.875、0.932。多酚类物质一般分布细胞液泡内,由于木纳格葡萄果梗的相对电导率和MDA 含量高于红提葡萄,细胞膜的破坏程度较高,加快细胞质流动、细胞水分流失、多酚类物质流出,褐变进程加快;由于葡萄品种间褐变的作用底物不同,与PPO 的结合能力差异,导致褐变进程的不同[29]。
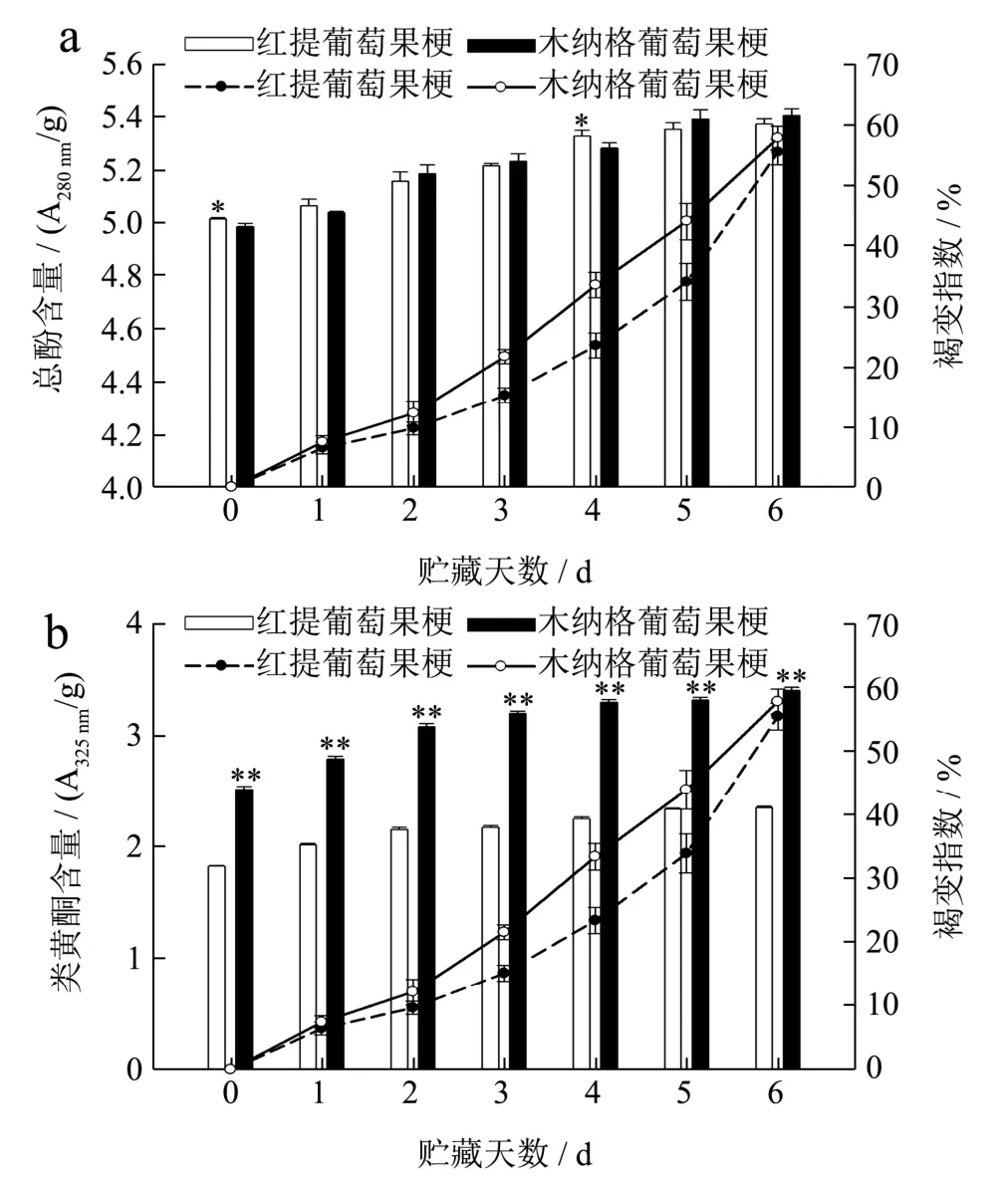
图4 葡萄果梗总酚(a)、类黄酮(b)含量与褐变指数的变化 Fig.4 Changes between the content of total phenols and flavonoids in grape rachis
类黄酮是存在于果蔬中的天然色素,也是植物组织内抗氧化物质之一。贮藏期间,随着褐变指数的增加,类黄酮含量呈上升趋势。在对鲜切慈姑褐变的研究中也发现,鲜切慈姑的褐变度随着类黄酮含量的增加而增加[30],与本试验结果一致。由于品种差异,木纳格葡萄果梗类黄酮含量极显著高于红提葡萄(p<0.01),但褐变指数高于红提葡萄果梗。贮藏至第6 d,木纳格葡萄果梗类黄酮含量比红提葡萄高44.79%。通过以上数据说明,葡萄果梗褐变指数随着总酚、类黄酮含量的上升而增加。
2.5 葡萄果梗PPO、POD、PAL 活性的变化
在贮藏期间,随着果梗褐变指数的增加,PPO、POD、PAL 活性呈现先上升,后下降的趋势。可能是在贮藏期间,葡萄果皮和果梗裸露在外,PPO、POD、PAL 活性被激活,启动了葡萄的自我保护机制,造成褐变相关酶活性的上升;随着防御机制启动的完毕,已经适应了贮藏环境,造成褐变相关酶活性的下降[31]。由图5a 可知,葡萄果梗的PPO 活性均呈现先上升后下降的趋势,与李江阔等[32]研究葡萄果实中的趋势相同。贮藏期间,红提葡萄果梗的PPO 活性显著低于木纳格葡萄(p<0.05)。贮藏至第5 d,红提葡萄果梗的PPO 活性出现峰值,为0.95 U/g。贮藏至第6 d,木纳格葡萄果梗的PPO 活性出现峰值,为2.36 U/g。酚类物质存在于细胞液泡中,PPO 存在于细胞膜、细胞壁及细胞质中,正常植物细胞中不会发生褐变。由于木纳格葡萄果梗的相对电导率高于红提葡萄果梗,表明木纳格葡萄果梗细胞结构受到的破坏程度较高;细胞区域分布被打破,加快PPO 与酚类底物、醌类化合物的氧化反应,醌类化合物进一步聚合形成呈现褐色、棕色或黑色的聚合物,促进褐变进程。
在不同品种葡萄果实的研究中发现,克瑞森葡萄的POD 活性较高,O2-·和H2O2含量较低,表现出优良的贮运品质[33]。由图5b 可知,葡萄果梗的POD活性均呈现先上升后下降的趋势,红提葡萄果梗的POD 活性始终极显著高于木纳格果梗(p<0.01)。贮藏至第3 d,两种葡萄品种果梗的POD 活性,均出现峰值。红提果梗POD 的峰值,为3.22 U/g。木纳格葡萄果梗POD 峰值,为0.20 U/g,是红提葡萄果梗的6.12%。木纳格葡萄果梗中H2O2含量较高,POD在H2O2含量高的条件下,催化果梗中酚类底物和类黄酮化合物的氧化聚合,加速果梗中酚类物质的代谢,造成膜脂过氧化程度高,从而加速褐变[34]。
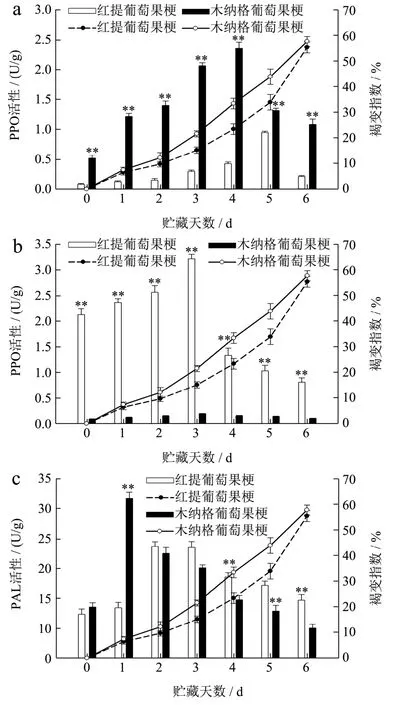
图5 葡萄果梗PPO(a)、POD(b)、PAL(c)活性的变化 Fig.5 Changes of PPO,POD,PAL activity of grape rachis
PAL 可以影响酚类物质的合成,能够作为褐变的重要指标。由图5c 可知,葡萄果梗的PAL 活性均呈现先上升后下降的趋势。在贮藏前期,木纳格葡萄果梗的PAL 活性高于红提葡萄果梗。在第1 d,差异极显著(p<0.01),木纳格葡萄果梗的PAL 活性比红提葡萄果梗高57.56%。贮藏至第4~6 d,红提葡萄果梗的PAL 活性分别比木纳格葡萄果梗高29.38%,42.38%,46.36%。但在贮藏期间,木纳格葡萄果梗的褐变指数高于红提葡萄果梗。木纳格葡萄果梗中苯丙氨酸的含量较高,在PAL 催化作用下生成肉桂酸,并进一步转化为各种酚类化合物,为褐变提供反应底物,加速褐变。
2.6 葡萄果梗SOD、CAT、APX 活性的变化
由图6 可知,贮藏期间,SOD、CAT、APX 活性呈先上升,后下降的趋势,与Lo’ay 等[18]在不同砧木对无核白葡萄簇的影响中的研究结果相类似。贮藏至第6 d,红提葡萄果梗SOD、CAT 活性分别是木纳格葡萄的1.02 倍、2.19 倍。除第2 d 外,红提葡萄果梗的APX 活性显著高于木纳格葡萄(p<0.05);贮藏第3 d 时,红提和木纳格葡萄果梗的APX 活性均出现峰值,分别是80.67 U/g,69.22 U/g。红提葡萄果梗的APX 活性比木纳格葡萄果梗高16.33%。活性氧主要由叶绿体和线粒体等具有高氧化代谢活力或者维持电子传递的细胞器产生。SOD 是酶促清除系统中的第一道屏障,不仅可以将O2-·歧化为H2O2和O2,而且能阻止氧化的Fe3+重新受O2-·作用还原成Fe2+,而催化形成毒性更强的羟基(·OH)。CAT 可以清除高浓度H2O2,减少H2O2对组织造成的氧化伤害[35]。APX 可以通过氧化抗坏血酸清除H2O2,在一定程度上,减少氧自由基对果蔬的破坏[36]。本研究发现,木纳格葡萄果梗褐变指数高于红提葡萄,可能是木纳格葡萄果梗SOD、CAT、APX 活性低于红提葡萄,增加活性氧的积累,加快膜脂过氧化程度,破坏细胞膜结构完整性;导致细胞区室化的丧失,使位于质体和其他细胞器中的多酚氧化酶和过氧化物酶与位于液泡中的酚类底物接触,形成棕色聚合物,加快褐变的发生。

图6 葡萄果梗SOD、CAT、APX 活性变化 Fig.6 Changes analysis of the activity of SOD,CAT,APX of grape rachis
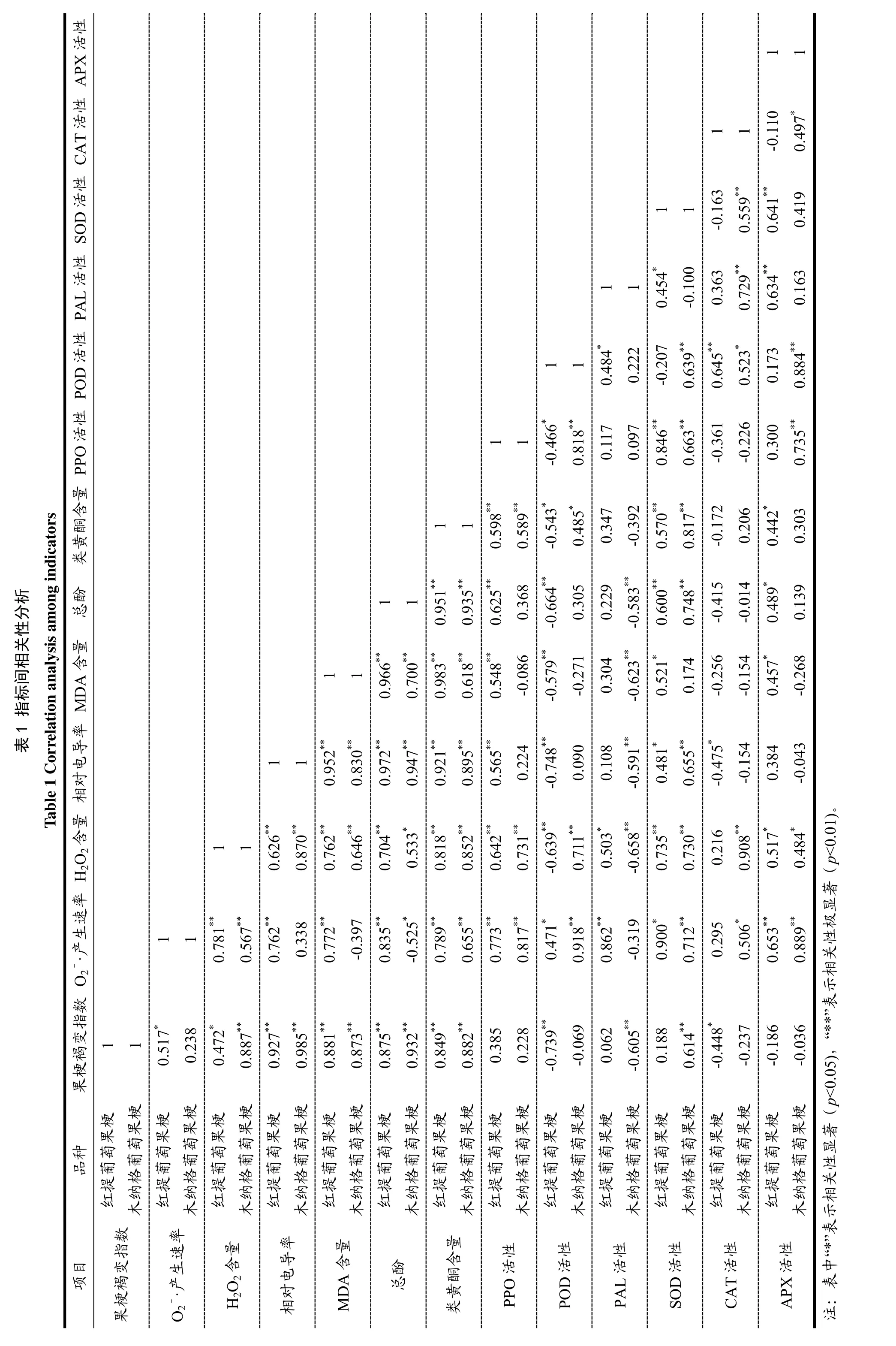
2.7 相关性分析
由表1 可知:红提葡萄果梗O2-·产生速率与MDA含量(r=0.772**)、总酚(r=0.835**)呈极显著正相关;PPO 与MDA 含量(r=0.548**)呈极显著正相关;POD与H2O2含量(r=-0.639**)、相对电导率(r=-0.748**)、总酚(r=-0.664**)、类黄酮含量(r=-0.543*)及PPO活性(r=-0.466*)呈显著负相关,PAL 与果梗褐变指数(r=0.062)、O2-·产生速率(r=0.862**)、H2O2含量(r=0.503*)、相对电导率(r=0.108)、MDA含量(r=0.304)、总酚(r=0.229)及类黄酮(r=0.347)呈正相关;SOD 与POD(r=-0.207)呈负相关,与PAL(r=0.454*)呈显著正相关;CAT 与类黄酮含量(r=-0.172)呈负相关,与SOD(r=-0.163)呈负相关;APX 与相对电导率(r=0.384)、MDA 含量(r=0.457*)呈正相关,与CAT(r=-0.110)呈负相关。
木纳格葡萄果梗O2-·产生速率与MDA 含量(r=-0.397)呈负相关,与总酚(r=-0.525*)呈显著负相关,PPO 与MDA 含量(r=-0.086)呈负相关;POD与H2O2含量(r=0.711**)、相对电导率(r=0.090)、总酚(r=0.305)、类黄酮含量(r=0.485*)及PPO 活性(r=0.818**)呈正相关,PAL 与果梗褐变指数(r=-0.605**)、O2-·产生速率(r=-0.319)、H2O2含量(r=-0.658**)、相对电导率(r=-0.591**)、MDA含量(r=-0.623**)、总酚(r=-0.583**)及类黄酮含量(r=-0.392)呈负相关;SOD 与POD(r=0.639**)呈极显著正相关,与PAL(r=-0.100)呈负相关;CAT与类黄酮含量(r=0.206)、及SOD(r=0.559**)呈正相关;APX 与相对电导率(r=-0.043)、MDA 含量(r=-0.268)呈负相关,CAT 活性(r=0.497*)呈正相关。
葡萄果梗褐变指数与H2O2含量、相对电导率、MDA 含量、总酚及类黄酮呈显著正相关(p<0.05);红提、木纳格葡萄果梗褐变指数与PPO 的相关系数分别为0.385,0.228。红提葡萄果梗褐变指数与POD活性、CAT 活性呈显著负相关(p<0.05),相关系数分别为-0.739,-0.448。木纳格葡萄的果梗褐变指数与PAL 活性呈极显著负相关(p<0.01),相关系数为-0.605;与SOD 活性呈显著正相关(p<0.05),相关系数为0.614;可能是由于葡萄果梗之间生理结构的不同、酶的活力及作用条件存在差异性,导致各指标间不同的相关性,同一种酶对果梗褐变的影响程度也不同。
3 结论
在10±0.5℃条件下,由于红提葡萄果梗具有较高的总酚、SOD、CAT、POD、APX、PAL 活性,可以延缓果梗相对电导率、MDA 含量的上升及活性氧的积累,减少细胞膜损伤,使PPO 活性、H2O2含量保持在较低水平,减慢果梗褐变速度,葡萄果梗褐变进程与抗氧化酶密切相关。因品种之间果梗生理结构的差异,引起果梗褐变的抗氧化酶有所不同。通过相关性分析发现,POD 和CAT 可能是影响红提葡萄果梗褐变主要因素,SOD 和PAL 可能是影响木纳格葡萄果梗褐变的主要因素。抗氧化酶基因调控对不同葡萄品种果梗褐变的影响仍需进一步深入研究。