CRS+HIPEC联合胸腔灌注+系统化疗治疗腹膜间皮瘤并胸腔转移1例及文献复习
2021-06-16闫国军姬忠贺杜雪梅
闫国军 刘 刚 姬忠贺 杜雪梅 李 雁,*
(1. 首都医科大学附属北京世纪坛医院腹膜肿瘤外科,北京 100038; 2. 首都医科大学附属北京世纪坛医院病理科, 北京 100038)
恶性间皮瘤是一类主要原发于腹膜和胸膜的罕见恶性肿瘤。研究[1]表明,恶性间皮瘤的发生与石棉接触密切相关,美国恶性间皮瘤发病率4.5/100万,由于近年来石棉应用的减少,恶性间皮瘤的发病有下降趋势。我国胸膜间皮瘤的发病率为0.3/10万-0.5/10万,腹膜发病仅次于胸膜发病[2]。由于发病率低,无特异性表现,早期诊断困难,导致误诊率较高,延误治疗时机,临床预后差。
由于恶性间皮瘤可累及胸腹腔多个脏器,无法根治,恶性间皮瘤的传统治疗原则是姑息治疗。行胸腹腔结节穿刺或胸腹腔镜探查活检,获得病理诊断,然后进行姑息性化学药物治疗(以下简称化疗)加支持治疗。如果出现严重的恶性胸腔积液或腹腔积液,则有限引流加胸腹腔内注射药物治疗,控制症状,进行姑息支持治疗,在此种治疗模式下,中位生存期仅为6~12个月[3]。
进入21世纪后,恶性间皮瘤的治疗模式发生了很大转变,尤其是针对恶性腹膜间皮瘤,治疗原则已经上升为积极彻底手术联合围手术期辅助化疗,主要治疗技术是手术中行肿瘤细胞减灭术(cytoreductive surgery, CRS)加腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy, HIPEC),同时配合术后辅助化疗。Verma等[4]研究发现,采取以CRS+HIPEC为基础的综合治疗策略,患者可有明显生存获益。本中心收治了1例同时发生腹膜-胸膜恶性间皮瘤的患者,采用CRS+术中胸腹腔热灌注化疗(hyperthermic intrapleural-intraperitoneal chemotherapy,HIPPEC)联合术后胸腔灌注化疗(intrapleural perfusion chemotherapy, IPC)加系统化疗模式治疗,截至2020年3月,无病生存超过45个月,临床疗效显著,现报道如下。
1 临床资料
1.1 病例资料
患者女性,49岁,因“腹胀半年,咳嗽伴气短1个月,发现胸腹腔积液半个月”于2016年6月21日转入本院。2016年1月出现无明显诱因腹胀,后腹胀逐渐加重,2016年6月1日出现咳嗽伴胸闷气短,进行性加重。2016年6月7日行腹部超声检查提示“胸腹腔积液”。胸部X线片提示右侧大量胸水,胸部电子计算机断层扫描(computed tomography,CT)检查提示右肺中叶及下叶炎症改变,腹部CT提示腹水,不除外腹膜转移病变。行胸腔闭式引流术,引出血性胸水;同时行经阴道后穹隆穿刺抽取盆腔积液,为血性腹水,细胞学检查发现肿瘤细胞(胸水),病理提示可能为腺上皮或间皮源性。CA125 468.2 U/mL,正电子发射计算机断层显像(positron emission tomography,PET)/CT检查提示:腹盆腔多处腹膜结节样增厚,代谢增高;腹部肠系膜弥漫增厚伴代谢增高;考虑恶性,腹膜多发转移可能,左侧附件实性病变伴异常代谢,不除外原发肿瘤性病变。同时胸水涂片经解放军总医院病理会诊:考虑间皮瘤。患者以“腹膜恶性肿瘤”转入院。既往体健。体格检查见右侧可见胸腔闭式引流管,双肺呼吸音清,未闻及干湿性啰音,腹部略膨隆,移动性浊音(±)。
实验室检查:糖类抗原199(carbohydrate antigen199,CA199) 19.2 U/mL,CA125 341.6 U/mL,CA153 17.4 U/mL,癌胚抗原1.03 ng/mL,甲胎蛋白3.75 ng/mL,CA724 0.73 ng/mL。
腹部增强CT(2016年6月21日,本院):1)腹膜多发、多部位软组织结节,盲肠肠系膜侧异常强化结节,腹盆腔积液(图1A~B);2)冠状位CT可见小肠积气,腹盆腔大量积液,肠系膜多发结节,右侧膈肌增厚(图1C);3)考虑子宫多发肌瘤,右附件区占位。
胸部CT平扫+增强:右心膈角结节,转移瘤?考虑双肺炎症,左肺下叶结核,前纵膈缩减,考虑残余胸腺(图1D)。

图1 患者术前胸腹部CT检查
全消化道造影(2016年06月28日,本院):胃大弯改变,腹腔占位,粘连不除外,小肠运动过快,右膈膨隆,少量盆腔积液。
初步诊断:腹膜恶性间皮瘤,胸膜恶性间皮瘤,腹腔积液,胸腔积液。
1.2 方法
入院完善相关检查后,腹膜癌综合治疗团队讨论,患者恶性间皮瘤诊断成立,考虑腹腔为原发部位,右侧胸膜为肿瘤侵透膈肌形成的同时性转移,累及胸膜引起胸腔积液,考虑胸膜为转移病灶,且病灶位于右侧心膈角,经腹手术切开膈肌可同时处理胸膜肿瘤;术前各项检查未见远处转移,无手术绝对禁忌证。可考虑行剖腹探查,CRS+HIPPEC。切除肿瘤获取明确病理诊断,同时减轻肿瘤负荷,配合术中胸腹腔联合热灌注化疗,争取控制肿瘤生长,缓解患者症状,提高患者生存质量,延长生存。
2016年6月30日在全身麻醉下行剖腹探查+CRS+HIPPEC。腹腔探查:腹盆腔大量黄色腹水,总量约2 000 mL,缓慢吸净腹水,大网膜(图2A)、双侧膈肌腹膜、两侧结肠旁沟腹膜、阑尾、结肠及肠系膜表面(图2B)、盆底腹膜表面(图2C)、小肠系膜表面(图2D)可见大量大小不等肿瘤结节,最大者位于大网膜上,直径约6 cm,肿瘤呈菜花状,右侧膈肌腹膜肿瘤侵犯膈肌实质,脾门可见片状肿瘤组织侵犯,腹膜癌指数(peritoneal cancer index,PCI)[5]评分27 分,于大网膜上剔除肿瘤结节1枚,送冰冻病理,结果回报倾向于间皮瘤,术中诊断腹膜恶性间皮瘤,遂决定行CRS+HIPPEC术。
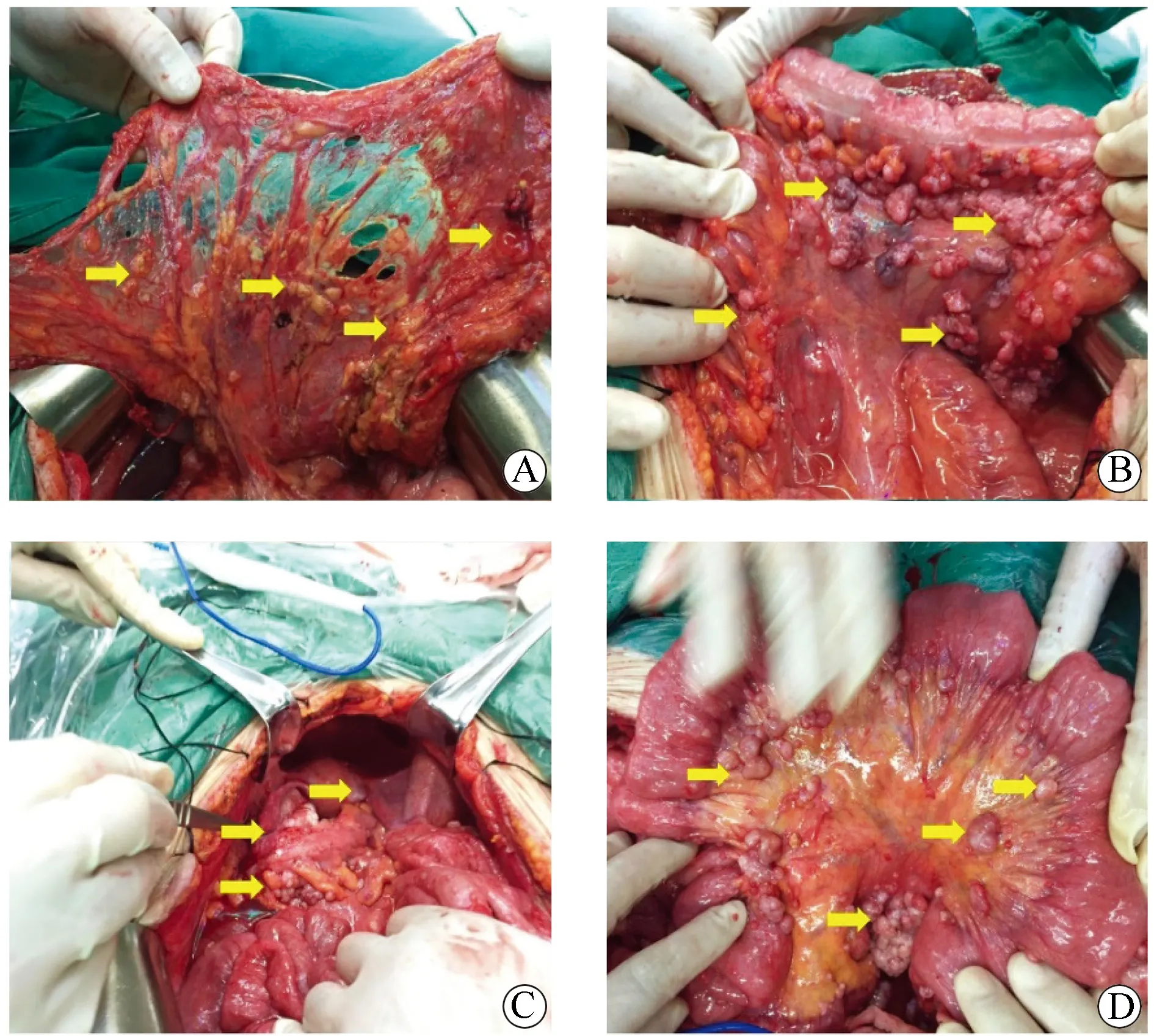
图2 患者术中所见腹膜间皮瘤主要特点
腹腔肿瘤切除:切除肝圆韧带、大网膜(图3A)、脾脏、全子宫+双附件+盆底腹膜、右半结肠,切除双侧膈肌表面肿瘤及部分膈肌(图3B),电刀烧灼灭活肠系膜及肠壁表面肿瘤(图3C、D),术后细胞减灭程度 (completeness of cytoreduction,CC)评分为1分。

图3 患者完成手术后的腹腔所见
胸腔肿瘤切除:切开右侧膈肌,探查发现右侧心膈角处肿物,约1.0 cm×2.0 cm,切除肿物及部分受累膈肌。
CRS完成后,行开放式HIPPEC,化疗药物为顺铂120 mg、丝裂霉素30 mg,分别溶解于3 000 mL 0.9%(质量分数)氯化钠注射液(以下简称生理盐水)中,加热至43 ℃,以400 mL/min流量,行持续热灌注化疗各 30 min。体管置于膈肌下方,使化疗药液在腹腔及右侧胸腔内充分循环。HIPPEC结束,修补膈肌并放置胸腔闭式引流,行消化道重建,回结肠端侧吻合。术后对症支持并康复治疗,恢复过程顺利,术后13 d出院。
术后病理检查(大体标本,图4A):肝圆韧带、膈肌肿瘤、大网膜、脾、全子宫+双附件+盆腔病损+左结肠旁沟、胸腔肿物、右胸腔肋膈角肿物。
组织学病理:上皮型恶性间皮瘤(图4B),累及肝圆韧带、膈肌肿瘤、右胸腔肋膈角、回盲部、阑尾浆膜层、大网膜、脾、子宫、双附件、胸腔(图4C),未见脉管瘤栓及神经侵犯,淋巴结未见转移癌(0/16)。
免疫组化结果:CK(+),CAM5.2(+),VIM(+),Calretinin(+)(图4D),MC(+),CK7(+),CK20(-),CA125(+),WT-1(+),ER(-),PR(部分+),P53(+),CK5/6(+)(图4E),Ki-67(8%)(图4F),Pax8(-),CDX2(-)。

图4 患者肿瘤标本的病理学特点
术后辅助静脉化疗:2016年8月2日、2016年8月23日、2016年9月14日、2016年10月12日分别行4个周期培美曲塞+顺铂静脉化疗:培美曲塞800 mg静脉滴注(IV) +顺铂120 mg IV,每3周一次(q3w)。2017年1月12日行第5周期静脉化疗:培美曲塞800 mg IV,顺铂120 mg IV,q3w。2017年2月9日行第6周期静脉化疗:培美曲塞800 mg IV,顺铂120 mg IV,q3w。
术后胸腔灌注化疗:2016年10月31日复查胸片提示,右侧胸腔积液较前增多。2016年10月31日行超声引导下右侧胸腔积液置管引流术。胸水细胞学检查提示可见间皮细胞。引出370 mL深黄色液体。放净胸水后给予胸腔灌注化疗:紫杉醇60 mg D1,D3,顺铂40 mg D2,D4。2016年11月26日给予胸腔灌注化疗:紫杉醇120 mg D1,D3,顺铂60 mg D2,D4。
化疗结束后行胸腹部CT检查提示病情平稳,未见明显进展征象。后患者定期复查随诊。
1.3 随访及转归
截至2020年3月20日,患者一般状态良好,无肿瘤复发征象,无病生存大于45个月,总体生存期超过50个月(图5)。

图5 患者治疗过程总结
2 讨论
恶性间皮瘤来源于间皮细胞,可发生于胸膜、腹膜、心包膜等处,腹膜发病仅次于胸膜发病,居第2位,腹膜恶性间皮瘤大约占所有恶性间皮瘤的10%~20%[6]。国内外多是以个案报道的方式报道腹膜恶性间皮瘤同时伴胸膜恶性间皮瘤。Del Gobbo等[7]于2014年曾报道1例同时性胸腹膜恶性间皮瘤病例,进行了姑息性化疗,预后较差。同时性胸腹膜恶性间皮瘤早期缺乏典型临床表现,可表现为胸闷、气短、腹痛、腹胀、胸腹水等[8],往往不能引起足够重视,延误诊断与治疗,最终导致预后差,如不积极治疗,中位生存期仅为6~9个月[3]。
腹膜恶性间皮瘤伴胸膜恶性间皮瘤由于其同时累及胸膜及腹膜,病变范围更加广泛,肿瘤负荷较单纯胸膜恶性间皮瘤或腹膜恶性间皮瘤更重,被认为是Ⅳ期肿瘤或肿瘤的终末期,姑息支持治疗或姑息化疗为主要治疗手段,预后极差。手术是使实体肿瘤获得治愈可能的唯一治疗手段。胸膜外全肺切除术(extrapleural pneumonectomy,EPP)和胸膜部分切除术(pleurectomy /decortication,P/D)为针对胸膜恶性间皮瘤常用的手术方式,也是针对胸膜恶性间皮瘤的一种肿瘤细胞减灭术。研究[9-12]表明,EPP或P/D联合围手术期辅助化疗,可使恶性胸膜间皮瘤患者明显获益,EPP使患者获益更加明显,可以达到最大程度的肿瘤细胞减灭,但是有较高的并发症发生率和病死率。Migliore等[13]于2015年对胸膜恶性间皮瘤行CRS+胸腔热灌注化疗(hyperthermic intraoperative intrapleural chemotherapy,HITHOC)进行了初步探讨,发现效果良好,患者获益明显。近二十年来,得益于CRS+HIPEC技术的不断进步,腹膜恶性间皮瘤的患者预后得到明显改善,CRS+HIPEC已成为腹膜恶性间皮瘤的一种标准治疗方式。腹膜恶性间皮瘤为原发于腹膜的病变,Jin等[14]研究发现,CRS+HIPEC相比于化疗或对症支持治疗,可有效延长患者生存期。综上,肿瘤细胞减灭术+热灌注化疗在胸膜或腹膜恶性间皮瘤患者的预后中起着非常重要的作用。
无论是针对胸膜恶性间皮瘤的CRS+HITHOC还是针对腹膜恶性间皮瘤的CRS+HIPEC,都遵循最大程度的肿瘤细胞减灭原则,同时联合术中的胸腔或腹腔的热灌注化疗,最大程度杀灭肿瘤细胞,力争达到细胞学水平根治。胸腹腔联合肿瘤细胞减灭术+联合热灌注化疗为同时性胸腹膜恶性间皮瘤的治疗提供了一个思路。但肿瘤细胞减灭术的手术创伤较大,对于同时性胸腹膜恶性间皮瘤的患者,需做好患者的术前评估与筛选,才能使患者获得最大生存获益。
本例患者为同时性胸腹膜恶性间皮瘤,病期晚,肿瘤负荷重,如采用传统治疗方式,预计生存期不足1年。患者转诊于本中心后,腹腔行CRS达到CC-1,减灭肉眼可见肿瘤,最大程度减轻了腹腔肿瘤负荷。对于胸腔转移病灶,也采取了CRS,切除转移灶,减灭肿瘤,术中开放膈肌行胸腹腔联合热灌注化疗,从细胞水平减灭肿瘤。胸腹腔联合行CRS+HIPPEC,从原发灶到转移灶,从组织学层面到细胞学层面,最大程度减轻了肿瘤负荷,为后续的辅助化疗奠定基础。培美曲塞联合顺铂为恶性间皮瘤的一线化疗方案[15]。但CRS+HIPEC术后是否行全身化疗仍有争议,Yan等[16]研究发现,CRS+HIPEC术后行全身化疗与未行全身化疗的中位生存期分别为76个月和53个月,有延长趋势,但差异无统计学意义。培美曲塞联合顺铂的化疗方案对胸膜恶性间皮瘤患者有明显生存获益[17]。术后全身化疗是在充分减灭肿瘤的基础上进行,而全身化疗由于血腹膜屏障与血胸膜屏障的存在,难以在局部达到较高的药物浓度。局部灌注化疗多用于控制胸腹水,缓解腹胀胸闷等症状。此例患者术后再次出现胸水,给予胸腔灌注化疗,化疗药物在局部达到较高药物浓度,进而控制肿瘤进展。CRS+HIPPEC充分降低了肿瘤负荷,辅助系统与局部治疗,从而使患者获得长期生存。
综上所述,本文报道了CRS+HIPPEC联合胸腔灌注加系统化疗成功治疗1例同时性胸腹膜恶性间皮瘤患者,结合文献分析,该策略为解决同时性胸腹膜恶性间皮瘤的治疗难题并使患者获得长期无病生存提供了一种治疗策略,但其疗效和安全性仍需高级别循证医学证据验证。
