NLE1在结肠癌中的表达及其对HT29细胞增殖凋亡的影响
2021-06-16刘揆亮李楠杉李文坤王亚丹
刘揆亮 李楠杉 吴 静* 李文坤 李 倩 王亚丹
(1. 首都医科大学附属北京友谊医院消化内科,北京 100050; 2. 首都医科大学附属北京世纪坛医院消化内科,北京100038;3. 首都医科大学附属北京同仁医院科技处,北京 100730)
结肠癌(colon cancer,CC)的发生发展大多存在一个特征性的病理变化过程,即由结直肠腺瘤起源,沿腺瘤-腺癌序列发展而来。深入探讨其潜在机制,寻找有效的诊治标志物及药物靶点对于结直肠癌的早期诊治及预后改善具有重要意义[1]。笔者前期采用miRNA和LncRNA芯片筛选结直肠腺瘤-腺癌序列中差异表达生物标志物时[2-3],发现Notchless同源物1(Notchless homolog 1,NLE1) 在结肠正常黏膜、腺瘤、腺癌组织中的表达逐步升高,提示其可能在腺瘤-腺癌序列的发展过程中发挥一定作用。本研究旨在验证NLE1在结肠腺瘤及腺癌组织中的表达水平,并初步探讨其功能。
1 材料与方法
1.1 实验材料
组织芯片为商业化产品(上海芯超公司,HCol-Ade060CS1-01,HCol-Ade075Pre-01),共105例结肠癌[美国癌症联合委员会(American Joint Committee on Cancer,AJCC) Ⅰ-Ⅱ期]及癌旁组织标本,25例腺瘤[合并高级别上皮内瘤变(high-grade intraepithelial neoplasia, HGIN)]标本。实时荧光定量PCR检测所用组织标本包括25例结肠癌(AJCC Ⅰ-Ⅱ期),30例结肠腺瘤及40例正常对照组织。本研究经首都医科大学附属北京世纪坛医院伦理委员会批准,均取得患者知情同意。
1.2 主要试剂
HT29细胞株(北京协和细胞资源中心);TaqMan PCR试剂盒(Applied Biosystem公司,美国); GV115慢病毒载体(上海吉凯生物技术有限公司);脂质体2 000转染试剂(Invitrogen公司,美国);Caspase3/7检测试剂盒(G8091,Promege公司,美国),NLE1兔抗人多克隆抗体(NBP1-83860,Novus公司,美国);Fas兔抗人多克隆抗体(#2764,CST公司,美国);Bax兔抗人多克隆抗体(50599-2-Ig ,Proteintech公司,美国);GAPDH鼠抗人单克隆抗体(sc-32233,Santa Cruz公司,美国);辣根酶标记山羊抗小鼠IgG和辣根酶标记山羊抗兔IgG(中杉金桥公司)。
1.3 方法
1) 实时荧光定量PCR: NLE1与GAPDH 的引物序列如下:NLE1(F:5′- CCAGGACCGCACCATCAAAG-3′;R:5′-TCGTCGGAGCCAGACACCAG-3′); GAPDH(F:5′-TGACTTCAACAGCGACACCCA-3′;R:5′- CACCCTGTTGCTGTAGCCAAA-3′)。按试剂盒说明书方法进行检测,记录循环阈值(cycle threshold,Ct)值。样品目的基因表达水平采用相对定量的△△Ct方法计算。
2) 免疫组化:免疫组化染色采用Envision二步法。以镜下见棕黄色或褐色颗粒为阳性。高倍镜下(400×)随机选取3个视野观察着色强度,染色强度分析:0~3分,0分表达缺失(无染色)、1分表达减弱(淡黄色)、2分中等表达(黄色)、3分强表达(黄褐色);染色细胞范围分析:0~3分,0分无染色细胞、1分<10%、2分10%~50%、3分>50%。两个系统分数相加为总表达强度,0分为(-),1~2分为(+),3~4分为(++),5~6分为(+++)。(-)与(+)记入低表达,(++)与(+++)记入高表达[4]。
3) 慢病毒的合成及转染: NLE1-shRNA及对照shRNA序列为:5′-GACAGAGAAGGTCCTAGACAT-3′;5′-GACAGAGAAGGTCCTAGACAT-3′。
构建重组载体 pGCSIL-shNLE1 和 pGCSIL-shCtrl,慢病毒颗粒包装后进行转染。将待转染细胞(5×104个/孔)接种到6 孔板后,pGCSIL-shNLE1 慢病毒 或 对照shRNA慢病毒分别转染HT29细 胞, 于37 ℃,5%(体积分数)CO2培养孵育72 h,PCR及Western blotting方法明确敲除效率。后续实验根据转染的慢病毒分为shNLE1组与shCtrl组。
4) 增殖与凋亡的检测:用慢病毒转染的HT-29 细胞进行检测。增殖检测中,在96孔板中转染的细胞(3×103/μL)放入培养箱中培养1~5 d,每日培养终止前4 h加入10 μL噻唑蓝[3-(4,5)-dimethylthiahiazo(-2)-3,5-diphenytetrazoliumromide,MTT](5 g/L),之后加入100 μL 二甲基亚砜(dimethyl sulfoxide,DMSO),酶标仪检测吸光度490 nm的吸光度值,确定细胞增殖水平。集落形成试验中,将慢病毒转染的HT-29 细胞(1×103个/孔),接种在6 孔板中并孵育10 d 以形成集落,每2 d更换新鲜培养基,随后PBS洗涤细胞,4%(质量分数)多聚甲醛固定30~60 min,PBS洗涤,Giemsa染液染色后,光学显微镜下计数含有>50个细胞的菌落总数,检测集落形成数量。凋亡检测中,转染后悬浮细胞(1×104/mL)于96孔板,培养5 d后,每孔加入100 μL Caspase反应液培养,室温孵育1~2 h后测定信号强度,检测细胞凋亡水平。
5) Western blotting检测:取相应一抗(均为1∶500),检测方法同前[4]。
1.4 统计学方法
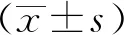
2 结果
2.1 NLE1在结肠腺癌及腺瘤组织中的差异表达
组织芯片中NLE1抗体的免疫组化结果显示,在正常结肠黏膜中偶见上皮细胞胞核着色;在结肠腺瘤组织中,可见NLE1表达增强,以上皮细胞胞核阳性表达为主;在结肠腺癌组织中,可见肿瘤细胞胞质与胞核阳性表达(图1A)。在结肠正常黏膜、腺瘤及腺癌组织中,NLE1的高表达率分别为14.3% (15/105),44.0% (11/25)及68.6% (72/105),腺癌组织中的NLE1表达水平明显高于腺瘤及正常黏膜(分别为P<0.05,P<0.01);腺瘤组织中的NLE1表达水平明显高于正常黏膜(P<0.001)。实时荧光定量PCR分析显示,结肠正常黏膜、腺瘤及腺癌组织三组的NLE1 mRNA表达分别为1.38±0.82,5.04±2.09,7.57±1.25。腺癌组织中NLE1表达水平明显高于腺瘤及正常黏膜(P<0.05,P<0.01);腺瘤组织中的NLE1表达水平明显高于正常黏膜(P<0.01)(图1B)。

图1 结肠腺瘤-腺癌序列中NLE1的表达水平
2.2 NLE1对HT29细胞增殖凋亡的影响及其可能机制
应用沉默NLE1的慢病毒及对照转染HT29细胞后,Western blotting检测结果显示,与shCtrl组相比,shNLE1组的表达受到明显抑制,提示沉默有效(图2A)。转染后96 h及120 h时检测发现,shNLE1组HT-29细胞增殖水平较shCtrl组显著降低(P<0.01)(图2B),细胞凋亡水平显著增高(P<0.05)(图2C),集落形成能力也显著降低(P<0.05)(图2D)。Western blotting检测结果显示,与shCtrl相比,shNLE1组的HT29细胞中Fas与Bax蛋白的表达水平显著升高(图3)。
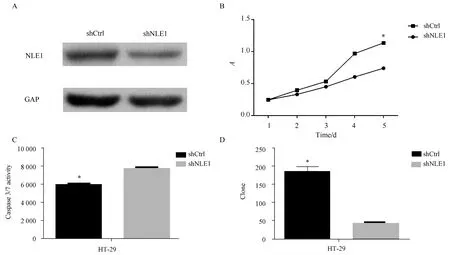
图2 NLE1沉默抑制HT29细胞增殖,促进其凋亡
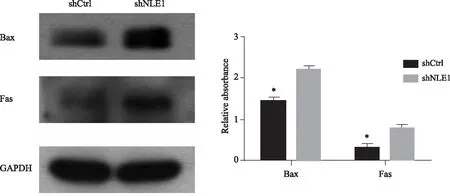
图3 NLE1沉默显著促进HT29细胞中Bax与Fas的表达
3 讨论
结肠癌的发生发展大多经过腺瘤腺癌序列,在腺瘤及早期腺癌阶段,尽早发现病变,对于降低结肠癌的发病率和病死率具有重要意义[1]。虽然目前早期发现结肠腺瘤及腺癌仍有赖于肠镜检查,但生物标志物对于结肠癌及癌前病变的早期诊断也具有重要意义。一直以来,研究人员为寻找理想的胃肠道肿瘤的生物标志物进行了大量研究,不过,专门针对早期胃肠道肿瘤的生物标志物的研究较为少见。一项研究[5]针对早期胃癌、进展期胃癌与正常组织进行表达谱芯片分析,在正常组织与早期胃癌以及早期胃癌与进展期胃癌的比较中分别发现了1 024个与415个差异表达的基因,两组基因间仅有46个重叠,提示早期胃肠道肿瘤与进展期肿瘤组织中的肿瘤生物标志物可能存在差异。有必要针对早期肿瘤组织进行分析以寻找相应的生物标志物。
本课题组在前期的研究[3]中针对早期阶段结肠癌、结肠腺瘤及正常组织的各种分子表达差异进行筛选,发现了一些可能成为新型分子标志物的非编码基因,在前期研究的数据中,针对编码基因的分析发现,NLE1在结肠腺瘤及早期阶段结肠癌中的表达也逐步升高,并存在明显的表达差异。提示其可能在结肠腺瘤及早期结肠癌的发生发展过程中发挥一定作用。本研究中,笔者首先通过免疫组化的方法,在包含结肠腺瘤及腺癌组织的组织芯片中分析了NLE1在结肠癌组织、腺瘤(高级别上皮内瘤变)组织及癌旁正常黏膜中的表达水平的变化,从蛋白层面证实了NLE1在结肠腺瘤/腺癌组织中表达逐渐增强。进一步的实时荧光定量PCR检测明确了NLE1在mRNA水平上的表达异常。证实NLE1在结肠腺瘤及腺癌组织中存在高表达。
有关NLE1功能的报道目前并不太多。Notch信号通路是结直肠癌中发挥促癌作用的一条重要通路[6]。NLE1是在寻找Notch通路信号调节剂时发现的,其编码的含WD40重复序列的蛋白可与Notch受体的胞质内结构结合发挥作用[7-8]。作为Notch信号通路的调节剂,
NLE1参与了一些重要的生理过程,尤其是核糖体60S大亚基的生物合成,在小鼠的轴向骨骼形成及儿童期癫痫小发作中发挥重要作用[9-10]。近年研究[11]显示,NLE1还具有维持肠道干细胞及造血干细胞稳态的作用。在小鼠肠道上皮内条件性敲除NLE1可激活p53,但并不影响Notch通路活性,提示其可能通过非Notch依赖的通路在肠道稳态的维持中发挥作用[11]。有关NLE1在恶性肿瘤中发挥何种作用目前报道不多。新近的一项研究[12]提出,在可自发出现肠道肿瘤的Apc缺陷小鼠体内敲除NLE1后,肿瘤细胞的增殖受到明显抑制,Apc缺陷小鼠的生存有改善,提示NLE1在结肠癌的发生中具有促癌作用。本研究中,为初步探索NLE1的功能,笔者采用慢病毒转染的方式,在HT29细胞中对NLE1进行了表达沉默,进一步的功能检测证实,NLE1沉默可显著抑制结肠癌HT29细胞的增殖能力,并能够促进其凋亡,这一结果与文献报道[12-13]相符。
NLE1参与促癌作用的机制目前仍不清楚。笔者的免疫组化染色显示,NLE1 在结肠癌组织中同时存在胞核与胞质的异常表达,而在结肠腺瘤及正常黏膜中则多为核表达,提示NLE1在结肠癌不仅有表达水平异常,表达定位也有变化,其确切作用及机制有待进一步研究。本研究在沉默NLE1后的HT29细胞中,通过Western blotting方法检测了Bax与Fas蛋白表达水平的变化,发现二者均有明显升高,提示在结肠癌中高表达的NLE1可能对这两种蛋白的表达有抑制作用。多项研究[14-15]显示,Bax与Fas均为促凋亡蛋白,多种抗肿瘤药物可通过上调Bax与Fas促进肿瘤细胞凋亡。因此笔者推测,结肠癌组织中高表达的NLE1有可能通过Bax与Fas调控凋亡信号,影响结肠癌肿瘤细胞的增殖与凋亡,进而发挥促癌作用。NLE1促进结肠癌发生发展的确切机制还有待进一步研究明确。
