单纯疱疹病毒感染后自身免疫性脑炎的研究进展
2021-06-16迟博闻王佳伟
迟博闻 王佳伟,2*
(1.首都医科大学附属北京同仁医院神经内科,北京 100730; 2. 首都医科大学附属北京同仁医院中心实验室, 北京 100730)
单纯疱疹病毒(herpes simplex virus, HSV)是散发性病毒性脑炎最常见的感染原因之一,其感染所致的单纯疱疹病毒性脑炎(herpes simplex virus encephalitis,HSE)是一种多以精神行为异常和人格改变为首发症状并可伴有不同程度神经功能缺损和癫痫发作的疾病。病毒主要侵犯颞叶、额叶和边缘系统,引起脑组织出血坏死性病变,在以往抗病毒药广泛应用之前,具有较高的发病率和病死率[1]。研究[2]显示,部分经过常规抗病毒治疗的HSE患者病情好转后,又出现新的神经系统症状,经过免疫治疗(皮质类固醇、血浆置换、免疫球蛋白和利妥昔单抗等)后,症状可得到缓解。与复发性单纯疱疹病毒性脑炎不同,这种神经系统症状与自身免疫性脑炎(autoimmune encephalitis, AE)有关。本文就HSE后继发自身免疫性脑炎的发病机制、临床表现、辅助检查、治疗方法等进行综述,为临床早期识别、及时治疗提供帮助。
1 HSE后继发自身免疫性脑炎的发展历史
2007年,Dalmau等[3]将抗N-甲基-D-天冬氨酸受体(anti-N-methyl-D-aspartate receptor, NMDAR)脑炎描述为:患有卵巢畸胎瘤的年轻女性潜在的可逆性免疫介导的副肿瘤性疾病被认为是非感染性青年脑炎的首位原因。随着与自身免疫性脑炎相关的抗体,如抗NMDAR抗体、抗γ-氨基丁酸受体A/B受体(gamma-amino butyric acid A/B receptor,GABAA/BR)抗体、抗胶质纤维酸性蛋白受体(glial fibrillary acidic protein receptor, GFAPR)抗体等的陆续发现,对脑炎的发病机制有了新的认识。研究[4]显示,除了副肿瘤综合征、免疫检查点抑制剂药物等因素外,病毒感染也是导致自身免疫性脑炎的重要激发因素。
部分被诊断为复发性单纯疱疹病毒性脑炎患者,脑脊液和血清学HSV病毒核酸检测阴性,复发期间应用抗病毒药物治疗无效[4],由此提示除HSV感染引起的直接神经元损害外,还存在他因素。HSE的动物实验[5]表明,病毒不仅可以直接侵害神经元导致坏死,导致病毒性脑炎的发生,而且可以通过免疫介导的抗体反应引起神经系统出现新的损害,导致感染后的自身免疫性脑炎的发生。这些感染除HSV外,亦可能继发其他的病毒感染,如日本乙型脑炎病毒、西尼罗河病毒、新冠病毒等感染。
2012年,Pruss等[6]报道了HSE患者中存在抗NMDAR抗体。2013年,Armangue等[7]在一位单纯疱疹病毒性脑炎患儿中发现,发病4周后患者血液中存在抗NMDAR抗体。后续研究[8]发现,27%的HSE患者出现继发AE,包括抗NMDAR脑炎(64%)和其他抗神经元表面蛋白抗体脑炎如GABAbR脑炎、LGI1脑炎、AMPAR脑炎等(36%)。30%HSE后未出现神经症状的患者血清和/或脑脊液中产生了自身抗体,包括NMDAR(27%)、其他抗体(73%)。随后,有研究[9]提出了“双峰脑炎”、“二次脑炎”等概念,临床医生早期关注此类患者提供了帮助。
2 HSE后继发自身免疫性脑炎的致病机制
关于HSV感染后所导致的自身免疫性脑炎发病机制有以下几种假说[10]。
第一,分子模拟[11]。即外源性病原体的抗原与宿主自身的抗原结构相似,针对外源性抗原产生的特异性抗体或效应性T细胞与宿主相应抗原产生交叉反应,从而引起自身免疫性损伤。但是,通过对脑脊液的分析未发现HSV病毒感染发生“分子模拟”的直接依据[12]。
第二,病毒感染后神经元崩解释放出自身抗原破坏中枢免疫耐受。复发脑炎患者存在多种自身抗原及抗体释放,如HSV感染继发的中枢神经系统自身免疫抗体(抗NMDAR抗体和抗GABAbR抗体等)[13],还有研究[14]报道HSV感染后导致脑组织受损释放自身抗原后产生了抗突触抗体(如:电压门控钙通道抗体)。在没有临床症状的患者中检测到这些自身抗体,提示自身免疫反应的激活,而血液中可能长期存在的长寿浆母细胞或与预后相关[15]。此外,日本乙型脑炎[16]、爱泼斯坦-巴尔病毒、巨细胞病毒和水痘带状疱疹病毒以及广为关注的新型冠状病毒[17]等多种病毒感染后,亦发现患者体内存在抗NMDAR等抗体。
第三,针对疱疹病毒感染的自身炎性反应。单纯疱疹病毒感染后导致T、B细胞激活,进而分泌大量炎性细胞因子,这些炎性因子或可透过血-脑脊液屏障引起中枢神经系统免疫反应,从而识别中枢神经系统自身抗原。一项利用患者脑脊液进行流式细胞分析的研究[18]显示,白细胞介素-2(interleukin-2,IL-2)、CXC趋化因子配体10(CXC chemokine ligand 10,CXCL10)、巨噬细胞炎性反应蛋白(recombinant human C-C motif chemokine 3,CCL3)、白细胞介素-10(interleukin-10,IL-10)、巨噬细胞衍生趋化因子22(recombinant human C-C motif chemokine 22,CCL22)和白细胞介素-6(interleukin-6,IL-6)等炎性细胞因子在抗NMDAR脑炎的发病中扮有重要角色[18]。在HSV感染后的小鼠模型中发现:抑制趋化因子受体3(chemokine CXC motif receptor 3, CXCR3)的信号转导减少了T细胞浸润和小胶质细胞活化,控制了炎性反应,这提示抑制CXCR3或可有效减少有害的宿主免疫反应从而减少自身抗体的产生[19]。
第四,遗传因素。原发性免疫功能障碍是重要的HSE易感因素之一[20],Toll样受体3(Toll-like receptor 3,TLR3)是神经元和星形胶质细胞对HSV-1的先天免疫反应所必需的双链RNA传感器[21-22]显示,TLR3或与TLR3途径相关的其他基因突变可能是HSE发病的危险因素。虽然HSE患者中仅5%的人存在TLR3缺陷,但HSE后存在基因缺陷的患者中66%最终被确诊为AE[23]。单纯疱疹病毒感染后抗NMDAR脑炎的小鼠模型表明,小鼠鼻内接种HSV-1能够诱导超过一半的动物产生NMDAR抗体,并降低海马NMDAR的水平[24-25]。这些发现突显了遗传因素在HSE以及继发AE中可能发挥重要作用,提供了潜在的治疗靶点。
第五,继发性免疫缺陷。2例HIV感染后AE的病例提示可能存在较为少见的脑脊液逃逸综合征导致单纯疱疹病毒在中枢不断复制引起炎性反应,在HIV感染的第四阶段,由于抗反转录病毒药物的应用使免疫功能部分恢复,产生B细胞的激活可能增加了自身抗体的产生率[26-27]。同时一项关于自身抗体的综合分析[28]显示, HIV感染患者血清中自身抗体的总体频率更高。为此,有研究[29]提出HIV感染可能造成了NMDAR的免疫反应失调,从而产生具有的AE。
3 HSE后继发自身免疫性脑炎的临床表现
HSE后发生AE的平均时间约为(48±18) d[13]。临床表现为“双相病程”,病毒感染时多有发热、头痛、腹泻等前驱症状,后出现轻微的意识和人格改变,部分可出现精神行为异常,经抗病毒治疗后患者症状逐渐减轻,但2个月内患者再次出现急性或亚急性脑病、精神行为改变、自主神经功能失调、癫痫发作和运动障碍等。部分患者因自身免疫性脑炎的症状出现较早而很难与原发病HSE鉴别[30]。青少年和成人的临床症状相似,但儿童与之不同,常发展为舞蹈样运动障碍[31],而合并运动障碍的患者若抗NMDAR抗体阴性则患者多具有与多巴胺-2受体的胞外区结合的自身抗体[32-33],随后可能出现行为改变(易怒、躁动和精神错乱)、癫痫发作、语言、睡眠和自主神经功能障碍,可能导致中枢通气不足,需要加强护理。
4 实验室检查结果
4.1 脑脊液检查
腰椎穿刺多数压力正常、少数升高,脑脊液白细胞数轻度升高或正常,细胞学呈淋巴细胞性炎性改变,但通常又比病毒感染的反应轻微,蛋白轻度升高,寡克隆区带可呈阳性[34]。自身免疫性脑炎相关抗体检测多提示相关抗体阳性。
4.2 影像学检查
HSE典型的MRI表现为不对称的颞叶内侧坏死,同时可累及扣带回和岛叶、丘脑及基底节。而在一些儿童患者中,可能会出现累及额叶、枕叶或顶叶等更广泛区域的异常。而在继发自身免疫性脑炎患者中,大约60%脑部MRI正常,其余患者表现为非特异性改变,包括大脑皮质或后颅窝的皮层下皮质变化、短暂的脑膜强化或炎性脱髓鞘改变[35]。与HSE时期的MRI相比,症状复发期间的MRI未见更明显的强化对比(图1),但与未发生AE的患者相比,AE患者的囊性坏死更为多见[8]。
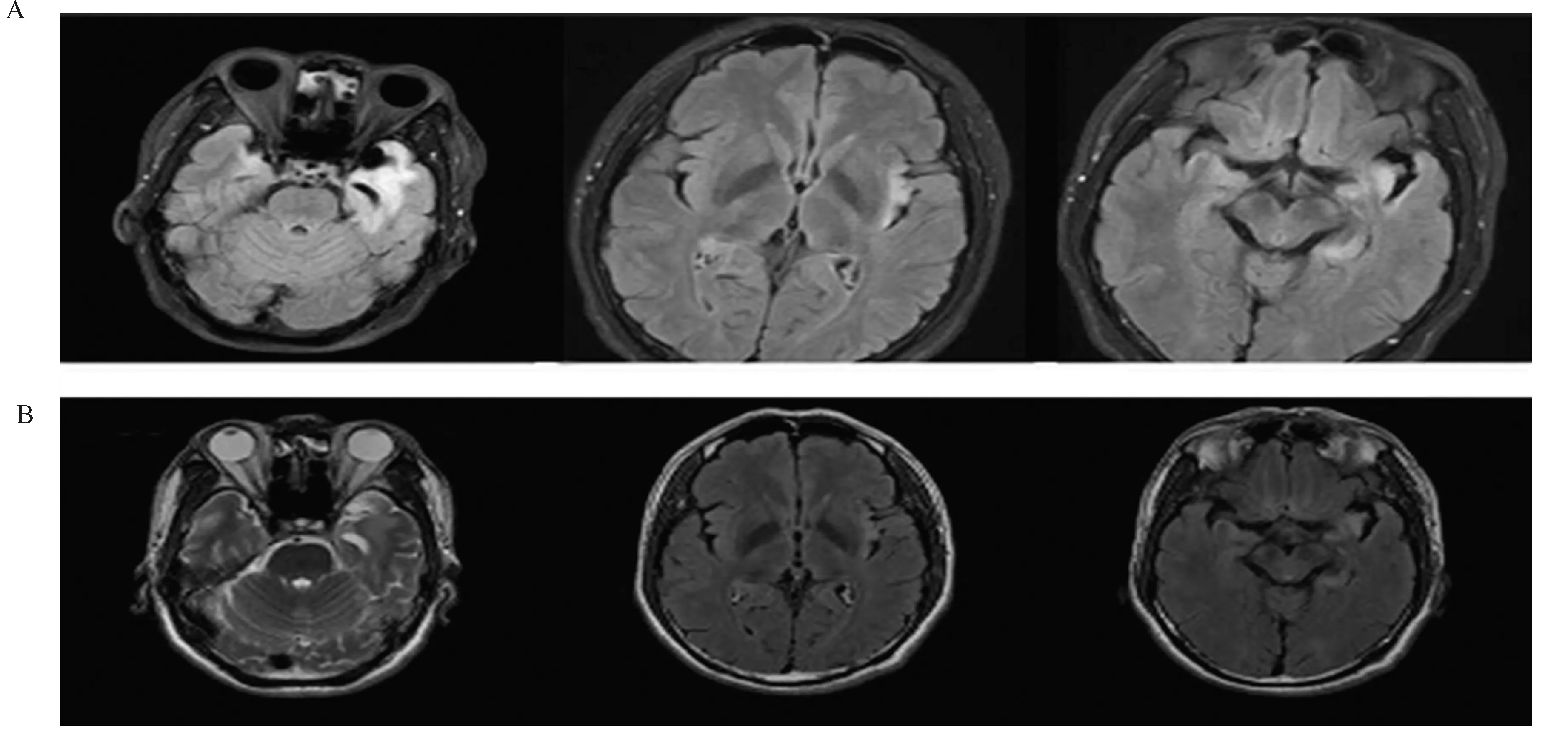
图1 HSE起病与复发MRI对比
4.3 其他检查
脑电图:呈弥漫性或者多灶性慢波,偶可见颞叶起源的癫痫放电。重症抗NMDAR脑炎可见特异性δ刷。
病原学检查:自身免疫性脑炎的诊断均需排除其他诊断,尤其感染性病因,脑脊液二代测序可有效提高诊断效率。
肿瘤学检测:自身免疫性脑炎往往会合并肿瘤,为排除肿瘤导致的AE,应进行肿瘤筛查。
5 HSE后继发自身免疫性脑炎的诊断和鉴别诊断
HSE患者出现症状的复发或行为-精神改变,伴或不伴有舞蹈或异常运动,都应考虑是否有病毒复发或免疫介导的发生(表1)。HSE后的NMDAR脑炎早期可单纯产生抗NMDAR而无任何临床症状且易被误诊为病毒性脑炎的复发,故存在诊断延迟,延迟时间为28~90 d。与大多数发热起病的感染性脑炎患者相比,AE更常出现头痛或流感样症状等前驱表现,病程中出现发热症状者仅占50%[36]。随后儿童通常表现为癫痫、行为改变、运动障碍或意识水平下降,而青少年和成年人更容易出现行为、精神、认知变化。对于HSE未完全恢复或复发的患者,建议立即进行脑脊液检查,并筛查自身免疫性脑炎和副肿瘤相关的抗体谱。对于自身抗体阳性患者可诊断为病毒性脑炎继发的自身免疫性脑炎,而自身抗体阴性者应进行HSV-PCR排除病毒性脑炎的复发,并结合实验室检查及影像学鉴别,如是否出现脑脊液细胞数增多(白细胞计数超过5个/mm3)或寡克隆蛋白(+),MRI有无发现新的中枢神经系统感染病灶或炎性脱髓鞘改变[37]。在合理排除其他疾病的情况下可诊断为HSV感染继发的自身免疫性脑炎。

表1 HSE复发与HSE后AE的临床特征比较
鉴别诊断通常包括其他病毒性脑炎、副肿瘤综合征、急性播散性脑脊髓膜炎、代谢性中毒性脑病、桥本脑病、克雅病(Creutzfeldt-Jacob disease,CJD)、原发性精神障碍或抗精神病药物恶性综合征等。
6 HSE后继发自身免疫性脑炎的治疗方法
HSE后脑炎的治疗方法包括免疫治疗、癫痫发作和精神症状的对症治疗以及支持治疗。对于病原学检测阳性的患者可能是由于自身免疫反应过程中嗜神经病毒重新激活,这时应同时合并抗病毒治疗。
6.1 免疫治疗
如果病原学检测是阴性的,应开始一些经验性免疫治疗,如类固醇、静脉注射免疫球蛋白、免疫吸附疗法或血浆置换等一线治疗。如果经过一线免疫治疗后病情仍未得到改善,则需根据症状反应和抗体结果考虑二线免疫治疗,如利妥昔单抗、环磷酰胺或二者合用。患者脑脊液中鞘内合成抗体效价如果持续较高,病情改善有限或缓慢,或经治疗后存在复发风险,可考虑使用硫唑嘌呤或麦考酚酸酯等进行长程免疫抑制治疗。值得注意的是,部分婴儿在免疫治疗后症状缓解不明显,如弥漫性皮质萎缩,并导致明显的发育延迟,这提示抗体可能在突触发育和可塑性方面发挥了不良作用,因此早期规范的免疫治疗是神经功能恢复的关键。
6.2 对症治疗
AE相关性癫痫对一般的抗癫痫药物不敏感,可考虑使用苯二氮卓类药物、丙戊酸钠、左乙拉西坦、拉莫三嗪、托吡酯等广谱抗癫痫药物进行治疗。并可通过静脉滴注地西泮或肌注咪达唑仑终止癫痫持续状态。精神症状则可酌情选用奥氮平、氯硝西泮、氟哌啶醇等药物。
6.3 抗病毒治疗
部分HSE后自身免疫性脑炎在机体免疫反应过程中存在嗜神经病毒的重新激活,这部分患者则需要合并抗病毒治疗。目前普遍应用于临床的药物包括阿昔洛韦、更昔洛韦、鳞甲酸钠等,但抗病毒治疗与免疫治疗之间是否存在药物相互作用关系还有待探究。
7 小结及展望
HSV感染后发生的自身免疫性脑炎发病率较高,其非特异性的临床表现给早期诊断和治疗带来挑战,本文综述了HSV感染后继发的自身免疫性脑炎的发展历史、可能的致病机制、临床表现、实验室检查及治疗。但由于免疫反应过程的复杂性,其发病机制仍未有定论,未来研究HSE继发的自身免疫性脑炎的发病机制及多中心的前瞻性临床队列研究将对及时正确诊断和有效治疗提供重要指导意义。
