超声引导射频消融治疗下肢静脉功能不全的疗效及预后影响因素分析
2021-06-13汪佳旭韩林霖杨秀华
汪佳旭 张 巍 韩 天 韩林霖 杨秀华
下肢静脉功能不全(chronic venous insufficiency,CVI)也称下肢静脉血液回流障碍,在成年人中的发病率约为26%[1]。瓣膜的损坏或失效是静脉功能不全的主要原因,可能导致局部静脉高压、静脉充血及扩张、组织水肿或灌注改变。最常见的症状是腿部肿胀、疼痛、夜间痉挛、疲劳及沉重感。治疗CVI的主要目的是改善症状,减少患肢水肿,治疗脂性硬化症,促进静脉溃疡的愈合。在血管内治疗出现之前,治疗CVI的主要途径是以静脉结扎或剥脱术为主的开放性手术,但由于手术过程中疼痛感明显,患者恢复时间较长、创伤较大,以及人们对美观的更高要求,腔内射频消融闭合术正在逐渐取代传统手术方式[2]。然而大部分患者在大隐静脉功能不全的情况下,常伴有穿支静脉功能不全及浅表静脉的扩张,仅针对大隐静脉主干的治疗很难一次性解决问题,对穿支静脉及网状静脉的治疗同样重要。本研究旨在探讨超声引导射频消融闭合大隐静脉主干、点式剥脱治疗交通支静脉和泡沫硬化处理小腿部浅表静脉联合手术的临床疗效,分析影响射频消融术后靶静脉再通的相关因素。
资料与方法
一、研究对象
选取2018年10月至2019年10月在我院均采用超声引导射频消融闭合大隐静脉主干、点式剥脱治疗交通支静脉和泡沫硬化处理小腿浅表静脉联合手术治疗的102例CVI患者,男38例(63条患肢),女64例(105条患肢),年龄29~86岁,平均(55.79±12.25)岁;共168条患肢,其中双下肢66例,左下肢23例,右下肢13例;高血压病者20例,高血糖者16例;大隐静脉直径2.2~16.0 mm,平均(7.10±2.57)mm;根据美国静脉联盟下肢静脉曲张(CEAP)系统分类[3],其中C2级患肢49条,C3级35条,C4级50条,C5级34条。纳入标准:①均行彩色多普勒超声检查提示大隐静脉功能不全;②均有静脉曲张临床症状,其中C2~C5级;③髂静脉、下腔静脉、下肢深静脉通畅,深静脉无反流。排除标准:①下肢深静脉血栓;②大隐静脉主干内急性血栓;③凝血功能障碍;④严重肝、肾功能异常;⑤妊娠、哺乳期;⑥全身情况不能耐受手术;⑦患有精神疾病等不能配合治疗;⑧对硬化剂过敏。本研究经我院医学伦理委员会批准,所有患者均签署知情同意书。
二、仪器与方法
1.超声检查:使用日立Hi Vision Ascendus彩色多普勒超声诊断仪,EUP-L52线阵探头,频率6~12 MHz。嘱患者取站立位或坐位,将下肢外展,从腹股沟处开始向下探查大隐静脉的分布、走行,观察是否存在双大隐静脉或副隐静脉,嘱患者做Valsaval动作,在股隐静脉瓣下方5 cm处,测量大隐静脉直径;CDFI探查静脉管腔内的血流信号、瓣膜的反流情况(图1)、交通支静脉的开放情况;脉冲多普勒配合腓肠肌挤压试验测量瓣膜反流时间,测量时取样线角度<60°。对于功能不全的交通支静脉(图2)及小腿部的曲张浅静脉(图3),超声引导下使用记号笔标记其走行。图3 二维超声显示小腿部多条曲张的浅表静脉

图1 CDFI及脉冲多普勒显示Valsalva动作时大隐静脉瓣口可见持续的反流信号

图2 二维超声显示小腿部增宽的交通支静脉
2.术中超声引导定位:使用日立Prosoundα7彩色多普勒超声诊断仪,UST-5412线阵探头,频率6~12 MHz。术中超声全程引导,患者取仰卧位,将腿部固定在高于心脏的位置,常规碘伏术区消毒,铺无菌巾,局麻满意后,患肢在超声引导下于膝关节旁用穿刺针刺入大隐静脉主干,用肝素化盐水冲洗导管和导管鞘,导入导丝和导管鞘,在超声监测下更换7 F导管鞘。导入Boston Science 0.018导丝和射频导管(COVIDIEN ClosureFast)至距大隐静脉汇合处2.5 cm,固定导管位置。在超声实时监测下沿大隐静脉主干周围,分段向隐筋膜间隙内注入麻醉肿胀液(肾上腺素0.2 mg、2%利多卡因20 ml、碳酸氢钠10 ml及0.9%生理盐水470 ml)[4],横切面观察到大隐静脉被麻醉肿胀液包绕呈“牛眼征”表现(图4)。随后超声确认治疗段大隐静脉与皮肤的距离≥1 cm[5]。在保证导管静止的同时,回撤导管鞘,与导管上的轴标记对准,在整个加热元件上施加均匀的压迫力,以使静脉壁与加热元件间接触良好,随后开始射频,逐段闭合大隐静脉主干,射频能量在120℃下输送,每7 cm静脉段以20 s周期处理,在治疗循环结束时,快速回撤导管进入下一个轴标记位置,进行下一次治疗。治疗结束后,停止外部压迫,快速撤出导管,对治疗的静脉段行CDFI检查,确认静脉闭合后取出导引鞘,射频结束。超声引导下于小腿曲张静脉团处予以泡沫硬化剂(聚桂醇)注射,行多点穿刺,在超声引导下注入泡沫硬化剂,当超声观察到静脉管腔的无回声内有烟雾状强回声散开时,表明硬化剂注射成功,药物注入后行局部压迫[6]。于小腿部功能不全的交通支静脉皮肤处局部麻醉,开小切口,取出或挑出静脉,无需缝合,按压止血。确认病变静脉治疗成功后,在伤口处覆盖纱布,使用弹力绷带对所治疗下肢进行加压包扎,手术结束。

图4 二维超声显示大隐静脉周围被无回声的麻醉肿胀液包绕,呈“牛眼征”表现
术后缠绕弹力绷带72 h或予压缩袜至少1周,嘱患者每天至少活动30 min,不要久坐或长时间站立,避免剧烈活动或体力劳动,建议患者遵医嘱服用非甾体抗感染药物止痛。
3.疗效评价:疗效判断以超声检查结果和下肢静脉曲张症状缓解为标准。术后6个月复查超声,观察大隐静脉闭塞、有无反流情况,以及是否仍存在浅静脉曲张及功能不全的交通支静脉,计算短期手术疗效;观察患者是否出现严重的并发症,包括静脉穿孔、血肿、感染、邻近神经损伤、皮肤灼伤、血栓、静脉炎、肺动脉栓塞等。射频消融治疗成功定义为接受治疗的大隐静脉段完全闭合,超声未探及管腔内有明确的血流信号;治疗失败定义为消融靶静脉存在任何长度的开放静脉段[7]。本研究将超声探查到未闭合的大隐静脉、功能不全的交通支静脉及浅表曲张静脉均归为手术失败。
4.观察指标:查阅文献,统计可能对射频消融治疗大隐静脉主干再通产生影响的因素,如血压、血糖、年龄、性别、CEAP分级、静脉术前直径等行统计学处理。
三、统计学处理
应用SPSS 20.0统计软件,计量资料以x±s表示,治疗前后CEAP分级比较行t检验,计数资料以频数或率表示。对年龄、性别、CEAP分级、静脉直径、血压、血糖等潜在影响因素行二分类Logistic回归分析;绘制受试者工作特征(ROC)曲线分析相关影响因素对超声引导射频消融术后大隐静脉再通截断值及对应ROC曲线下面积(AUC)。P<0.05为差异有统计学意义。
结 果
一、联合手术的治疗效果
102例患者共168条患肢术后6个月随访,所有患者症状均有所缓解,治疗前、后CEAP分级分别为(3.41±1.10)级、(1.33±1.13)级,患者治疗后的CEAP分级均显著低于治疗前,差异有统计学意义(P<0.05)。见图5。23条患肢仍需手术干预,其中12条患肢射频靶静脉段出现再通,2条患肢再发侧支静脉曲张,4条患肢再发小隐静脉曲张,5条患肢出现功能不全的交通支静脉。术后均未发现严重并发症,4条患肢超声显示皮下软组织水肿。联合手术治疗成功率为87%。
二、Logistic回归分析影响超声引导射频消融术后靶静脉再通的影响因素

图5 CVI患者射频消融术前及术后大隐静脉声像图
Logistic回归分析显示,血压、血糖、年龄、性别、CEAP分级均与射频消融再通无关联,大隐静脉术前直径与射频消融再通相关(P<0.05)。见表1。
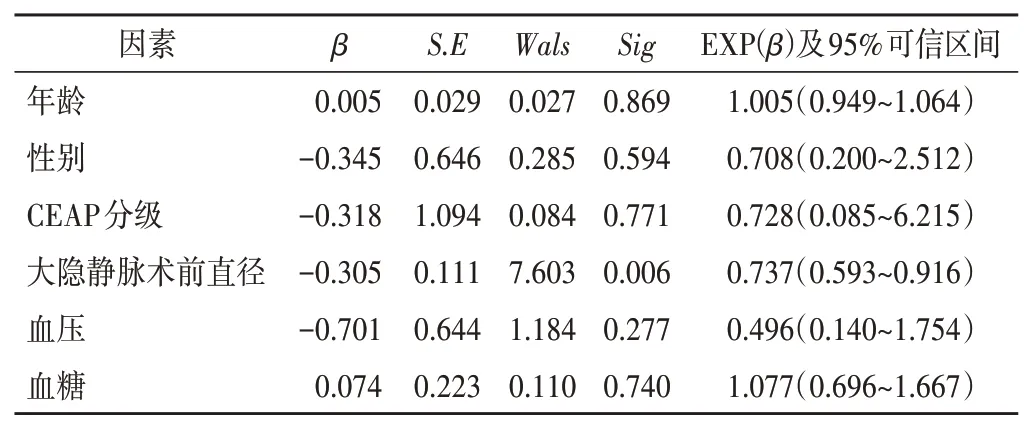
表1 超声引导射频消融术后靶静脉再通的影响因素分析
三、ROC曲线分析大隐静脉术前直径预测超声引导射频消融术后疗效的截断值及诊断效能
ROC曲线分析显示,大隐静脉术前直径截断值为8.5 mm,预测超声引导射频消融术后疗效的曲线下面积及95%可信区间为0.764(0.623~0.905),敏感性为75.0%,特异性为80.8%。见图6。
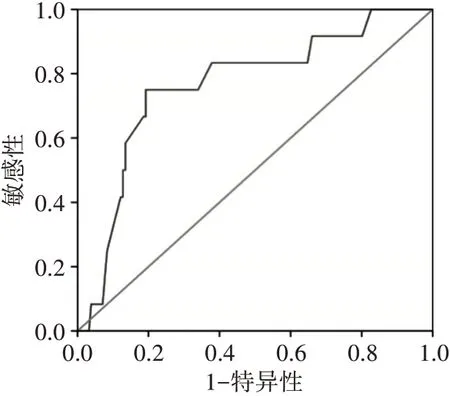
图6 大隐静脉术前直径预测超声引导射频消融术后疗效的ROC曲线图
讨 论
针对CVI最全面的治疗包括对大隐静脉或小隐静脉主干的治疗、浅表迂曲静脉团的治疗及功能不全的交通支静脉的治疗3个方面,超声引导射频消融术闭合大隐静脉主干是近年来新兴的治疗方式,美国血管外科学会和美国静脉论坛于2011年制定的关于治疗下肢静脉曲张患者的指南[3]中指出为治疗大隐静脉瓣功能不全,建议对走行于腹股沟处至膝盖处的大隐静脉段使用静脉腔内射频消融治疗代替高位结扎和静脉剥离术。对于已确诊的静脉曲张和主干反流患者首选腔内射频消融治疗,仅在不适合应用腔内射频消融的情况下予以超声引导下曲张静脉的泡沫硬化剂疗法;而对于毛细血管扩张及小静脉曲张,泡沫硬化剂则是一线治疗方法[8]。为达到良好的治疗效果,本研究采用射频消融闭合大隐静脉主干、点式剥脱治疗交通支静脉,以及泡沫硬化处理小腿浅表静脉的联合手术方法。本研究结果发现,超声引导射频消融大隐静脉主干联合交通支静脉点式剥脱、小腿浅表曲张静脉团的泡沫硬化的综合治疗成功率为87%,与Van der Velden等[9]研究发现传统手术治疗有效率85%相当,术后患者CEAP分级下降,手术疗效较好。超声检查在CVI患者治疗前、治疗中及治疗后均发挥重要价值,治疗前超声可定位标记曲张静脉及功能不全的交通支静脉,治疗中超声引导有助于安全放置射频导管及安全注射泡沫硬化剂,使手术过程可视化,治疗后超声可以及时确认消融是否成功[10-12]。分析本研究部分患者手术失败的原因:对于存在侧支循环的大隐静脉,虽然处理了曲张大隐静脉主干,股静脉血流仍有可能通过侧支的瓣膜口进入侧支静脉,如患者肥胖或仍保持不良的生活习惯(久坐、久立等),术后仍有可能出现侧支静脉曲张、小隐静脉曲张及交通支静脉功能不全;另外,早期小隐静脉反流常呈节段性[13],术前仅通过常规观察小隐静脉与腘静脉交汇处的瓣膜功能来诊断小隐静脉是否存在反流并不全面,这也是造成部分患者术前未发现小隐静脉曲张,而术后超声复查发现小隐静脉曲张的原因之一。
本研究分析了可能会对大隐静脉术后闭合率造成影响的潜在因素,如年龄、性别、大隐静脉术前直径,以及术前CEAP分级、血压、血糖等行Logistic回归分析,研究发现大隐静脉术前直径对射频消融术后管腔闭合率造成明显影响,与Nayman等[2]研究结果一致,ROC曲线分析进一步得出当大隐静脉术前直径≥8.5 mm时,管腔闭合效果不佳,分析原因为射频导管通过热消融的方式破坏与之接触的静脉管壁,进而闭合管腔,当静脉直径≥8.5 mm时,大隐静脉因周围软组织及超声探头外部压力受力不均而出现不对称收缩,进而导致射频导管的表面与管腔内壁接触不均,使射频消融不完全;而年龄、性别等因素主要是通过改变管腔内血流动力学增加静水压,导致瓣膜功能失效,从而造成静脉曲张,但在射频消融后大隐静脉管腔封闭,不存在血液流动,因此对术后闭合率无明显影响。本研究考虑到功能不全的交通支静脉对静脉曲张复发的影响,所以在治疗过程中有目的地处理了功能不全的交通支静脉,使研究结果更严谨。本研究不足之处是随访时间短,长期疗效仍需以后进一步研究。
综上所述,大隐静脉术前直径是超声引导射频消融大隐静脉主干再通的重要影响因素,当术前直径≥8.5 mm时,应警惕术后大隐静脉再通的可能。超声引导射频消融闭合大隐静脉主干、点式剥脱治疗交通支静脉及泡沫硬化处理小腿浅表静脉联合手术是治疗静脉曲张的一种安全、有效的方法。
