靶向抗肿瘤纳米粒的制备及其增强声动力/饥饿联合治疗效果评估
2021-06-13王志刚
张 若 张 亮 黄 菊 杨 扬 王志刚
声动力治疗(sonodynamic therapy,SDT)是通过超声激活声敏剂产生具有细胞毒性的活性氧,从而杀伤肿瘤细胞[1]。与传统的光动力治疗(photodynamic therapy,PDT)相比,SDT可以避免能量穿过组织时发生的大幅衰减,具有更好的组织穿透性[2]。然而,缺乏肿瘤靶向性的声敏剂限制了SDT的进一步应用[3]。IR780是常用的光敏剂,不仅具有良好的PDT效果,还是一种近红外染料,可用于光声成像,为肿瘤治疗提供直观的影像学信息[4]。研究[5]发现IR780在超声辐照下可产生大量的活性氧,诱发肿瘤细胞的凋亡;同时,IR780可主动靶向肿瘤细胞,促使纳米粒在肿瘤部位的聚集。因此,IR780作为声敏剂用于SDT得到了广泛的关注。但是,单独应用SDT对肿瘤细胞的杀伤作用并不理想,与其他治疗方法联合使用可以达到更理想的治疗效果[6]。葡萄糖氧化酶(GOx)是人体内固有的酶,可通过催化葡萄糖的降解、封锁细胞的能量来源、抑制肿瘤细胞的生长与增殖,从而实现肿瘤的饥饿治疗[7]。因此,本实验以GOx为核心,嵌有IR780的聚乳酸-羟基乙酸共聚物(PLGA)为外壳,拟制备一种核壳结构的多功能纳米粒(IG@P纳米粒),用以实现光声成像、主动靶向肿瘤细胞及SDT/饥饿联合治疗。
材料与方法
一、主要实验材料
鼠源性乳腺癌4T1细胞购于中国科学院细胞库;PLGA(山东岱罡生物科技有限公司);IR780、CCK8、GOx、钙黄绿素(CAM)、碘化吡啶(PI)、聚乙烯醇(PVA)、DiI染料(美国Sigma公司);DAPI染料、磷酸盐缓冲液(PBS)、3,3,5,5,-四甲基联苯胺(TMB)试剂盒(天津博士德生物科技有限公司);双肮、胰蛋白酶-EDTA(上海碧云天生物技术有限公司);DMEM、10%胎牛血清(美国Gibco公司);异丙醇溶液[重庆川东化工(集团)有限公司]。
二、主要实验仪器
超声波细胞破碎仪(VC105,美国Sonics公司);马尔文粒径仪(ZS 90,美国Malvern公司);紫外-可见光分光光度计(UV-23600,日本Shimadzu公司);多功能酶标仪(SpectraMax M3,美国Bio-Rad公司);扫描电镜(Hitachi S-3400N,日本日立公司);激光共聚焦显微镜(Hitachi 7600,日本Nikon公司);光学显微镜(DP 70,加拿大Olympus公司);光声成像仪(Vevo LAZR,加拿大Visual Sonics公司)。
三、主要实验方法
(一)纳米粒的制备
1.IG@P、I@P、G@P、PBS@P纳米粒的制备:称取50 mg PLGA及2 mg IR780溶于3 ml二氯甲烷中;称取10 mg GOx溶于200μl双蒸水中。待上述试剂完全溶解后,将200μl含10 mg GOx的双蒸水加入含PLGA及IR780的二氯甲烷溶液中,并采用超声波细胞破碎仪进行第1次乳化(90 W,3 min)得到初乳;在初乳中加入10 ml PVA溶液,进行第2次乳化(60 W,2 min)得到终乳。将10 ml异丙醇溶液加入终乳中,并进行4 h的磁力搅拌,之后,将上述溶液进行离心洗涤(8000 r/min,5 min),反复进行3次,从而获得IG@P纳米粒。采用同样的方法制备不含GOx的纳米粒(I@P,200μl双蒸水替代200μl含有10 mg GOx的双蒸水)、不含IR780的纳米粒(G@P,二氯甲烷溶液中不加IR780),以及仅含有PBS的纳米粒(PBS@P,200μl PBS替代200μl含有10 mg GOx的双蒸水且二氯甲烷溶液中不加IR780)。
2.DiI标记的纳米粒的制备:在二氯甲烷溶液中加入10μl DiI染料,其余方法同上。
(二)理化性质检测
1.采用光学显微镜及扫描电镜观察纳米粒的形态。
2.采用马尔文粒径仪检测IG@P纳米粒的粒径及电位。
3.采用紫外-可见光分光光度计分析IG@P纳米粒及PBS@P纳米粒的光学特性。
4.IG@P纳米粒催化活性:参照TMB试剂盒说明书,采用多功能酶标仪检测GOx在浓度2.5、5.0、10.0、20.0 mM葡萄糖溶液中的催化活性。
5.超声作用下检测IG@P纳米粒产生活性氧能力:将3 ml 50μg/ml IG@P纳米粒溶液与单线态氧荧光探针(50×10-6M)混合,并置于比色皿中,检测超声辐照0、15、30、45、60 s后溶液内活性氧产量。
(三)IG@P纳米粒光声成像
将制备好的IG@P纳米粒(400μg/ml,200μl)加入凝胶模块中,采用波长680~970 nm的激光辐照,采集光声图像并分析光声信号强度,确定最佳激发波长。将不同浓度(100、200、300、400μg/ml)IG@P纳米粒加入凝胶模块中,用最佳激发波长的激光辐照,采集并分析光声图像及光声信号值。
(四)IG@P纳米粒对4T1细胞靶向性检测
4T1细胞在DMEM完全培养基(10%胎牛血清,1%双抗)中培养。将对数生长期的细胞采用胰蛋白酶-EDTA从培养瓶中消化下来,移至共聚焦皿中培养24 h后加入DiI标记的IG@P和G@P纳米粒(60μg/ml,3 ml),分别孵育1、2、4 h后用多聚甲醛固定,并用DAPI染料进行细胞核染色。最后采用激光共聚焦显微镜观察细胞对纳米粒的吞噬情况。
(五)IG@P纳米粒的细胞毒性作用
1.CCK8法检测纳米粒的细胞毒性:将4T1细胞从培养瓶中消化下来,并移至96孔板中继续孵育24 h。5个孔为1组,共分5组:对照组、饥饿治疗组(G@P组)、靶向饥饿治疗组(IG@P组)、声动力治疗组(I@P+US组)、声动力/饥饿联合治疗组(IG@P+US组)。24 h后对照组加入200μl PBS,余组加入对应的纳米粒(60μg/ml,200μl),并继续孵育4 h。I@P+US组、IG@P+US组在孵育4 h后进行超声辐照(2 W/cm2,30 s)并继续孵育2 h。最后,每孔加入8μl CCK8染液,采用多功能酶标仪检测450 nm处每孔的吸光度(OD值),并计算细胞存活率,公式为:细胞存活率=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
2.CAM/PI双染法检测细胞毒性:为了更直观地观察纳米粒对肿瘤细胞活性的影响,将消化下来的4T1细胞转移至共聚焦培养皿中培养,同样分为5组:对照组、G@P组、IG@P组、I@P+US组、IG@P+US组(方法同上),其中I@P+US组、IG@P+US组在孵育4 h后行超声辐照(2 W/cm2,30 s)并继续孵育2 h。最后,每个培养皿中加入10μl CAM/PI混合染料。30 min后采用PBS冲洗共聚焦培养皿,去除游离的纳米粒及染料,加入DAPI染料继续孵育15 min,于激光共聚焦显微镜下观察细胞的存活情况。
四、统计学处理
应用SPSS 20.0统计软件,计量资料以x±s表示,组间比较采用t检验或双因素方差分析。P<0.05为差异有统计学意义。
结 果
一、IG@P纳米粒理化性质
1.IG@P纳米粒的基本性质:IG@P纳米粒呈大小均一的球形(图1A、B),平均粒径为(248.1±24.3)nm(图1C),平均电位为(-14.7±2.38)mV。紫外吸收光谱可见IG@P纳米粒在783 nm处有明显的吸收峰,而PBS@P纳米粒无明显吸收峰(图1D)。
2.IG@P纳米粒的催化活性:波长650 nm处可检测到GOx催化葡萄糖分解产生的过氧化氢与TMB反应生成蓝色物质;随着葡萄糖浓度的增加,IG@P纳米粒的催化速度增加。见图1E。
3.IG@P纳米粒的活性氧产量:在超声辐照下IG@P纳米粒可产生大量的活性氧,且随着辐照时间的延长,活性氧的产量逐渐增加。见图1F。
二、IG@P纳米粒体外光声成像
IG@P纳米粒在783 nm处有明显吸收峰,见图2A。在783 nm的激光辐照下,随着IG@P纳米粒浓度的增加(100、200、300、400μg/ml),光声信号强度呈线性增强。见图2B、C。
三、IG@P纳米粒对4T1细胞靶向性
DiI标记的IG@P及G@P纳米粒均呈红色荧光,细胞核呈蓝色荧光。激光共聚焦显微镜下观示,随着孵育时间的延长,DiI标记的IG@P纳米粒在细胞内的聚集逐渐增多(图3A);而DiI标记的G@P纳米粒在细胞内无明显聚集(图3B)。
四、IG@P纳米粒的细胞毒性作用
1.CCK8法检测纳米粒的细胞毒性:对照组、G@P组、IG@P组、I@P+US组肿瘤细胞存活率分别为100%、(65.78±8.3)%、(47.4±9.9)%、(41.9±10.9)%,IG@P+US组肿瘤细胞存活率最低,仅(17.5±9.2)%,与其他各组比较差异均有统计学意义(均P<0.05);IG@P组与G@P组、I@P+US组比较差异均有统计学意义(均P<0.05)。
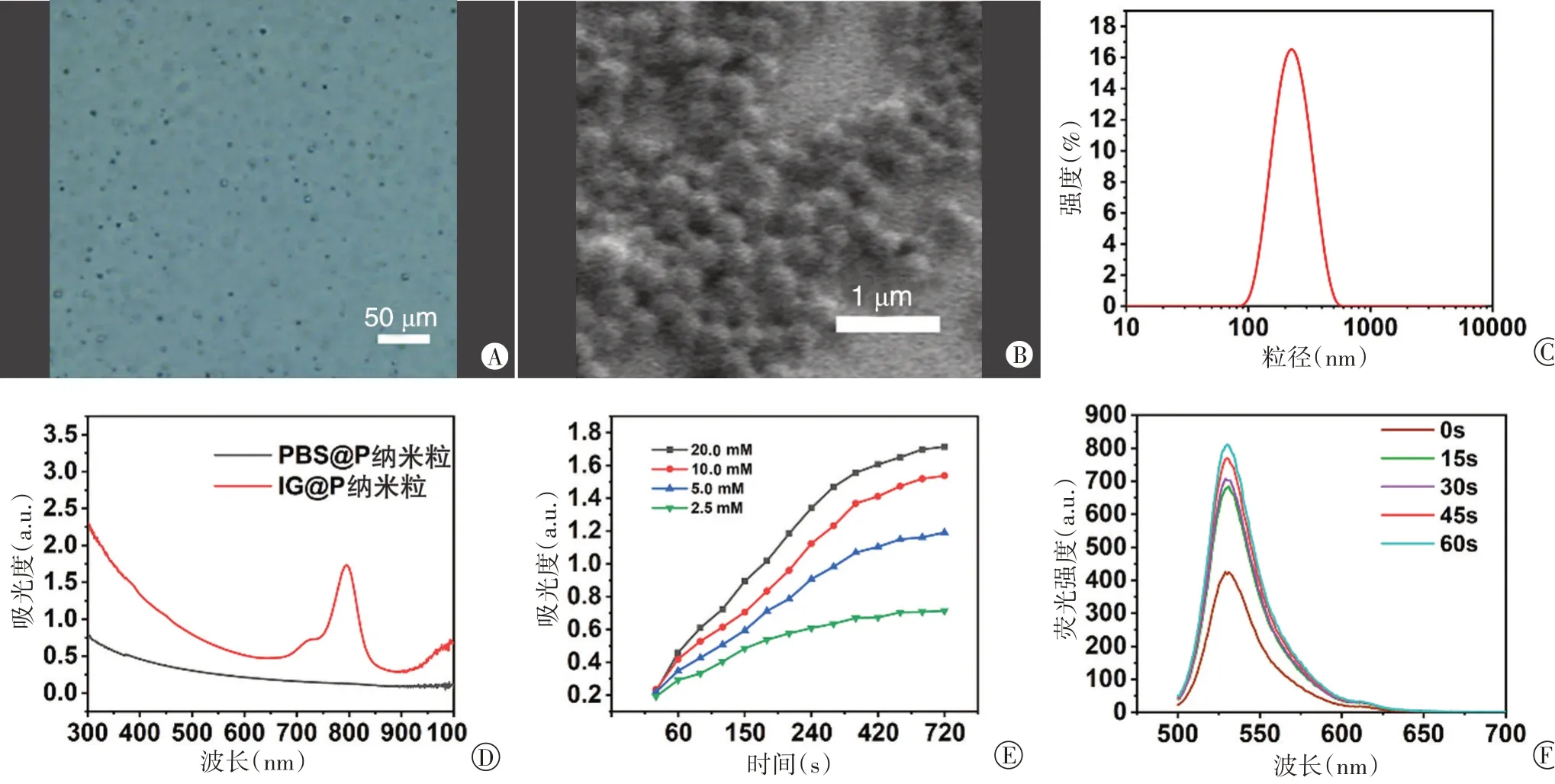
图1 IG@P纳米粒的理化性质

图2 IG@P纳米粒体外光声成像检测
2.CAM/PI双染法检测细胞毒性:纳米粒浓度为60μg/ml时,IG@P+US组细胞几乎全部死亡(大片红色荧光),而对照组细胞活性几乎不受影响(大片绿色荧光)。见图4。
讨 论
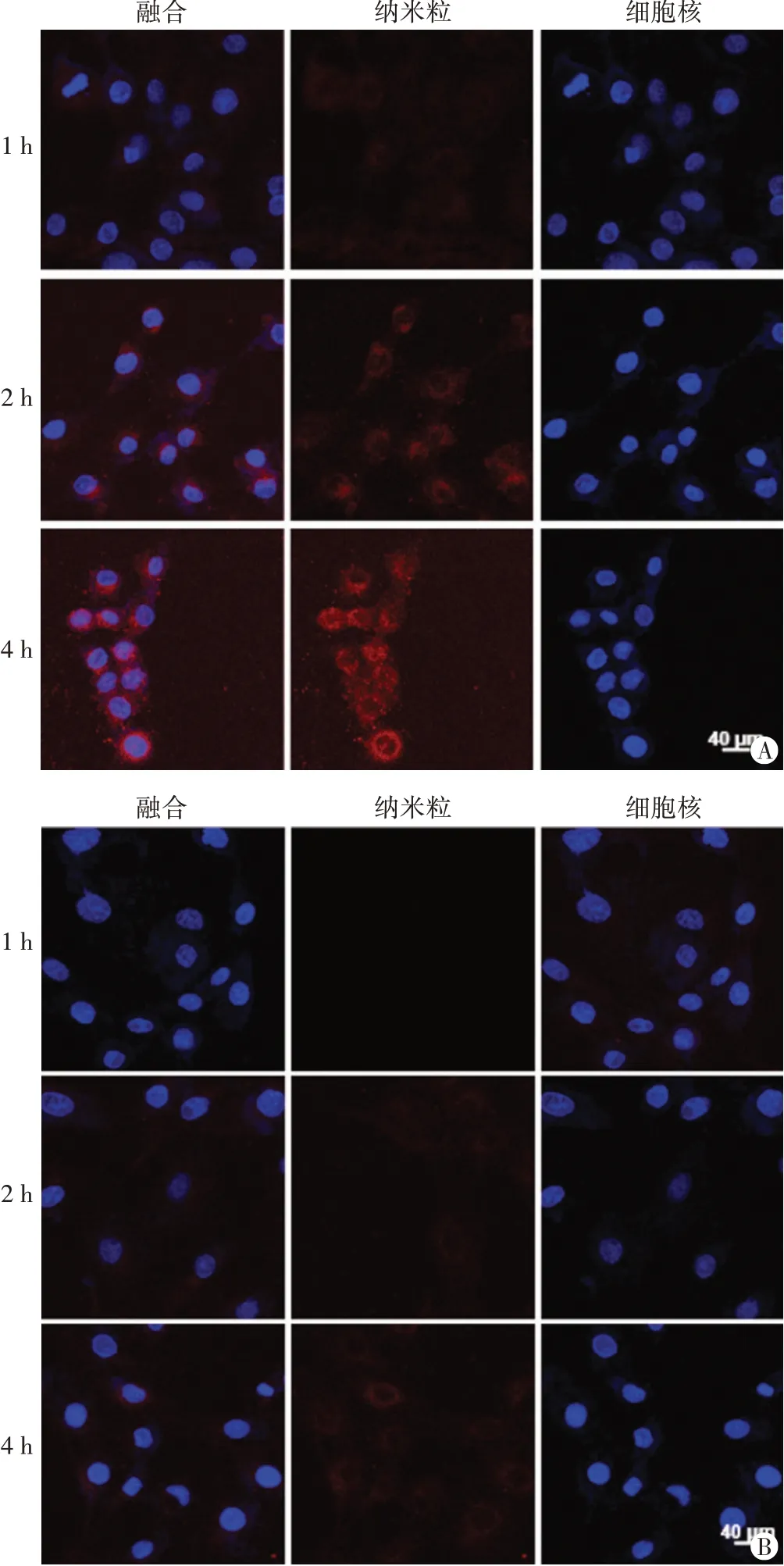
图3 孵育1、2、4 h后4T1细胞对DiI标记的IG@P纳米粒(A)及G@P纳米粒(B)吞噬情况的激光共聚焦显微镜下观(×200)
SDT是一种新兴的肿瘤治疗方式,由超声波激发声敏剂后引发声化学反应,产生具有细胞毒性的活性氧,从而引起肿瘤细胞的凋亡。声敏剂在无超声辐照时无细胞毒性,仅在超声辐照下才在辐照区域产生具有细胞毒性的活性氧,对周边正常组织损伤小,安全性高[3]。相较于传统的放化疗,SDT具有良好的时间及空间选择性、无创性等优势[1]。SDT主要包括两个步骤,先是将声敏剂递送至肿瘤部位,随后给予超声辐照激发声敏剂,产生声动力效果[8]。但声敏剂靶向性差,在肿瘤部位的富集效果差,限制了SDT的进一步应用。本实验发现,IR780作为声敏剂,可在超声辐照的激发下产生大量的活性氧,随着超声辐照时间的延长,活性氧的产量增多。过量的活性氧增加了细胞内的氧化应激压力,引起细胞的氧化损伤,从而杀伤肿瘤细胞。且IR780是脂溶性荧光小分子,可在不借助任何化学修饰的情况下靶向肿瘤细胞,增加肿瘤细胞对其的吞噬[4-5]。IR780靶向机制可能由于IR780为亲脂性阳离子,通过静电吸附作用与带负电的肿瘤细胞膜相互作用,从而增加了纳米粒在肿瘤内部的聚集[9]。本实验4T1细胞靶向实验表明,与未装载IR780的纳米粒(G@P纳米粒)比较,IG@P纳米粒可实现在肿瘤细胞内的富集,证实IR780赋予了纳米粒对肿瘤细胞的靶向性。IR780的主动靶向性通过增加载有声敏剂的纳米粒在细胞内的聚集,增加了超声辐照下活性氧的产量,从而有望增效声动力作用,进而增加对肿瘤细胞的杀伤作用。

图4 CAM/PI双染法检测各组4T1细胞毒性的激光共聚焦显微镜下观(×200)
研究[10]表明,联合治疗较单一治疗效果更显著。临床上常用的辅助治疗手段为化疗,但是化疗具有严重的副作用,限制其的进一步应用。大部分肿瘤细胞以葡萄糖为主要能量来源,用以维持其生长及增殖。GOx作为一种天然酶,可催化葡萄糖分解,具有良好的生物安全性,被用于肿瘤的饥饿治疗。但GOx是非特异性催化葡萄糖分解,易导致正常组织内葡萄糖含量下降而损伤健康组织。本实验通过细胞靶向实验表明IR780的主动靶向作用,可促进纳米粒在肿瘤细胞内特异性聚集,因此,GOx可以特异性地消耗肿瘤细胞内的葡萄糖,切断肿瘤细胞的能量供应,从而抑制肿瘤的生长增殖而不损伤周围正常细胞。本实验使用PLGA为载体包载IR780及GOx用于乳腺癌的联合治疗,结果发现包载于纳米粒内的IR780及GOx体外声动力及催化效果未受到影响;随后的细胞毒性实验表明,靶向组(IG@P组)细胞存活率明显低于非靶向组(G@P组),且声动力治疗与饥饿治疗联合应用(IG@P+US组)较单一治疗(G@P组、I@P+US组)低,差异均有统计学意义(均P<0.05),表明SDT与饥饿治疗联合应用具有更显著的肿瘤细胞杀伤作用,IR780介导的肿瘤细胞靶向作用可增效抗肿瘤治疗效果。
随着纳米医疗的不断发展,诊疗一体化的纳米探针受到越来越多的关注。光声成像是近年来新兴的诊断方法,可实时、无创、动态监测治疗过程。其成像原理是在激光的激发下,分子将吸收的光能转化成热能,随后引起组织的形态改变从而被超声波探测,形成光声图像。光声成像弥补了传统光学成像组织穿透性差及超声成像组织分辨率低的不足,将两者优势相结合,通过不同波长的光激发,实现对深部组织的高分辨成像[11]。本实验中,IG@P纳米粒在783 nm处光声信号最明显,且光声信号随着纳米粒的浓度呈线性增强,表明IR780作为近红外染料,具有良好的光声成像效果,可以用于监测抗肿瘤治疗效果。
综上所述,本实验成功制备了具有肿瘤靶向作用的IG@P多功能纳米粒,可用于光声成像,且可增效SDT/饥饿联合治疗,为肿瘤的治疗提供了新的思路。但本实验未能进一步在动物实验中验证,且IR780靶向肿瘤细胞的具体机制尚不完全明确,均有待后续实验的进一步完善。
