调料中的微生物对浅发酵香肠产品特性的影响
2021-06-11康峻吉莉莉王卫白婷黄倩
康峻,吉莉莉,王卫,白婷,黄倩
(成都大学肉类加工四川省重点实验室,成都 610106)
微生物在发酵食品中普遍存在,具有延长保质期、改善营养价值、去除抗营养因子、富含益生菌和提升食品感官品质等作用[1]。发酵肉制品中的微生物具有提高产品安全性、缩短成熟时间、提高营养价值等效果[2]。
传统中式腊肠属于非发酵型干香肠,原料肉绞制并与辅料混合,灌入肠衣后经自然风干即成,产品特性与西式发酵肠有较大差异,属于无外源微生物参与的发酵,产品风味主要取决于原料肉中内源蛋白酶的作用。但在四川有一种酱香型香肠,添加了以四川微生物酿造的豆瓣、醪糟、豆豉等辅料。富含有益微生物的调味品与当地特定的气候条件结合,使得香肠在传统制作的自然风干进程中也伴随一定的微生物发酵进程,但风干迅速降低了香肠的Aw值,对微生物的发酵有一定的抑制,使香肠处于“浅发酵”状态,也避免了香肠因深度发酵产生酸味。以此具有浅发酵特征的香肠传统配方及制作方法为基础,对发酵调味品进行筛选和优化,采用智能自控设备,开发出一种命名为“浅发酵香肠”的产品[3]。前期研究表明, 参与浅发酵香肠发酵的微生物, 与西式发酵肠类似,主要包括乳酸菌、微球菌和酵母菌等, 西式发酵肠正是通过这些发酵菌的协同作用, 实现产品风味和品质的提升。但是浅发酵香肠发酵时间短,能产生酸性物质的微生物含量有限,因此对pH的影响远没有西式发酵香肠大,而对其风味的提升作用更强[4]。前期研究显示,浅发酵香肠不同于其他中式腊肠和西式发酵肠的显著特点之一是调料中的微生物在生产加工进程中发挥的浅发酵作用,且发酵调味品种类和比例不同,对香肠的品质也会呈现差异[5]。为此将调料经灭菌处理作为对照,与未处理的试验组比较,测定香肠加工进程及产品各项特性指标,以探究调料中的微生物对浅发酵香肠产品特性的影响。
1 材料与方法
1.1 产品配方、工艺及试验设置
1.1.1 原辅料
猪前夹肉(瘦肉∶肥肉为7∶3):由遂宁市高金食品有限公司提供;浅发酵香肠专用调料:由肉类加工四川省重点实验室研制并提供。
1.1.2 制作工艺
将原料瘦肉和肥膘肉绞制混合,加入配料混匀后于4 ℃腌制24 h,灌入肠衣于7~13 ℃、相对湿度65%~75%、风速0.5~1.5 m/s条件下风干发酵成熟6 d,然后真空包装后于15~20 ℃发酵6 d,即可外包装后贮藏。
1.1.3 试验设置
试验组浅发酵香肠添加常规浅发酵香肠调料,将调料巴氏灭菌(90 ℃ 15 s)作为对照组,产品指标测定为第0,1,2,3,5,10,15天。
1.2 试验材料
MRS乳酸菌琼脂培养基、PCA平板计数琼脂培养基、虎红培养基、PDA马铃薯葡萄糖琼脂培养基、Chapman琼脂培养基:均购自杭州百思生物技术有限公司。“浅发酵香肠”辅料;成都大学四川肉类产业研究院提供。
1.3 仪器与设备
Testo 205pH计 德国仪表(深圳)有限公司;HD-3A型智能水分活度测量仪 无锡华科公司;TGL-20 M高速台式冷冻离心机 湖南湘仪实验室仪器开发有限公司;LRH系列生化培养箱 上海一恒科技公司;ZFD-A5140鼓风干燥箱 上海智城公司;BCD-452WDPF冷藏冰箱 青岛海尔集团;CR-400色彩色差计 日本柯尼卡美能达公司;仿天然风干发酵间 浙江嘉兴艾博公司。
1.4 检测指标及方法
1.4.1 微生物的测定
按照GB 4789.2—2010《食品微生物学检验 菌落总数测定》,乳酸菌与微球菌的检测参照张雪梅等的方法。在无菌条件下取25 g样品,加入225 mL无菌生理盐水中,置于拍打式均质器中均质10 min,取1 mL样液进行10倍稀释至适当的浓度,取100 μL稀释液,在PCA、甘露醇琼脂培养基、MRS培养基中涂布,在37 ℃恒温培养箱中培养48 h,分别对菌落总数、微球菌和乳酸菌进行计数,在PDA和虎红培养基中涂布,在28 ℃培养72~100 h,分别进行计数,每个样品3个重复,对符合要求的平板中生长的菌落进行计数,计算出样品中各种微生物的数量。
1.4.2 pH的测定
用酸度计的肉类专用穿刺电极直接插入肠体测定,待pH计度数稳定后记录。
1.4.3 水分活度Aw的测定
将样品在室温条件下切碎,取约2 g混匀的样品铺满样品盒的底部,使用水分活度仪测定。
1.4.4 TBA的测定
按照GB 5009.181—2016《食品中丙二醛的测定》。准确称取研磨均匀的样品10.00 g,置于150 mL具塞三角瓶内,加入50 mL 7.5%三氯乙酸混合液,振摇30 min,用双层滤纸过滤2次,除去油脂,准确移取上述滤液5 mL置于25 mL比色管中,加入5 mL 0.02 mmol/L TBA溶液,摇匀,加塞,置于90 ℃水浴锅中保温40 min,取出冷却1 h,加入5 mL三氯甲烷,摇匀,静置,将上清液移入小试管中在10000 r/min离心1 min,吸取上清液分别于532 nm、600 nm 处比色,同时以空白调零。
TBA=(D532 nm-D600 nm)÷155×0.1×72.6×100。
式中:D532 nm、D600 nm分别为上清液在532 nm、600 nm处的吸光值,其中与TBA反应的物质(TBARS)以每100 g 样品中TBA的质量表示。
1.4.5 色度值的测定
用切片机将香肠切成1 cm的薄片,用聚乙烯薄膜将背侧面压平,用CR-400色彩色差计进行色度值的客观仪器分析其L*、a*和b*。
1.4.6 挥发性风味物质的测定1.4.6.1 前处理条件
取3 g粉碎后的样品于15 mL顶空瓶中密封,设置CTC自动进样器对样品的前处理条件:加热箱温度75 ℃,加热时间45 min,样品抽取时间20 min,解吸时间5 min。
1.4.6.2 GC条件
HP-5MS UI色谱柱(30 m×0.25 mm,0.25 μm);压力32.0 kPa;流速1.0 mL/min;载气为He,不分流进样;进样口温度250 ℃;升温程序:起始温度40 ℃,保持1 min,以3 ℃/min升至85 ℃,保持3 min,再以3 ℃/min升至105 ℃,保持2 min,再以12 ℃/min升至165 ℃,再以10 ℃/min升至230 ℃。
1.4.6.3 MS条件
电子电离源(EI);电子能量70 eV;离子源温度230 ℃,四级杆温度150 ℃;检测器电压350 V;质量扫描范围(m/z):40~500。
1.5 数据分析
所有测试项目均进行3次重复,采用SPSS 25软件进行显著性分析及主成分分析;采用GraphPad Prism 5进行数据趋势分析。
2 结果与分析
2.1 微生物特性测定结果及分析
浅发酵香肠加工及冷藏期微生物变化见图1~图4。

图1 乳酸菌的变化

图2 酵母菌的变化
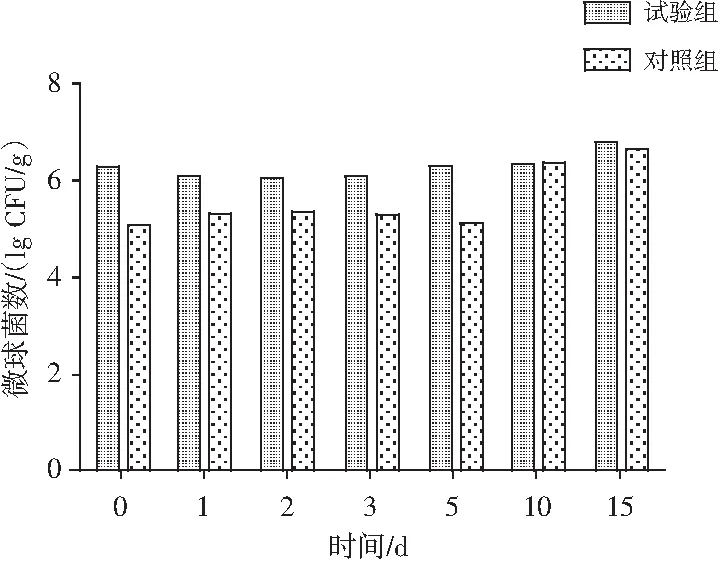
图3 微球菌的变化

图4 菌落总数的变化
随着加工成熟时间的延长,两组微生物数量逐步增加,两组菌落总数稳定上升,加工初期试验组为6.11 lg CFU/g,对照组为5.71 lg CFU/g。发酵至第15天时,试验组增至7.13 lg CFU/g,对照组为6.76 lg CFU/g。乳酸菌群稳定上升,加工初期试验组为6.08 lg CFU/g,对照组为4.18 lg CFU/g。至发酵风干第5天时对照组接近6 lg CFU/g,且包装成熟第10天及以后升至6.21 lg CFU/g左右,试验组在第15天时增长至7.14 lg CFU/g。试验组微球菌变化分为两个阶段:第一阶段为制作后到风干2 d,微球菌数量有所下降,由 6.34 lg CFU/g下降至6.07 lg CFU/g;第二阶段在为第3~15 d,微球菌持续增长,最终为6.87 lg CFU/g。对照组微球菌的变化分为3个阶段:第一阶段为制作后到风干第2天,微球菌数量增长至5.37 lg CFU/g;第二阶段在为第3~5天,微球菌降低至5.14 lg CFU/g;第三阶段为第5~15天,香肠在真空包装下冷藏,微球菌出现了增长,最终达到6.64 lg CFU/g。试验组酵母菌数初始为5.30 lg CFU/g,之后逐步增长至6.23 lg CFU/g,对照组酵母菌的数量从第0~15天稳定在4 lg CFU/g,没有明显变化。试验组香肠在检测中相同制作时间每种微生物数量均高于对照组,尤其是乳酸菌和酵母菌。最初,微球菌含量间的差异较大,至第15天时,两组差异已不显著,主要是由于鲜肉中本身含有一定的乳酸菌、微球菌等微生物[6],是对照组香肠中主要的微生物来源。试验组香肠的四川发酵调味品提供了丰富的有益微生物,使微生物的初始值高于对照组。
2.2 pH测定结果及分析
香肠在制作期及冷藏期pH的变化见图5。

图5 pH的变化
试验组pH的变化主要呈现下降趋势,并在第15天时下降至5.37。且在冷藏期pH变化更为明显,结合微生物检测结果来看,这是由于3~10 d中,乳酸菌大量增殖,产生乳酸使pH值显著下降[7]。对照组香肠在制作期0~3 d,pH值下降较缓慢,由5.76下降至5.74,在贮藏期3~10 d,同组之间出现了显著的下降(P<0.01),由5.74下降至5.67,10~15 d的pH下降缓慢,最终pH值为5.60。两组香肠在10~15 d pH下降缓慢,可能是由于氨基酸分解产生胺和肽,中和了香肠内的酸性物质,减缓了酸性物质的积累[8]。在低温条件下,发酵受到限制,因此pH值下降的幅度没有超过0.2~0.4个单位,这与Bover-Cid等[9]报道的相似。因此,浅发酵肠中的微生物能促进香肠pH的下降,但是不会低至发酵香肠(pH≤4.8)的水平[10]。
2.3 Aw值测定结果及分析
浅发酵香肠水分活度Aw的变化见图6。
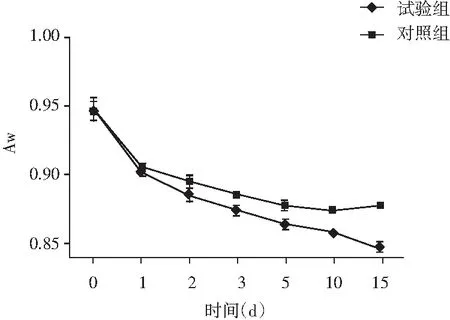
图6 Aw的变化
在风干发酵过程中,由于有规律变化的湿度和风速等模拟自然环境的加工条件,使香肠的Aw在最初的3 d快速下降,与第0天相比,第3天的Aw显著下降(P<0.01),试验组由0.947减少至0.873,对照组由0.935减少至0.886。在之后的制作期与第3天相比,第15天的Aw继续下降(P<0.05),试验组由0.873下降至0.847,对照组由0.886下降至0.877。微生物的增殖发酵使碳水化合物向有机酸转变,使得瘦肉部分肌肉蛋白变性,肌肉束的收缩以及肌原纤维内部和肌原蛋白质网络之间的水分流失[11]。试验组的Aw从第2天开始显著低于对照组(P<0.05),说明发酵香肠中的微生物增殖对香肠中水分消耗较多,同时也能使pH下降,促进酸诱导的肌肉蛋白质变性和凝胶化,并导致蛋白质的持水力降低,从而使得水分活度下降[12]。因此,浅发酵香肠中的微生物具有降低Aw值的作用,有利于延长保质期。
2.4 TBA测定结果及分析
香肠的TBA含量的变化见图7。

图7 TBA含量的变化
两组TBA的含量在增加,表明脂肪氧化的程度在增加,香肠中的内源性脂肪酶以及微球菌能够促进脂肪的氧化。3~5 d均有一个较明显的增加,5 d后趋于较平稳的变化,至第15天时,试验组为0.66 mg/kg,对照组为0.76 mg/kg。而试验组的TBA含量从第2天开始显著低于对照组(P<0.05),试验组中乳酸菌含量较高,可能是乳酸菌在一定程度上抑制了脂质氧化,虽然适当的脂肪氧化是肉制品风味成分的主要来源[13],但是过度的脂肪氧化会影响香肠的品质和风味。在冷藏期,对照组的TBA含量有所下降,试验组的TBA含量增长变缓,可能是由于乳酸菌、酵母菌增长,在一定程度上抑制了脂肪的氧化[14]。卢涵等[15]研究表明乳酸菌、酵母菌在发酵香肠中起到了降低脂肪氧化水平的效果。总的来说,试验组的TBA比同期对照组的低,这说明浅发酵香肠中的微生物具有一定的延缓脂肪氧化的作用。
2.5 色度值测定结果及分析
香肠在加工过程中色泽的变化见表1。

表1 色度值的变化

续 表
两组亮度L*值在整个过程中呈现下降的趋势,试验组由63.44下降至51.59,对照组由63.26下降至51.67,两组L*值没有显著性差异。对照组红度a*值由18.26下降至14.57,试验组由18.76下降至16.06。试验组a*值相比于对照组下降得更为缓慢(P<0.05)。黄度b*值在风干期间比较稳定,随后在冷藏期有所下降,两组之间没有显著性差异。发酵肉的颜色形成和稳定性涉及微生物、酶和化学反应,这些反应受pH、色素浓度、氧化还原电位、温度和水分的影响[16]。微球菌中的葡萄球菌带有的过氧化酶对色泽的变化有着一定的影响[17],试验组a*值明显高于对照组,说明香肠中微生物能够延缓色泽衰退。
2.6 挥发性风味物质测定结果及分析
通过固相微萃取-气相色谱-质谱联用仪(SPME-GC-MS)测定浅发酵香肠中挥发性风味成分,见表2。

表2 浅发酵香肠加工过程中挥发性风味物质的变化
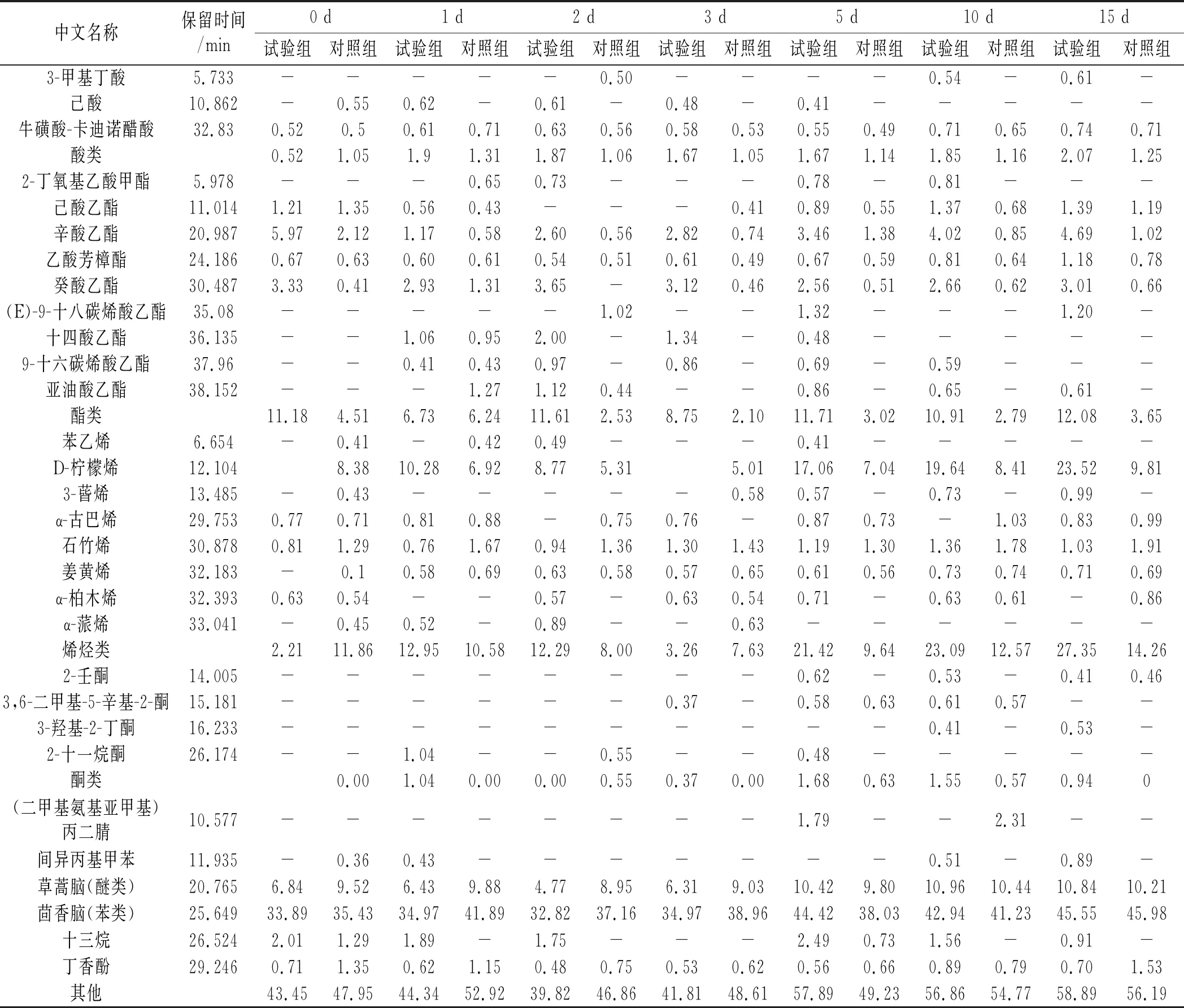
续 表
香肠加工初期试验组与对照组检测到3种类型的醛类,脂质氧化的醛类挥发性化合物被认为是干发酵香肠和干火腿特征性味道和气味的重要贡献者[18],与试验组相比,对照组中与脂质自氧化相关的己醛、壬醛百分比较高,己醛衍生自亚油酸氧化,庚醛是n-6和n-9多不饱和脂肪酸的氧化产物[19]。苯乙醛的百分比增加源自微生物氨基酸代谢,苯乙醛被发现是对干香肠风味有积极贡献的化合物之一[20]。两组香肠中检测到的4种醇,芳樟醇、桉叶油醇、(-)-4-萜品醇、α-松油醇,均来自香肠制备过程中添加的香料。试验组的芳樟醇在成熟期间含量低于对照组,是由于芳樟醇与酸的酯化。检测到另外3种类型的醇,2,3-丁二醇和苯乙醇主要由微生物通过氨基酸分解代谢产生[21],2,3-丁二醇是乳酸菌代谢的副产物[22],试验组的2,3-丁二醇在成熟后期含量高于对照组(P<0.05)。还检测到1-辛烯-3-醇,它具有明显的蘑菇味,并且具有较低的感官阈值[23],1-辛烯-3-醇的浓度与青霉菌的生长有关[24]。另外,在发酵开始时检测到了己酸,在整个过程总共鉴定出4种类型的酸,检测到源自脂质自氧化化合物的戊酸[25]。3-甲基戊酸的百分比在发酵过程中先增加再减少,可能与氨基酸的分解氧化有关,牛磺酸-卡迪诺醋酸是一种不常见的酸,可能来自调味品。一般情况下,酸是形成酯的底物。酯是重要的挥发性化合物,其检测阈值低,对于香肠独特风味的形成有着重要的作用[26],酯主要是短链酸与醇由微生物的酯酶进行酯化作用[27]。乙酯非常重要,它使香肠具有成熟的果香[28]。 检测到乙酯,例如己酸乙酯、辛酸乙酯、乙酸芳樟酯可以通过葡萄球菌和乳酸菌的酯化活性来解释,并且明显试验组的乙酯含量高于对照组(P<0.05)。潜在的酯化作用还取决于pH值、温度和生产香肠所使用的原料[29]。乙酯类化合物,主要是短链酸生成的酯类,可赋予产品香甜风味,并且能够掩盖游离脂肪酸带来的不愉快气味[30],如己酸乙酯富有果香味,辛酸乙酯则具有酒香气息。乙酸芳樟酯具有柠檬、薰衣草幽香气味。在加工期间,在试验组和对照组中鉴定出4种酮,这些化合物的百分比在发酵过程中降低,其中2-壬酮源自微生物的β-氧化作用,这可能归因于葡萄球菌的存在[31]。接种的香肠中这些甲基酮的百分比高于对照组(P<0.05)。此外,由LAB碳水化合物分解代谢产生的3-羟基-2-丁酮也有助于产生水果味,并且在试验组中百分比高于对照组(P<0.05)。
两组香肠中检测到烯烃类化合物数量达8种,相对含量均较高,例如D-柠檬烯、姜黄烯、石竹烯属萜类物质,但此类物质对产品风味的影响较小,更多的是对香肠风味起协调作用,其他挥发性化合物如茴香脑、草蒿脑等主要源于所添加的发酵调味品。
根据挥发性化合物的结果,浅发酵香肠风味物质主要来源于添加的发酵调味品。两组浅发酵香肠中酯类化合物在冷藏期间缓慢增长,试验组的醛类化合物相较于对照组的含量较低,结合乳酸菌和微球菌的生长情况,表明微生物进行着一定的发酵作用,并且乳酸菌的增长带来了一定的抑制脂质氧化的作用。综上,说明香肠微生物能够促进风味物质的形成。
3 结论
以富含有益微生物的四川发酵调味品为辅料,在智能仿天然风干发酵间中制作具有四川传统酱香风味的浅发酵香肠。将调料经灭菌处理作为对照,与未处理的试验组比较,研究了调料中的微生物对香肠产品特性的影响。结果表明,与试验组比较,加工各阶段及产品中对照组的菌落总数、乳酸菌、酵母菌、微球菌同期均显著更高(P<0.05)。试验组和对照组的菌落总数及乳酸菌皆增长稳定,试验组微球菌增长分为两个阶段:风干发酵期由6.34 lg CFU/g下降至6.07 lg CFU/g,之后稳定增长至6.87 lg CFU/g;对照组微球菌增长分为3个阶段:由风干发酵期2 d时从5.12 lg CFU/g增长至5.37lg CFU/g,加工至5 d时从5.37 lg CFU/g降低至5.14 lg CFU/g,之后稳定增长至6.64 lg CFU/g。试验组酵母菌随着加工时间的变化而稳定增长,而对照组在整个加工过程中无明显增长变化。至第15天时,试验组产品菌落总数达到7.13 lg CFU/g,乳酸菌7.14 lg CFU/g,酵母菌6.23lg CFU/g,微球菌6.87 lg CFU/g,且与对照组比较呈现更低的pH、TBA及Aw,更为缓慢的色泽衰变。此时对照组pH为5.37,试验组为5.60;TBA值对照组为0.76 mg/kg,试验组为0.66 mg/kg;Aw值对照组为0.877,试验组为0.847。产品色度值的测定结果:试验组的L*、a*和b*值分别为51.59,16.06和28.77,而对照组的L*、a*和b*值分别为51.67,14.57和26.74。挥发性风味物质检测结果表明,试验组的酯类、酮类、醇类相对含量显著高于对照组(P<0.05),试验组分别为12.08%、0.94%和6.98%,而对照组分别为3.65%、0%和5.82%。而醛类试验组显著低于对照组(P<0.05),试验组为10.16%,对照组为13.98%。对产品的各项特性指标进行综合评定,浅发酵香肠中由发酵调味品组成的调料引入的微生物具有降低香肠的酸度,赋予产品良好色泽,延缓香肠氧化酸败,促进风味物质形成的作用,而有关调料中微生物对浅发酵香肠特性影响的机制有待进一步探究。
