去泛素化酶USP12抑制肺腺癌增殖和促凋亡
2021-06-11金美芳李晓未王浥霏
张 闽,许 亮,金美芳,李晓未,王浥霏
(1.苏州大学附属儿童医院病理科,江苏 苏州 215003;2.苏州市立医院东区检验科,江苏 苏州 215001)
世界范围内,肺癌致死率占恶性癌症致死率首位,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)作为其主要病理类型呈显著增长趋势[1-2]。尽管目前的靶向治疗能显著改善肺癌病人生存率和生活质量,仍有许多病人因缺乏治疗靶点而受死亡威胁[3-6]。众多研究[7]表明肺腺癌的发生发展与去泛素化酶(eubiquitylating enzyme, DUB)家族的功能密不可分。人类泛素特异性蛋白酶(ubiquitinspecific protease, USP)亚家族是去泛素化酶家族中研究最广泛,且拥有最多成员的家族[8]。该家族蛋白结构具有多样性,且属于半胱氨酸蛋白酶类,能够通过水解作用移除靶蛋白上的泛素链,使蛋白不易被泛素化降解,从而促进目标蛋白结构稳定性和功能[9]。众多研究[10-11]显示USP家族成员能够参与癌细胞DNA修复、细胞周期进展和基因转录调控等众多过程。且越来越多的研究将特异性激活的USP家族成员作为靶点进行药物开发,这使得对USP家族成员功能和作用机制的研究显得尤为重要。作为USP家族成员之一,USP12被报道与前列腺癌的发生相关,但其在肺腺癌中的作用尚不清晰,本文旨在对USP12在肺腺癌中的表达以及功能进行研究,为肺癌临床治疗提供更多依据。
1 材料与方法
1.1 公共数据库分析 GEPIA网站(http://gepia2.cancer-pku.cn/#help)是一个在线数据库,涵盖了TCGA数据库的癌症病人信息,以及GTEx数据库中正常人体中基因表达信息。本研究通过对比该网站中483 例肺癌病人数据和347 例正常及癌旁组织数据,分析USP12在肺癌与正常组织中的表达差异。
1.2 实验材料
1.2.1 细胞系:非小细胞肺癌细胞系A549与H1299均购于中科院上海细胞库。两种细胞系均使用含10%胎牛血清和青链霉素混合液的RPMI 1640培养基培养,并置于CO2浓度为5%、湿度饱和的37 ℃恒温培养箱中,待细胞长至80%密度传代,并选择处于对数生长期的细胞进行实验。
1.2.2 抗体与试剂:细胞RPMI 1640培养基、胎牛血清、青链霉素混合液、胰酶、RIPA蛋白裂解液和3-(4,5-二甲基-2-噻唑基)-2,5-二苯基四唑溴化物(MTT)试剂均购自美国Sigma-Aldrich公司;USP12,Caspase 3,cleaved-Caspase 3和GAPDH抗体购自美国Cell Signaling Technology公司;BCA蛋白定量试剂盒、ECL发光试剂盒、凋亡检测试剂盒均购于美国Thermo Fisher公司。
1.3 实验方法
1.3.1 s h U S P 1 2载体与p C D H-U S P 1 2构建与细胞转染:根据U S P 1 2基因序列设计s h U S P 1 2干扰序列如下:s h U S P 1 2-1,5'-CCCUAAGAAGUUCAUCACAAGAUUA-3';shUSP12-2,5'-UCGAGGCCAUUAUAUUGCAA UAGUU-3';将干扰序列与pLKO载体连接得到pLKO-shUSP12核心载体,之后与pVSVG、pREV、pGAG包装体系共同转染至HEK293T细胞系中,24 h后离心收集含有病毒颗粒的上清并用0.45 μmol/L滤器过滤,使用稀释法测定病毒滴度,得到感染细胞的合适浓度。将A549与H1299细胞以每孔3×104的密度接种于24孔板,加入含有病毒与聚凝胺(polybrene)的培养基,48 h后更换含有嘌呤霉素的培养基,持续培养1 周,筛选出稳定转染shUSP12的细胞系,通过实时定量PCR实验确定是否成功敲除USP12。
1.3.2 pCDH-USP12过表达载体构建:通过NCBI网站下载USP12 CDS区全长序列,基因组模板经PCR扩增后将所得序列连接于pCDH-CMV-MCSEF1-Puro载体而获得pCDH-USP12过表达载体。将pCDH-USP12与包装载体pMD2、pAX2共转染于HEK293T细胞系中,24 h后收集病毒上清,测定病毒滴度,并用于感染肺癌细胞。转染后48 h更换含有嘌呤霉素的培养基,持续培养1 周,筛选出稳定转染pCDH-USP12的细胞系,通过实时定量PCR实验确定是否成功敲除USP12。
1.3.3 蛋白质免疫印迹实验:(1)样品制备:肺腺癌A549与H1299细胞经转染处理后,使用RIPA试剂进行裂解并提取蛋白,样品经BCA试剂盒进行蛋白定量,并加入适量5×上样缓冲液,于100 ℃加热5 min使蛋白变性;(2)电泳:配置分离胶浓度为10%的SDS-PAGE凝胶,各实验组取等量的蛋白样品30 μg加样于泳道,并设置蛋白marker组,恒流30 mA进行电泳50 min;(3)转膜与封闭:电泳结束后将蛋白胶置于醋酸纤维膜上,采用200 mA恒流60 min进行蛋白转印,转印后的NC膜置于5%脱脂牛奶中,摇床上室温封闭2 h;(4)抗体孵育:蛋白一抗按说明书比例稀释,将膜置于抗体中,4 ℃过夜孵育,第二天将膜取出,PBST溶液清洗3 次,每次5 min,将膜置于二抗中,室温下摇床上孵育45 min,PBST洗膜;(5)显色:使用ECL发光液对膜进行孵育显色,对目的条带进行拍照。
1.3.4 MTT实验:将转染shUSP12或pCDH-USP12的A549、H1299细胞及对照细胞消化计数,按每孔3 000 个细胞接种于96孔板中,每组设定5 个复孔,每孔中培养基体积为100 μL,每隔24 h更换新鲜培养基。在相应的时间节点(24、48、72、96 h)向每孔加入各20 μL浓度为5 mg/μL的MTT溶液,继续置于培养箱中孵育。4 h后取出96孔板,将培养基吸除干净并在每孔中加入150 μL的DMSO,使用酶标仪测定各组细胞在450 nm处的吸光度值并进行统计分析。
1.3.5 克隆形成实验:将转染shUSP12或pCDHUSP12的A549、H1299细胞及对照细胞消化计数,按每孔1 000 个细胞接种于6孔板中,每孔中加入2 mL完全培养基体积,每隔24 h更换新鲜培养基,10 d后待细胞增殖为肉眼可见的单克隆时取出孔板,PBS清洗3 次,加入溶解于4%多聚甲醛的结晶紫溶液,染色10 min后弃掉溶液,并使用PBS缓慢清洗克隆,对克隆进行拍照并计数。
1.3.6 细胞凋亡实验:A549与H1299细胞用胰酶消化并转移至不同EP管中,PBS清洗两次并将溶液弃去,避光进行如下操作,每管中加入配置好的AnnexinⅤ染色液将细胞重悬,置于冰上孵育30 min,之后每管加入1 μL PI染色液,置于37 ℃孵育5 min,使用Calibur流式细胞仪检测细胞凋亡情况,每组实验重复3 次,进行统计分析与作图。
1.3.7 免疫组织化学染色(IHC):从上海芯超公司购买了含有75 例肺腺癌与癌旁组织的芯片,通过免疫组化实验对其中USP12蛋白水平进行检测与统计分析,主要步骤如下:(1)抗体结合:组织芯片置于二甲苯和浓度梯度的乙醇中进行脱蜡;2% H2O2孵育10 min去除内源性过氧化物酶作用;0.1% Triton X-100覆盖组织透化10 min;芯片置于抗原修复液中95 ℃加热15 min,室温下冷却;5% BSA对组织进行封闭20 min,PBS清洗5 min;组织覆盖一抗,放置于4 ℃过夜进行孵育;室温下二抗孵育30 min;(2)染色:稀释好的DAB染液覆盖于组织上进行染色,PBS清洗后使用苏木素对细胞核进行染色,清水缓慢冲洗;(3)脱水封片:组织置于浓度梯度的乙醇和二甲苯中进行逐步脱水,中性树胶封片;(4)显微镜下观察染色情况并拍照。
1.4 统计学分析 使用SPSS 21.0和GraphPad Prism 7.0软件对数据进行统计学分析与作图,呈正态分布的数据以(±s)表示,两独立样本比较数据使用Student'st检验或单因素方差分析,P<0.05即视为差异有统计学意义。
2 结果
2.1 去泛素化酶USP12在肺癌中的表达分析 我们首先通过GEPIA网站对TCGA数据库中肺癌病人及GTEx数据库正常人体组织中USP12基因表达情况进行分析,发现去泛素化酶USP12在肺癌病人组织中的水平显著低于正常组织中(图1A)。此外,我们通过免疫组化实验对USP12在75 例肺腺癌与癌旁组织中的表达情况进行分析,结果与数据库分析一致,USP12在肺癌病人组织中表达低于对应癌旁组织(图1B),图1C为2 例代表性染色结果,表明USP12可能在肺癌中发挥抑癌作用。

图1 USP12在肺癌病人中表达情况与免疫组化染色
2.2 敲低去泛素化酶USP12促进肺癌细胞增殖 为进一步确定USP12在肺癌中的促癌作用,我们对USP12是否影响肺癌细胞增殖进行了研究,使用转染shUSP12敲低肺癌细胞A549及H1299细胞系中USP12水平,并通过实时定量PCR实验对转染效率进行评价,确定了shUSP12的有效性(图2A)。我们通过MTT实验和克隆形成实验对肺癌细胞的增殖存活能力进行检测,结果显示,与转染对照质粒的对照组相比,USP12敲低后的A549与H1299细胞的增殖能力明显增强,培养96 h后细胞存活率呈显著差异(图2B、2C)。

图2 敲低USP12能够促进肺癌A549与H1299细胞增殖
2.3 过表达去泛素化酶USP12抑制肺癌细胞增殖 我们接下来通过转染pCDH-USP12对肺癌细胞中USP12进行过表达,并通过实时定量PCR实验对转染效率进行评价,确定了pCDH-USP12的有效性(图3A)。MTT实验和克隆形成实验结果显示培养96 h后细胞存活率呈显著差异,克隆形成率明显降低,表明过表达USP12能够抑制肺癌A549与H1299细胞的增殖能力与存活能力(图3B、3C)。

图3 过表达USP12能抑制肺癌细胞增殖
2.4 过表达去泛素化酶USP12能够促进肺癌细胞凋亡
我们通过Annexin Ⅴ/PI双染色对肺癌细胞凋亡情况进行检测,结果显示USP12水平升高后,肺癌A549与H1299细胞的凋亡水平显著升高(图4A、4B)。蛋白质免疫印迹实验结果显示,过表达USP12后,细胞凋亡关键蛋白Caspase 3酶活性显著增强,伴随片段化Caspase 3蛋白水平升高(图4C)。
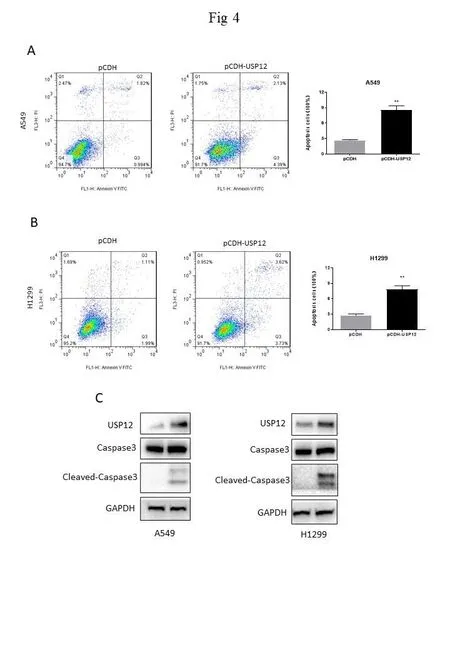
图4 过表达USP12能促进肺癌细胞凋亡
3 讨论
众多临床研究证明癌蛋白水平升高与抑癌蛋白水平下降是癌症发生的一大特征,泛素化(ubiquitination)与去泛素化(deubiquitination)过程作为调控蛋白降解的重要途径在癌症研究领域备受关注[12]。蛋白质在泛素化酶的作用下与泛素链相连,进而被蛋白酶体识别并发生水解。而去泛素化酶则通过去除蛋白质上的泛素链稳定蛋白质结构与功能,参与信号传导、DNA修复、细胞周期与凋亡等重要细胞生理过程[1,13]。USP家族是去泛素化酶家族中最大的亚家族,该家族成员结构高度保守,在不同癌症中发挥促癌或抑癌功能,其中大多数成员在癌症中发挥着促进作用,如USP2在乳腺癌、宫颈癌、胶质瘤和前列腺癌组织中表达水平明显高于对应的正常癌旁组织[14-17]。少数USP例如CYLD具有肿瘤抑制因子的特征,抑制肝癌、皮肤癌和结肠癌的发生或转移[18-20]。另有几种USP在不同癌症背景下发挥促癌或抑癌功能,例如USP9X在结肠癌发挥肿瘤抑制作用,而在肺癌和多种血液癌症中呈现高表达水平[21-23]。
USP12起初被定义为组蛋白H2B和H2A去泛素化酶[24-25]。对其酵母同源物结构研究显示,USP12参与肌动蛋白动力学、细胞极性和内吞作用[26]。USP12还可以通过影响Notch蛋白转运,下调其在细胞表面的水平,从而抑制下游信号作用[27]。USP12在癌症中的研究主要集中于前列腺癌中,其缺失能够显著促进前列腺癌细胞凋亡并引起细胞周期抑制[28-29]。Burska等[28]报道称USP12在前列腺癌细胞中可以直接去泛素化作用稳定雄激素受体AR蛋白结构,同时通过组蛋白去泛素化影响USP12转录而间接调控其水平。USP12下调AKT磷酸化水平而影响其与雄激素受体信号相互作用[30]。此外,USP12不仅作为癌症发展的标志物,还与治疗抵抗性和癌症复发相关,可能的机制为USP12通过去泛素化MDM2和AR,调控抑癌基因TP53和癌基因AR在前列腺癌细胞中的水平[31]。但USP12在肺癌中的具体功能并未见报道。
本研究首先通过对TCGA数据库肺癌病例分析发现USP12在肺癌肿瘤组织中高表达,并通过肺癌组织芯片免疫组化染色确证这一现象,说明USP12在肺癌中可能发挥抑癌功能。MTT与克隆形成实验结果进一步证实USP12对肺癌细胞增殖呈时间依赖性抑制。流式细胞术结果显示过表达USP12后肺癌细胞凋亡比例显著增加。Caspase为经典细胞凋亡信号通路,蛋白质免疫印迹实验表示USP12过表达引起的细胞凋亡伴随Caspase 3酶活性的激活。我们将在后续实验中继续探究USP12在NSCLC中的具体调控机制。针对USP12在NSCLC中的深入研究可能为靶向去泛素化酶家族在肺腺癌中的治疗提供更多依据。
