circCSPP1通过吸附miR-431促进结直肠癌增殖转移
2021-06-11袁晨磊关杰文
袁晨磊,张 姚,关杰文,窦 唯,张 鹏,赵 鑫
(1.苏州大学医学部,江苏 苏州 215123;2.苏州大学附属第一医院胃肠外科,江苏 苏州 215006)
结直肠癌(colorectal cancer, CRC)是消化系统最常见的恶性肿瘤之一,其发病率呈增长趋势。近年来肠镜检查的普及以及腹腔镜手术的发展,CRC的手术效率、术后临床疗效都有了显著的进步,但CRC的预后却仍不乐观,尤其是晚期转移患者,5年生存率不超过10%[1]。因此,阐明CRC的进展机制,发现新的生物标志物,对CRC的治疗具有重要意义。
微小RNA(micro RNA, miRNA)是一种非编码RNA分子(长度为20~22 个核苷酸),主要功能是通过与靶向mRNA的3'非翻译区(UTR)结合来防止mRNA转录或在转录后水平上引发mRNA降解[2]。鉴于miRNA高度的组织特异性,通过靶向组织中的miRNA对包括CRC在内的恶性肿瘤有巨大的临床应用前景。另外在竞争性内源RNA(ceRNA)的理论中,circRNA竞争性结合miRNA,miRNA可以将circRNA的信号转移至下游mRNA中,抑制mRNA的翻译过程,最终影响基因的表达[3]。
环状RNA(circular RNA, cricRNA)是一种新发现的具有共价闭环结构的长非编码RNA,广泛存在于人体细胞中[4]。circRNA在基因调控中起着至关重要的作用,如作为miRNA海绵吸附miRNA,调控相关基因以及多肽的表达等[4-8]。最新的研究[8-12]表明,circRNA在包括CRC在内的多种恶性肿瘤中发挥了重要的调控作用。circCSPP1作为新近发现的cricRNA在包括神经胶质瘤以及肝细胞癌中的机制已有相关研究,但其作用的分子机制尚不清楚。本研究旨在探讨circCSPP1在CRC中的作用及机制。
1 材料与方法
1.1 材料 PrimeScrip RT reagent Kit和SYBR Green PCR试剂盒购自Takara公司;NanoDrop 2000超微量分光光度计购自美国Thermo公司;Trizol试剂购自Invitrogen公司;链霉素、青霉素与DMEM培养基购自GIBCO公司;Lipofectamine TM2000购自美国Thermo公司;G418新霉素购自汉恒生物公司;AxyPrep质粒制备试剂盒购自爱思进生物技术有限公司;RNase R试剂盒购自吉赛生物公司;Transwell试剂盒购自康宁公司;荧光素酶报告分析试剂盒购自美国Promega公司;miRNeasy反转录试剂盒与miRNeasy PCR试剂盒购自德国Qiagen公司。
1.2 生物信息学分析 从GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)中选取gse121895及gse126094两个芯片作为研究对象,均采用芯片测序方法获取人类CRC及其相配对的正常组织的circRNA信息,其中gse121895芯片有2组CRC及癌旁组织数据,gse126094芯片有10组CRC及相对应的癌旁组织数据,癌组织及癌旁组织均呈对应关系。
1.3 临床资料 临床标本均来自于2019年09月—2020年08月苏州大学附属第一医院初治的CRC患者的根治性手术切除标本,共25 例,其中男性17 例,女性8 例。所有患者均经术后病理证实为CRC并未发现远处转移。患者为初次诊断且术前未经历放化疗等辅助治疗。其中肿瘤分期T≥3期患者23 例,有淋巴结转移患者7 例,样品按照匹配的CRC组织及远离癌组织5 cm以上的正常结直肠组织保存,样本的获取取得了患者及家属的知情同意并通过苏州大学附属第一医院医学伦理委员会的审批。
1.4 细胞培养和转染 7组人CRC细胞(SW620,SW480,HT-29,LOVO,HCT116,DLD-1,M5)均来自于江苏省临床免疫研究所,该细胞长期在实验室培育传代。细胞在含10%胎牛血清,1%青霉素链霉素双抗的DMEM培养基中培养,并保存于37℃,5% CO2的温箱中。
1.5 荧光原位杂交实验(FISH) 配置变性液(70%甲酰胺+SSC 现配)、杂交后洗涤液(SSC+蒸馏水+甲酰胺 现配)。细胞中加入Carnoy固定液,取3~4 滴至玻片上,烘干。后放入73 ℃变性液中浸泡5 min,随后依次用70%、85%、100%乙醇脱水。将探针密封在微量离心管中并于73 ℃水浴锅中浸泡5 min。玻片标本区域滴加探针并用盖玻片密封,样本置于37 ℃湿盒中过夜,洗脱缓释液清洗。用DAPI复染液染色并封片,在荧光显微镜下观察。
1.6 双荧光素酶实验 用10 mL Luciferase Assay Buffer Ⅱ溶解Luciferase Assay Substrate冻干粉,用Stop & Glo Buffer稀释50× Stop & Glo Substrate至1× Stop & Glo Substrate。将细胞平铺到96孔板上,在每个孔板上滴加circCSPP1荧光素酶报告基因质粒混合液以及miRNA转染混合液。培养2 d后弃去,PBS清洗。PLB液裂解,摇床上5 min。4 ℃,13 000 r/min,离心10 min。取裂解液加到LARⅡ 溶液中吹打混匀。化学发光仪下读数即为萤火虫荧光素酶活性。在记录完第一个荧光酶活性后加入Stop& Glo Substrate,再次读数,该读数为海肾荧光活性。报告基因表达水平=萤火虫荧光读数/海肾荧光读数。
1.7 实时定量聚合酶链式反应(qRT-PCR) 使用Trizol试剂分别从CRC组织和细胞系中提取出总RNA并检测总RNA的纯度,以总RNA为样本用PrimeScrip RT试剂盒逆转录为cDNA。采用SYBR预混料Ex-Taq-Ⅱ进行qRT-PCR反应。以上详细步骤按照试剂盒说明书进行。
1.8 MTT实验 用培养基重悬细胞,加入到96孔板中,放入细胞培养箱中培育3~5 d。当细胞长满孔板80%~90%时,滴加MTT溶液并置于温箱中培育4 h。弃去原培养基后加入DMSO溶液,放于摇床上充分摇晃10 min。测定待测溶液在490 nm波长处吸光值,绘制细胞生长曲线。
1.9 细胞克隆形成实验 将细胞液制备成单细胞悬液并计数,接种到6孔板上(400~1 000 个/孔)。当有明显克隆细胞团形成时,停止培养,将原培养基丢弃,用PBS将细胞冲洗干净。加入多聚甲醛和结晶紫染液,分别静置并用PBS清洗,风干。用数码相机进行拍照。比较细胞间克隆形成差异。克隆形成率=(克隆数/细胞数)×100%。
1.10 Transwell实验 取稳定传代细胞制成单细胞悬液并计数。如行侵袭实验,在Transwell小室底部膜上表面涂上Matrigel,风干。如行迁移实验则在Transwell上室加入90 μL细胞悬液,下室加入500 μL细胞培养基,随后在细胞培养箱中孵育24 h。取出Transwell小室,浸于70%甲醇液中半小时,PBS清洗后用台盼蓝进行染色。翻转Transwell小室,在显微镜下观察小室表面附着物,取3个视野进行计数,在统计时计每个视野均值。
1.11 统计学分析
1.11.1 生物信息学数据处理:在原始数据的处理中使用了perl语言进行基因的ID转换,使用R 3.6.3进行矩阵数据的处理,使用R语言中“Limma”包进行差异分析及火山图的制作,利用R语言中“VennDiagram”包进行Venn图绘制。文中差异筛选的条件均为abs(logFC)>1且P<0.05)生物信息学数据处理。
国土资源所要把服从于基层国土资源管理工作,服务于地方经济发展作为档案管理工作的出发点和归宿,在管理工作中体现国土档案和档案管理工作的价值。要强化国土档案工作的服务意识,从实际出发,充分发挥国土资源管理自身优势,切实提高国土所档案的利用率,努力使国土资源所档案由保管型向服务型转变,主动为领导决策、业务工作提供参考依据,为基层广大群众提供优质服务。同时,在利用过程中要贯彻规范的调借阅制度,建立登记台帐,以避免出现档案有借无还而缺少的现象。
1.11.2 实验数据处理:实验数据每组均由3个独立实验组成,用SPSS 22.0进行统计学分析,分别计算每组的均值及标准差,数据结果用均数±标准差的方式来呈现,使用t检验来验证(P<0.05)两组之间组间差异,单因素方差分析(P<0.05)被用来进行多组间的差异检验,利用GraphPad Prism 8软件来进行图形绘制。
2 结果
2.1 生物信息学分析CRC中circRNA的表达 筛选GEO数据库芯片数据,得到2 486 个差异表达基因(abs(logFC)>1且P<0.05)。红色和绿色分别代表上调及下调对象(图1A,图1B),结果显示,161 个基因在两个数据库中表达有明显差异(图1C),根据差异的显著性,按照P值从小到大排序,选出最显著的10 个基因:hsa_circ_0041829,hsa_circ_0003018,hsa_circ_0001946,hsa_circ_0055954,hsa_circ_0000257,hsa_circ_0005939,hsa_circ_0006232,hsa_circ_0001806,hsa_circ_0056264,hsa_circ_0040573。

图1 GEO数据库中circRNA的差异表达Fig.1 Differential expression of circRNA in GEO database
在CRC组织及其对应正常黏膜组织中,对筛选出的10种circRNA进行进一步分析,发现hsa_circ_0041829,hsa_circ_0001946,hsa_circ_0001806在癌组织及正常组织中表达具有显著差异,其中hsa_circ_0001806(后命名为circCSPP1)差异最显著,差异具有统计学意义(P<0.05)。其在CRC中的相对表达量是正常组织中3.52倍(图2)。

图2 CRC中多个circRNA相对表达水平Fig.2 Relative expression levels of multiple circRNAs in colorectal cancer
2.2 CRC临床样本中分析circCSPP1的表达 在25 例临床CRC样本中,根据qRT-PCR所得到的数据,circCSPP1在癌组织中较对应的癌旁组织表达量上升,差异具有统计学意义(P<0.001,图3)。
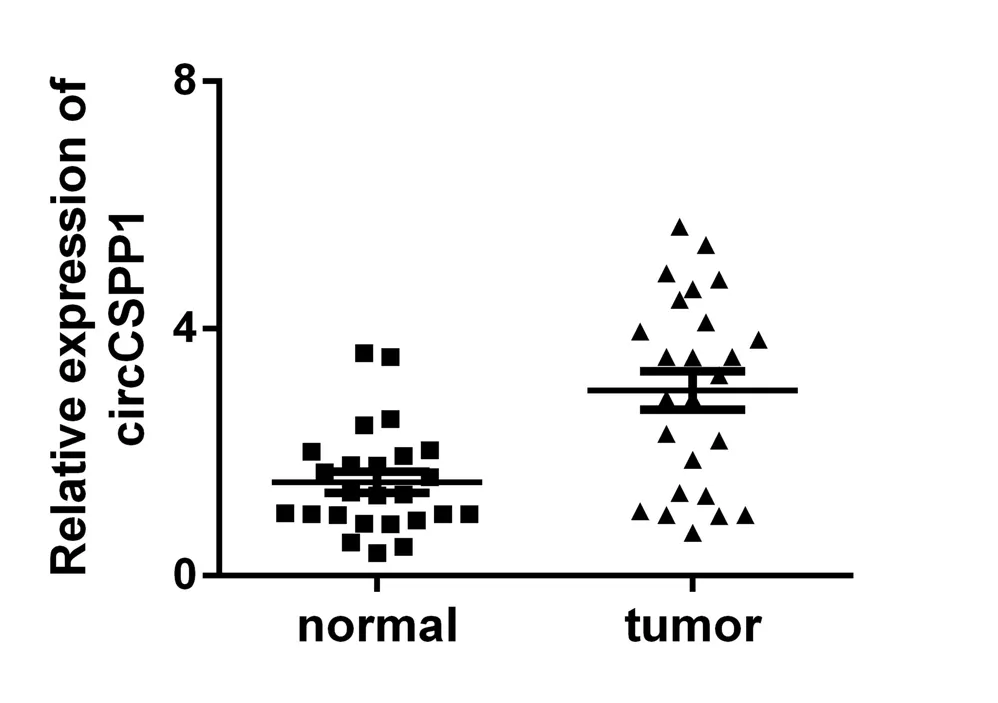
图3 临床样本中circCSPP1的相对表达水平Fig.3 Relative expression levels of circCSPP1 in clinical samples
2.3 实验细胞的筛选及sh-circCSPP1效率验证SW620,SW480,HT-29,LOVO,HCT116,DLD-1,M5均为人类CRC细胞株,根据qRT-PCR的结果,circCSPP1在这几株细胞中均呈现表达上调,LOVO和SW620细胞株中circCSPP1的相对表达量最高(图4),选取这两株细胞为研究对象进行后续研究。质粒转染结果显示,与对照组相比,sh-circCSPP1转染的细胞中circCSPP1表达量显著降低,差异具有统计学意义(P<0.05),这表明circCSPP1敲减株构建成功(图5)。

图4 不同CRC细胞株中circCSPP1的表达量Fig.4 Expression of circCSPP1 in different colorectal cancer cell lines

图5 sh-circCSPP1转染后细胞相关基因表达水平Fig.5 Expression levels of cell-related genes after sh-circCSPP1 transfection
2.4 MTT实验检测CRC细胞增殖 MTT实验表明,在SW620及LOVO细胞系中,随着培育时间的延长,细胞数目均有稳定增长,与对照组相比,转染后的细胞增长率在每个时间点均有下降(图6),差异具有统计学意义(P<0.05)。这表明了敲低circCSPP1可以抑制CRC细胞的增殖。

图6 细胞在490 nm处生长曲线Fig.6 Cell growth curve at 490 nm
2.5 克隆形成实验检测CRC细胞的集落形成率 对照镜检下的结果可以发现,circCSPP1表达受到抑制后,细胞的集落形成明显受到了影响,差异具有统计学意义(P<0.05,图7)。
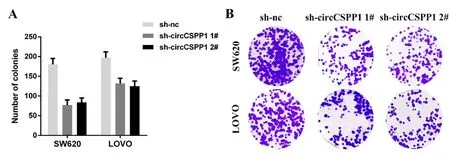
图7 细胞克隆实验Fig.7 Cell Cloning Experiment
2.6 Transwell实验检测CRC细胞迁移及侵袭Transwell转移与侵袭实验显示,低表达circCSPP1株对CRC细胞的迁移及侵袭能力均有显著影响(P<0.05,图8)。这表明circCSPP1与CRC进展的细胞表型密切相关,据此我们在细胞层面验证了circCSPP1的促进CRC进展的作用。
Transwell迁移与侵袭实验显示,低表达circCSPP1后,CRC细胞的迁移及侵袭能力均有显著下降(P<0.05,图8)。
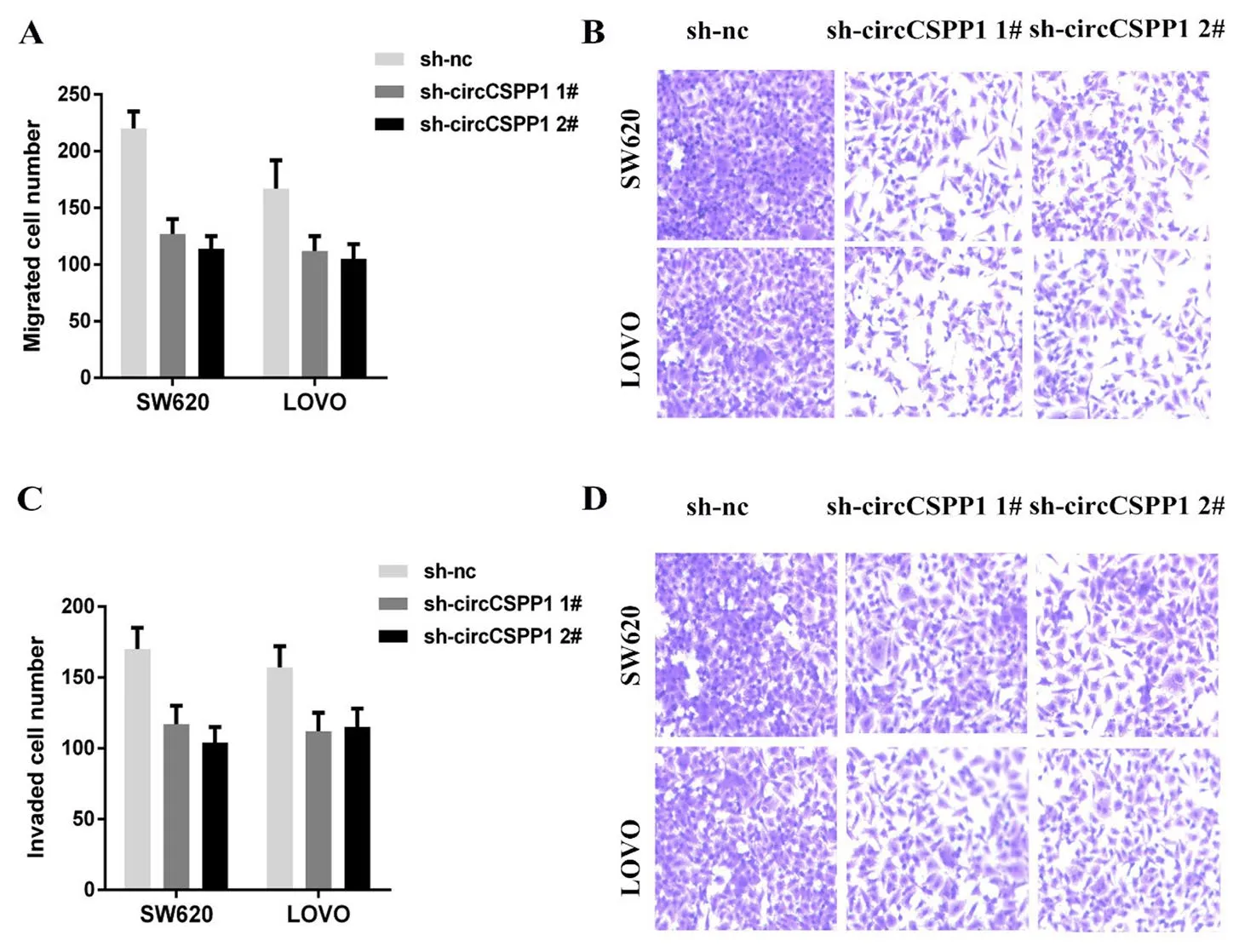
图8 Transwell侵袭和迁移实验Fig.8 Transwell invasion and migration assay
2.7 circCSPP1下游作用靶点的筛选 由于circCSPP1具有MRE(miRNA结合位点),因此circCSPP1可能通过ceRNA的途径来调节基因的表达。运用CircInteractome(circinteractome.nia.nih.gov)预测circRNA与miRNA结合靶点。报告基因实验原理为通过将circCSPP1的编码序列与miRNA连接,通过检测混合产物的表达量,进而探究circCSPP1与miRNA的关联,选取生物信息学分析结果中的5个miRNA进行双荧光素酶实验,结果发现加入miR-431 mimics及miR-486-3p mimics荧光素酶活性最低,即miR-431 mimics及miR-486-3p mimics与circCSSPP1存在连接的作用点。通过对比,选择最有可能产生关联的miR-431 mimics进行后续实验(图9)。

图9 加入不同miRNA后荧光素酶活性变化Fig.9 Variation of luciferase activity after adding different miRNAs
2.8 circCSPP1与miR-431在CRC细胞中的相互作用 通过数据库的预测序列,发现circCSPP1中的CAAGACA与miR-431中的GUUCUGU存在互补位点,这也可能是circCSPP1作为分子海绵与miR-431的结合位点,据此位点设计出circCSPP1-mut突变株(图10a)。随后在SW620及LOVO细胞株中分别验证了miR-431与circCSPP1及circCSPP1-mut之间的关联,结果显示,circCSPP1组的荧光素酶表达下降(P<0.05),而circCSPP1突变组在加入miR-431 mimics后的荧光素酶表达量未见明显变化(图10b),表明circCSPP1可以与miR-431相互作用,而突变株的基因并未与miR-431作用,因此猜测circCSPP1与miR-431的作用位点位于circCSPP1上CAAGACA部分。
在circCSPP1的敲低实验中,miR-431高表达,而circCSPP1过表达实验中,miR-431低表达(图10c,图10d)。由于细胞质中的circRNA主要是作为竞争性内源RNA出现,而细胞核中的circRNA多数调控着亲本基因的表达,FISH实验结果观察到细胞中circCSPP1和miR-431的分布情况,蓝色表示细胞核中DAPI,橘色表示细胞质中的miR-431,绿色表示细胞质中的circCSPP1,在此实验中DAPI为内参,结果提示circCSPP1及miR-431主要聚集部位均为细胞质中(图11,见封二),这为circCSPP1与miR-431在生物学上的相互作用提供了理论基础,综上可以认为细胞质中的circCSPP1通过竞争性结合胞质中的miR-431而解除其对mRNA的锚定作用。

图10 cicCSPP1与miR-431之间相互作用Fig.10 Interaction between circCSPP1 and miR-431

2.9 miR-431在临床样本中的表达 为了证实在细胞实验中的研究结果,在25 个CRC样本中验证circCSPP1与miR-431表达的相关性,结果显示miR-431的表达与circCSPP1呈现负相关(r=-0.35,P<0.01)(图12),用qRT-PCR实验对miR-431在正常及CRC组织中的分析表明,miR-431在CRC中低表达,其差异具有统计学意义(P<0.05,图13)。

图12 CRC样本中miR-431与circCSPP1负相关Fig.12 miR-431 negatively correlates with circCSPP1 in colorectal cancer samples

图13 CRC样本中miR-431表达量Fig.13 Expression of miR-431 in colorectal cancer samples
3 讨论
本研究显示circCSPP1在CRC中高表达,提示circCSPP1的表达水平可能与CRC的癌变相关。研究显示,circRNA在多种癌组织中呈现高表达。Fan等[13]的研究显示,circARHGAP12在鼻咽癌组织和细胞系中显著上调。Zhang等[14]的研究也显示,circ-UBR1在乳腺癌中上调。这提示在CRC中也可能存在高表达的circRNA。通过对两个数据库中的共同差异基因进行分析,最终确定了circCSPP1作为研究的目的基因。为了进一步证实circCSPP1与CRC相关,通过qRT-PCR在CRC样本中检测了相关基因表达水平,从结果可以体现circCSPP1与CRC之间具有相关性,这与GEO数据库中得到的结论一致,说明了circCSPP1作为CRC分子标志物的可行性。
circCSPP1在CRC中的高表达提示其可能在促进CRC的进展中发挥重要作用。Xue等[15]研究显示circCSPP1在胶质瘤中表达显著上调,促进肿瘤的增殖、侵袭和迁移。通过细胞实验对circCSPP1的结构以及在CRC中的所发挥的具体功能进行验证。首先通过FISH实验和RNase R实验,发现circCSPP1在细胞质中表达且具有稳定的结构特征,这和circRNA的闭环结构特征相符。对circCSPP1的剪接位点进行了Sanger测序,根据基因芯片的信息,发现circCSPP1位于基因上chr8:68018139-68028357部分,通过比对测序的结果,circCSPP1外显子11的3'端与外显子8的5'端连接,这种连接无法通过正常的线性剪接完成,据此可以得到circCSPP1由外显子反向剪接而成的结论。将sh-circCSPP1转录进细胞后,可以发现circCSPP1表达显著下降,表明circCSPP1敲低的细胞能够稳定表达。利用MTT实验,细胞克隆实验以及Transwell实验,证明circCSPP1在促进CRC细胞的恶性演变过程中发挥了巨大作用。这表明circCSPP1在CRC中作为促癌基因并且对于成为CRC的分子标记物及治疗靶点具有重要的意义。
本研究从circRNA作为竞争性内源RNA方向探究circCSPP1的作用机制。首先筛选出miR-431为circCSPP1可能的下游分子机制。通过双荧光素酶报告基因实验,发现突变株的circCSPP1并没有与miR-431产生关联,而原本的野生circCSPP1与miR-431形成了复合物,进一步论证了circCSPP1可以与miR-431结合,且circCSPP1与miR-431的结合位点就是CAAGACA,即预测的位点结合部分。在FISH实验结果中可以看出circCSPP1与miR-431均存在于细胞质中。另外在CRC细胞中分析了miR-431的表达情况,发现过表达circCSPP1可以降低miR-431表达,反之敲低circCSPP1则导致miR-431的表达提升,从分子层面说明了circCSPP1与miR-431的相关性(竞争性抑制),circCSPP1发挥海绵机制吸附miR-431,减少了胞质中miR-431的相对含量。在Yi等[16]的研究也显示出促癌基因circEPHB4通过海绵样吸附miR-637刺激胶质瘤细胞的增殖。这也佐证了海绵吸附作用机制的可行性。
综上,本研究发现circCSPP1在CRC中高表达,且可能作为miR-431的海绵通过吸附作用抑制miR-431在CRC中的表达,从而促进CRC的增殖和转移,这将对CRC的生物治疗和靶向治疗提供理论基础并具有重要意义。
