纤维蛋白原样蛋白1在乳腺癌中的表达及临床意义
2021-06-11牛子贺唐浩益张少卿张立峰徐志华
牛子贺,唐浩益,顾 杰,张少卿,王 洋,张立峰,徐志华,陈 彦
(1.苏州大学医学部,江苏 苏州 215123;2.苏州大学附属第一医院普外科,江苏 苏州 215006)
乳腺癌是全世界女性中最常见的恶性肿瘤之一,也是女性中癌症相关死亡的第二大原因[1]。虽然近年来乳腺癌的早期诊断和综合治疗取得一定进步[2],但是乳腺癌患者的预后并没有得到明显改善,再加上某些类型的乳腺癌具有高度侵袭性易发生转移,其总体生存率仍然很低[3]。因此,研究乳腺癌发生发展机制,寻找新的标志物,对乳腺癌患者个体化治疗、延长生存时间具有重要意义。纤维蛋白原样蛋白1(fibrinogen-like protein 1, FGL1)是肝细胞或肿瘤细胞分泌的一种可以促进有丝分裂的特异生长因子,又叫促肝细胞生长因子或者肝细胞衍生纤维蛋白原相关蛋白1,可以通过自分泌形式刺激肝细胞的增殖[4-5],是Yamamoto等[6]首次从肝细胞癌标本中分离出来的,研究[7]表明,FGL1可以通过激活LAG-3受体参与非小细胞肺癌的免疫治疗。然而在乳腺癌中FGL1相关研究较少,本研究旨在检测FGL1在乳腺癌中的表达并了解其与预后的关系,为临床治疗及预后预测提供理论依据。
1 材料与方法
1.1 病人资料收集 收集2020年1月—2021年7月在苏州大学附属第一医院行手术治疗的16 对乳腺癌患者的癌及癌旁组织标本。所有患者手术之前均未行放化疗等辅助治疗且术后病理证实为乳腺癌。所有患者均签署知情同意书且经苏州大学附属第一医院伦理委员会批准。
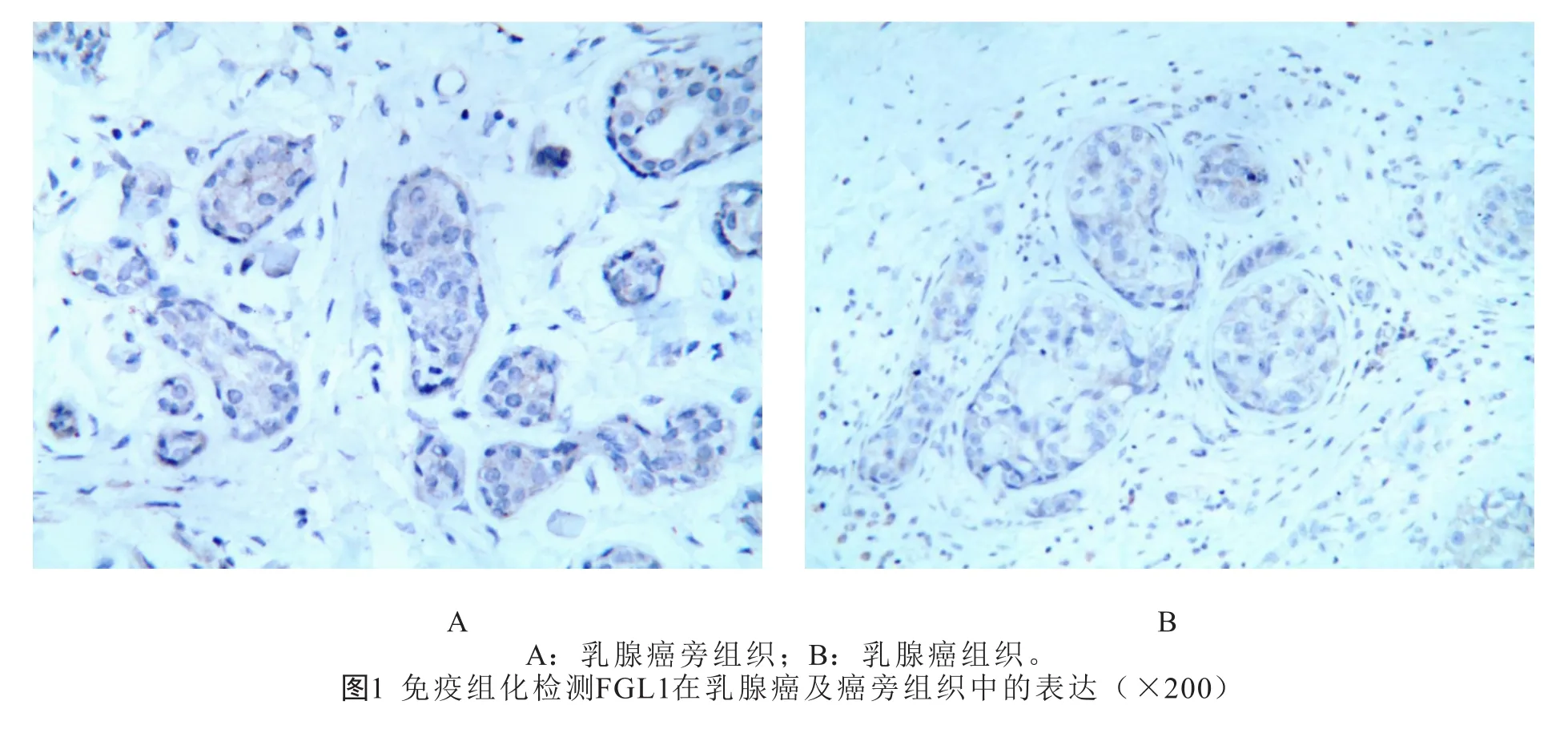
1.2 免疫组化及结果判读 将蜡块组织切成5 μm厚度切片,烤片2 h后二甲苯脱蜡,酒精脱水,柠檬酸盐缓冲液中抗原修复,过氧化氢室温孵育阻断内源性过氧化氢酶的活性,10%山羊血清孵育封闭,用PBS冲洗3 遍后,滴加FGL1抗体(美国加州,博士德,1:1 000),在4 ℃下一抗孵育过夜,PBS冲洗3 遍后室温条件下二抗孵育1 h,然后与二氨基联苯胺(DAB)反应,苏木精复染分化,二甲苯透明后中性树胶封片,最后在显微镜下观察染色情况并拍照。免疫组化检测结果由2位经验丰富的病理医师评估,染色强度计分为0、1、2、3(无、弱、中、强),染色百分比计分为0、1、2、3(<5%、5%~25%、26%~50%、51%~100%)。染色强度与染色百分比的乘积作为最终结果,>6 分为高表达组,否则为低表达组。
1.3 生物信息分析 Kaplan-Meier Plotter是生存数据在线分析数据库(http://kmplot.com/analysis/),包含了约54 000 个基因,21 种癌症类型,本研究利用该数据库分析乳腺癌患者中FGL1表达水平与临床预后的关系。
1.4 统计学方法 数据均采用SPSS 20.0统计软件包进行统计学分析。两组间比较采用t检验,Kaplan-Meier生存曲线分析FGL1表达水平与乳腺癌患者预后的关系。P<0.05为差异有统计学意义。
2 结果
2.1 FGL1在乳腺癌组织中表达降低 通过免疫组化分析FGL1在乳腺癌癌及癌旁组织中的表达发现,在16 例乳腺癌患者癌组织标本中,低表达组12 例(75.00%),高表达组4 例(25.00%);而在癌旁组织中,高表达组13 例(81.25%),低表达组3 例(18.75%),统计分析表明,与癌旁组织相比,FGL1在乳腺癌癌组织中表达降低,差异具有统计学意义(P<0.05)。(图1,见封二)
2.2 FGL1表达与乳腺癌患者临床预后关系 利用Kaplan-Meier Plotter在线分析工具我们分析了不同分型下患者的预后,在StGallen分型中,所有患者中高表达组无复发生存时间(Relapse Free Survival,RFS)比低表达组患者更长(P=0.00000),有趣的是,在亚组分析中,Basal(P=0.00047)、Luminal A(P=0.00049)、Luminal B(P=0.00073)型乳腺癌中有相同的结果,而HER2+型乳腺癌中则差异没有统计学意义(P=0.73);在PAM50分型中,Basal(P=0.12)、Luminal A(P=0.09)、HER2+(P=0.14)则均差异没有统计学意义,仅在Luminal B(P=0.039)、Normal(P=0.021)差异有统计学意义;在Pietenpol分型中,Basal-like 1型乳腺癌中,高表达组的RFS明显长于低表达组(P=0.0028),但是在Basal-like 2(P=0.48)、Immunomodulatory(P=0.16)、Mesenchymal(P=0.96)、Mesenchymal stemlike(P=0.32)、Luminal androgen receptor(P=0.051)型乳腺癌中则差异没有统计学意义。结果分析表明,FGL1与乳腺癌生存预后有关,可以作为预测疾病生存的生物学指标。(图2)

图2 乳腺癌中FGL1基因表达对临床预后的影响
3 讨论
乳腺癌是多因素、多基因参与的复杂疾病,目前主要治疗手段包括手术、放化疗、内分泌及靶向治疗在内的综合治疗。随着科技的进步,多基因检测技术广泛开展可以用于评估患者复发风险,在治疗、预后信息等方面提供重要价值。但是这些基因对于患者生存预后的预测体系并不完善,因此我们研究了FGL1基因。
FGL1是纤维蛋白原家族的一员,位于人类8号染色体(8p21.3-p22),是一个由二硫键连接的同型二聚体组成的68 KD蛋白,可编码由312 个氨基酸组成的蛋白质,以同源二聚体形式发挥生物学活性。目前已知FGL1是肝细胞再生的产物,参与肝细胞有丝分裂和肝能量利用。肝切除术和术后炎症释放的因子白介素6和转化生长因子TGF-β会影响FGL1的表达[8]。在这些外源因素诱导下,正常肝细胞通过信号转导和转录激活因子(STAT3)和肝细胞核因子-1A(HNF-1A)调节FGL1的转录[9]。慢性内科疾病如高脂血症、胰岛素抵抗、高血糖危象也会调节FGL1的表达。除上述功能外,血浆中也可以检测到FGL1,可以预测类风湿关节炎和登革热严重程度[10]。综上,FGL1在良性疾病中发挥重要作用,是一种潜在的生物标记物。当然,目前对FGL1基因表达调控研究不局限于生理病理功能探索。FGL1在实体瘤中的表达与癌旁组织表达不同,如Oncomine数据集的Meta分析显示,FGL1在肺癌、前列腺癌、黑色素瘤及结直肠癌中表达上调,而在胰腺癌、乳腺癌及肝癌中表达下调,这与本文中结果也是一致的。在TCGA数据集中,FGL1在肝癌中也是下调的,研究[11]表明,在肝癌中,由于HNF-1A的缺失,FGL1表达下调。此外,FGL1也介导肿瘤EMT过程,但有趣的是FGL1与肿瘤EMT结论却不一致,例如,在肝激酶突变的肺腺癌细胞(A549和H157C)中沉默FGL1,E-cadherin下调,N-cadherin和Vimentin上调[12],但是在SGC-7901胃癌细胞中,敲除FGL1后出现相反的结果[13]。因此,关于FGL1与肿瘤EMT进展还有待进一步研究。最新研究[7]表明,FGL1和抑制性受体LAG3之间可形成一个与PD-1/PD-L1不同的免疫抑制途径,既作用于肿瘤本身,也可作用于免疫细胞,可通过靶向治疗策略对晚期癌症产生双向协同作用,作为预测晚期肿瘤患者抗PD-1/PD-L1治疗效果的有效生物标志物。
本研究中,我们通过收集乳腺癌及癌旁组织标本并进行免疫组化染色,结果提示FGL1在乳腺癌中低表达,生存分析结果提示高表达组较低表达组的RFS长,虽然在不同分型中部分亚组分析结果不一致,但这可能是因为其样本量较少。因此接下来我们可以收集更多的临床样本,对乳腺癌的发生发展机制做进一步研究。总之,FGL1在乳腺癌中低表达且与预后相关,可有望成为判断预后的有效标志物。
