水力空化在不同pH下对大豆β-伴球蛋白理化性质的影响
2021-06-10马莹莹任仙娥李春枝杨锋黄永春阎柳娟
马莹莹,任仙娥*,李春枝,杨锋,黄永春,阎柳娟
广西科技大学生物与化学工程学院,广西糖资源绿色加工重点实验室,广西高校糖资源加工重点实验室(柳州 545006)
大豆蛋白氨基酸组成合理,并具有良好的加工性能以及较低的成本,常作为重要的食品配料被广泛应用于食品行业。大豆蛋白的主要成分为11S(大豆球蛋白)和7S(β-伴球蛋白),其中β-伴球蛋白是一种糖蛋白,具有三聚体的分子结构,由α’-、α-和β-这3个亚基组成。大豆蛋白经过适当修饰改性后可获得更好的功能性质,满足不同类型食品体系的需求[1]。蛋白质改性方法有物理改性和化学改性等方法,物理改性是通过改变蛋白质的高级结构和分子间聚集方式使蛋白质发生改性,具有无毒副作用、安全性高及对产品营养性质影响较小等优点而被广泛使用。空化技术作为近些年应用在食品加工中的新的物理方法,引起国内外很多学者的关注。
水力空化作为一种新兴技术,具有和超声空化相似的空化效应,在食品蛋白方面已有很多学者研究。Gregersen等[2]、Li等[3]的研究表明水力空化技术可降低牛奶蛋白浓缩物黏度,从而提高喷雾干燥效率,降低乳制品粉末的生产成本。Meletharayil等[4]研究发现水力空化可改善希腊酸奶的流变特性和微观结构。Pathania等[5]发现水力空化提高难以溶解的高蛋白奶粉再水化性能。可见,水力空化技术在一定条件下能改变食品蛋白质的理化性质,进而改善其产品品质。前期研究发现单孔孔板水力空化可使大豆球蛋白的平均粒径、暴露巯基含量和总巯基含量均减小,Zeta电位绝对值和表面疏水性均增加[6]。试验进一步研究水力空化处理对大豆蛋白中另一组分——大豆β-伴球蛋白理化性质的影响,为该技术应用于大豆蛋白改性提供依据。
1 材料与方法
1.1 材料与试剂
脱脂豆粕(益海嘉里(防城港)有限公司);乙二胺四乙酸二钠(EDTA二钠,西陇化工股份有限公司);1-苯胺-8-萘磺酸(ANS,上海阿拉丁生化科技股份有限公司);十二烷基硫酸钠(SDS,天津市大茂化学试剂厂);5, 5’二硫代双(2-硝基苯甲酸)(DTNB,国药集团化工试剂有限公司);三羟甲基氨基甲烷(天津市科密欧化学试剂有限公司);福林酚(上海源叶生物有限公司)。其余试剂均为国产分析纯。
1.2 仪器与设备
T6新世纪紫外-可见分光光度计(上海圣科仪器设备有限公司);F97Pro型荧光分光光度计(天津港东科技发展股份有限公司);Avanti J-26 XPI高速冷冻离心机(美国贝克曼库尔特有限公司);Nano ZS90马尔文纳米粒度和Zeta电位分析仪(英国马尔文仪器有限公司);T25高剪切混合乳化机(上海鑫鲨机械设备有限公司)。
1.3 试验方法
1.3.1 大豆β-伴球蛋白的制备
参照Nagano等[7]的方法稍作修改。脱脂豆粕经过粉碎后,用0.180 mm直径的筛子过筛,得到脱脂大豆粉。称取120 g豆粕粉并将其充分溶解于1.8 L去离子水中,用2 mol/L NaOH溶液将pH调至8.0。室温低速搅拌2 h,离心(9 000g,10 min,4 ℃)弃沉淀,保留上清液。向上清液中加入NaHSO3(0.01 mol/L),充分溶解后用2 mol/L HCl溶液调pH 6.4。将所得料液放置于4 ℃的冰箱内冷藏,静置过夜后离心(9 000g,10 min,4 ℃),得沉淀大豆球蛋白(11S),向上清液中加入CaCl2固体(0.01 mol/L),充分溶解后用2 mol/L HCl溶液将pH调至5.0。将调好后的料液放入已加热至45 ℃水浴锅中静置保温30 min,保温结束后将料液温度降至25 ℃左右,用2 mol/L NaOH溶液调pH 5.5。离心(9 000g,10 min,4 ℃)取上清液,上清液加等体积的去离子水(体积比1︰1),搅拌均匀后用2 mol/L HCl溶液调pH 4.8。在室温下静置2 h后离心(6 500g,10 min,4 ℃),所得沉淀即为大豆β-伴球蛋白。向大豆β-伴球蛋白沉淀中加入少量去离子水溶解,用2 mol/L NaOH溶液调pH 7.0,充分搅拌溶解。装入经过处理的透析袋中,放于4 ℃冰箱透析48 h,透析液经真空冷冻干燥后装入密封袋,放置冰箱冻藏备用。
1.3.2 水力空化处理不同pH大豆β-伴球蛋白
将大豆β-伴球蛋白配成4份质量分数为3%的分散液于1 000 mL烧杯中,分别调pH至3,5,7和9,取800 mL倒入水力空化装置的贮罐中,空化装置图同文献[6],启动装置,开启冷凝水使大豆β-伴球蛋白在整个处理过程中温度不超过35 ℃,处理不同时间(0,10和30 min)后取样测定其理化指标,每个指标测3次。
1.3.3 粒径和Zeta电位的测定
将空化处理后的蛋白质离心(10 000 r/min,10 min,4 ℃)后稀释至3 mg/mL,用0.45 μm的滤膜在室温下采用纳米粒度仪测定各样品的粒径。再取样品测定其Zeta电位。测定条件:1 cm聚苯乙烯池,一对0.45 cm2铂电极,间距0.4 cm,测定温度25 ℃,平衡时间2 min。
1.3.4 表面疏水性的测定
参照Voutsinas等[8]的方法,以ANS为荧光探针,将蛋白样品用0.2 mol/L、pH 8.0的磷酸盐缓冲液稀释至不同质量浓度(0.005~0.5 mg/mL),取4 mL样品,加入10 μL 8 mmol/L ANS溶液,混合均匀后,在荧光分光光度计下进行测定。设定激发波长370 nm、发射波长490 nm、狭缝宽5 nm。以荧光强度对蛋白质量浓度作图并进行线性回归,以线性回归斜率作为蛋白质的表面疏水性。
1.3.5 乳化性的测定
参考杨盛楠等[9]方法稍作修改。将蛋白样品稀释至3 mg/mL,取15 mL蛋白溶液,加入5 mL玉米油,在试管中加入5 mL的1 mg/mL的SDS备用,将蛋白溶液在均质机下进行均质分散1 min,转速10 000 r/min。均质停止时直接从底部吸取50 μL的乳浊液加入到装有SDS溶液的试管中,并将其充分混匀。静置10 min之后再从均质后的样液的底部吸取50 μL加入到另一支装有SDS溶液的试管中,使用紫外可见分光光度计在500 nm处测定吸光度。静置前后所测得的吸光度用A0、A10表示。以SDS溶液作为空白对照。乳化活性指数(EAI,m2/g)和乳化稳定性(ESI,min)分别按式(1)和(2)计算。

式中:θ为用于形成乳液所用油相在溶液中所占体积比;C为蛋白质浓度,g/mL;L为比色皿的厚度;DF为稀释倍数;A0为均质停止时取样测定的吸光度;A10为静置10 min后取样测定的吸光度。
2 结果与分析
2.1 粒径分布
大豆β-伴球蛋白在不同pH下的粒径分布如图1(A)所示。在所试pH下均呈多峰分布,其中在pH 5时有4个峰,1~100 nm处现3个峰,100~1 000 nm处1个峰;pH 3时有3个峰,分别在10~100,100~1 000和1 000~10 000 nm;pH 7和9时呈双峰分布。由图2可知,在pH 5时,平均粒径最大,为213.07±4.24 nm;pH 7和9时,平均粒径较小,分别为(18.30±4.41)nm和(15.11±0.22)nm。因为在溶液pH接近等电点(pI=4.8)时,分子间静电斥力降低,发生聚集,所以平均粒径较高。
由图1(B)可知,大豆β-伴球蛋白在pH 3时,水力空化处理后1 000~10 000 nm处的峰消失,10~100 nm处的峰向左偏移。pH 5时,处理后的粒径分布如图1(C)所示,100~1 000 nm处的峰均向左偏移,且处理30 min后在1 000~10 000 nm出现一个峰。从图1(D)中可知,pH 7时水力空化处理对蛋白的粒径分布无影响。pH 9时粒径分布图如1(E)所示,经水力空化处理后10~100 nm处的峰强度增加,粒径分布变窄。由图2可知,pH 5时,其平均粒径随空化处理时间显著减小(p<0.05),处理30 min后蛋白的平均粒径从(213.067±4.25)nm减小到(96.9±0.74)nm,这可能是由于空化效应,产生湍流和高剪切力,破坏蛋白分子间相互作用,大豆β-伴球蛋白的大聚集体逐渐被解离成小聚集体,从而导致平均粒径显著减小。王芳等[6]的研究结果表明单孔孔板水力空化处理可显著降低大豆球蛋白的平均粒径,处理30 min后大豆球蛋白的平均粒径由(335.67±3.43)nm减小至(234.73±4.32)nm。Hu等[10]的研究结果表明高强度超声处理40 min,7S球蛋白的平均粒径从75.9 nm减小到51.8 nm。由此说明水力空化和超声空化等物理改性具有相似的效果,均能引起蛋白质分子中聚集体的解离,从而导致其平均粒径减小。而在pH 3,7和9时,水力空化处理并未引起大豆β-伴球蛋白平均粒径发生显著变化(p>0.05)。

图1 水力空化对不同pH大豆β-伴球蛋白粒径分布的影响
2.2 Zeta电位
蛋白质的Zeta电位可以通过蛋白质表面电荷的分布来体现[11]。通常,蛋白质表面带负电荷的氨基酸多于带正电荷的氨基酸时,其Zeta电位为负值,反之则为正值。Zeta电位的绝对值越大,表明体系越稳定[12]。由图3可知,pH 3时,电位为正值,说明在酸性条件下蛋白质表面带正电荷的氨基酸多于带负电荷的氨基酸。pH 5,7和9时电位为负值,且随着pH的增加电位绝对值增大。
大豆β-伴球蛋白经水力空化处理后,其Zeta电位绝对值在pH 3和7时减小,pH 5和9时显著增加(p<0.05)。Zeta电位绝对值增加可能是经孔板水力空化处理后,蛋白质分子的结构在一定程度上被破坏,分子展开带负电荷的氨基酸残基更多被暴露于蛋白分子表面而导致的。pH 5时平均粒径减小(图2),聚集体发生解聚,更多带负电荷的氨基酸残基暴露出来,也使Zeta电位绝对值增加。Zeta电位绝对值减小是因为在pH 3和7时,经水力空化处理后蛋白发生轻微聚集,带电荷的基团被掩埋导致Zeta电位绝对值减小。可见,水力空化处理后大豆β-伴球蛋白分子结构会发生改变。
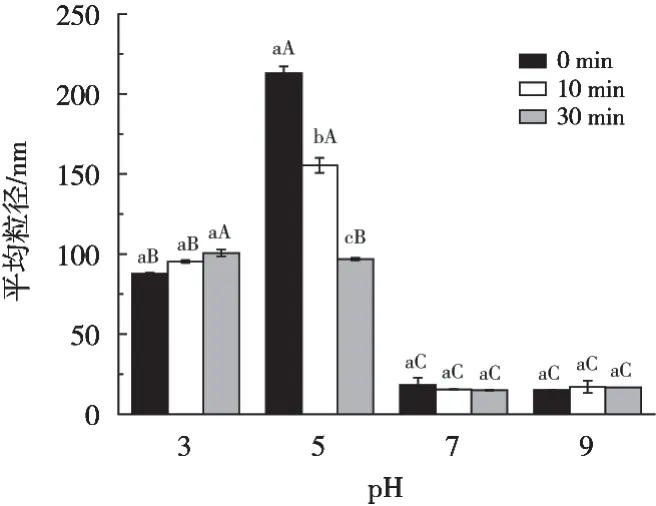
图2 水力空化在不同pH下对大豆β-伴球蛋白平均粒径的影响
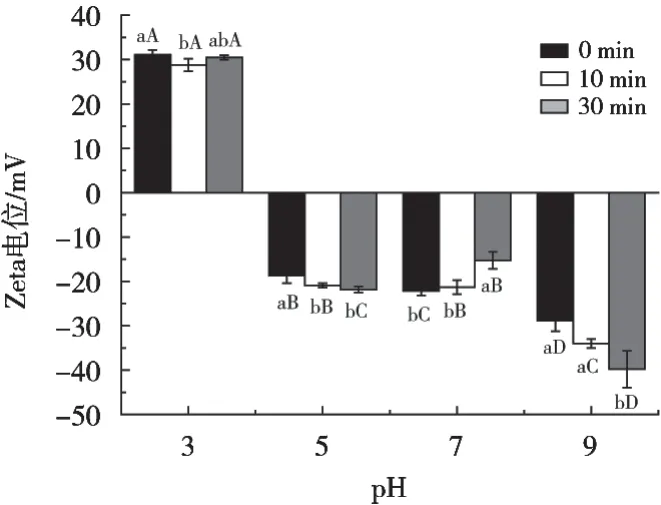
图3 水力空化对不同pH大豆β-伴球蛋白Zeta电位的影响
2.3 表面疏水性
表面疏水性是衡量蛋白质功能性质的重要指标之一[13],其大小是由疏水性基团暴露的程度决定的。如图4所示,pH 5时,表面疏水性最低(456.35±16.81),这是因为大豆β-伴球蛋白在疏水相互作用下形成聚集体,图2中pH 5时蛋白平均粒径最大也可印证这点。在pH>pI与pH<pI时,大豆β-伴球蛋白的表面疏水性均显著增加(p<0.05),且pH 3时达到最大(1 944.71±150.16),说明远离等电点时埋藏在蛋白分子内的疏水基团暴露出来,使表面疏水性增加。
大豆β-伴球蛋白在pH 3和9时经水力空化处理后,表面疏水性无显著变化(p>0.05),说明在pH 3和9时经水力空化处理后暴露到蛋白质表面的疏水性基团无明显变化,从图2也知pH 3和9的平均粒径无显著变化(p>0.05)。pH 5和7时,水力空化处理10 min后表面疏水性显著增加(p<0.05),说明有较多的疏水基团暴露在蛋白质分子表面,导致蛋白质表面疏水性增加。这可能是因为空化泡溃灭的瞬间产生高温、高压和高剪切力等,破坏蛋白质的高级结构或者使大的聚集体解聚,导致蛋白分子之间形成的聚集体较少(图2中平均粒径减小可印证),进一步暴露出包埋在β-伴大豆球蛋白分子中的疏水残基。图3中电位的绝对值增加也说明聚集体发生解离后更多疏水性残基暴露,导致表面疏水性增加。

图4 水力空化对不同pH大豆β-伴球蛋白表面疏水性的影响
2.4 乳化性
评价蛋白质乳化性的方法有乳化活性和乳化稳定性等方法。水力空化对不同pH大豆β-伴球蛋白乳化活性与乳化稳定性的影响如图5所示。由图5(A)可知,大豆β-伴球蛋白在pH 5时乳化活性较小,为(7.52±0.41)m2/g,远离等电点呈上升趋势,这与表面疏水性变化趋势一致(图4)。这是因为在等电点附近蛋白平均粒径最大(图2),表面疏水性较低(图4),蛋白难溶且静电斥力减小,所以乳化活性较差,远离等电点蛋白大的聚集体发生部分解聚,粒径减小,疏水性基团暴露出来,蛋白亲油性增强,宏观表现为乳化活性升高[14]。
由图5(A)可知,大豆β-伴球蛋白的乳化活性在pH 5,7和9时随水力空化处理时间的延长而增加,在pH 7空化时间为30 min时达到最大(95.48±0.82 m2/g)。这是因为水力空化产生的空化效应使蛋白结构遭到破坏,蛋白分子的极性亲水基团与非极性疏水基团暴露出来,亲水性与亲油性均增强,亲水性与亲油性达到一定程度的平衡时,蛋白质在油水界面具有较好的稳定性,表现为乳化活性增强[15]。从图5(B)中可见,大豆β-伴球蛋白经水力空化处理后乳化稳定性在pH 3和5时呈下降趋势,而在pH 7空化10 min与pH 9空化30 min后乳化稳定性增大。pH 3时的乳化稳定性较低,可能是此时的蛋白质粒径比碱性条件下的粒径大,粒子分布不均匀,导致稳定性降低。

图5 水力空化对不同pH大豆β-伴球蛋白乳化性的影响
3 结论
大豆β-伴球蛋白的平均粒径、Zeta电位、表面疏水性和乳化性等理化性质随着pH的改变而不同。水力空化处理在试验所试pH下均可使其理化性质发生变化,变化程度与其所处的pH有关,以pH 5和7时较为明显。可见,水力空化协同pH处理对大豆β-伴球蛋白的改性具有一定效果,这对将水力空化技术应用到大豆蛋白的生产中有一定意义。关于水力空化在不同pH下对大豆β-伴球蛋白的二级结构以及起泡性、凝胶性等功能性质的影响有待进一步研究。
