CuFeMnO4@SiO2@TiO2磁负载光催化材料的制备及磁回收性能
2021-06-10陈舒贤,刘贵山,2,曹鹏斌,闫爽,2
陈 舒 贤,刘 贵 山,2,曹 鹏 斌,闫 爽,2
(1.大连工业大学 纺织与材料工程学院,辽宁 大连 116034;2.大连工业大学 辽宁省高校新材料与材料改性重点实验室,辽宁 大连 116034)
0 引 言
当锐钛矿型TiO2受到能量大于3.2 eV的紫外线激发时,产生光生电子-空穴对,具有强氧化性,将表面吸附的水或OH-氧化成羟基自由基·OH,这一光催化作用可对有机物产生降解,从而广泛应用于污水处理、空气净化、微生物与细菌的分解等[1]。但在光催化时,TiO2存在着电子-空穴复合率高、可见光利用率低以及难以从降解物中分离的缺点,从而制约这一单一的均相催化体系的商业化进程[1]。目前一种较为有效的方法是将磁性核心与TiO2复合,在降解有机物后,可以通过磁性分离技术完成光催化剂与反应体系的有效分离,还可以提高光催化剂的耐久性,从而达到循环利用、环境友好的目的。
Wang等[2]通过湿化学法合成了Fe3O4@SiO2@TiO2复合光催化剂,在氙灯照射下,1 h内可以将5 mg/L的罗丹明B完全降解。利用磁性分离技术完成复合光催化剂的回收处理,循环利用结果表明,经5次循环,其降解率仍可达到85%。Rajesh等[3]在2013年运用层层沉积法制备了Fe3O4@TiO2复合光催化材料,这种材料具有较强的水溶性,可降解易产生环境激素污染问题的两种有机物——苯酚和对苯二酚,经磁性分离5次循环使用测试,其对环境激素降解率仍可达90%。Li等[4]通过乙醇酸铵的水解反应来控制TiO2在Fe2O3表面的沉积速率,制备了新型TiO2-Fe2O3纳米复合材料,该材料在1 h内,对亚甲基蓝、甲基橙降解率分别达到95%和82%,表现出较高的光催化降解能力。
CuFeMnO4是一种在紫外和可见光区都具有较强吸收能力的磁性材料、也具有较高的光吸热性能[5],本研究旨在利用其这一显著特性,制备CuFeMnO4与TiO2磁负载光催化材料,以期提高TiO2的应用效率。
1 实 验
1.1 磁负载光催化材料的制备
1.1.1 CuFeMnO4的制备
利用微乳液烧结法制备CuFeMnO4磁性材料。以分析纯的铁、锰、铜硝酸盐为原料,按照摩尔比4∶5∶3溶解于200 mL去离子水中,再滴入5 mL戊二醛和5 mL吐温80,搅拌,得到A溶液;将100 mL液体石蜡、5 mL span-80与A溶液进行混合、在7 000 r/min条件下剪切乳化5 min,得到均匀的黄绿色乳液B;在40 ℃恒温条件下,将150 mL 3% PVA溶液,2 mL 0.5 mol/L稀盐酸与5 mL OP-10混合,搅拌,制成C溶液;将乳液B缓慢加入C溶液中,在转速200 r/min条件下搅拌,反应生成固体树脂,干燥,在800 ℃下煅烧5 h,得到深棕色的CuFeMnO4粉末。
1.1.2 CuFeMnO4@SiO2的制备
称取0.5 g CuFeMnO4分散于无水乙醇中,超声振荡30 min,滴入3 mL 25%氨水与10.0 mL 去离子水混合,搅拌2 h;缓慢滴加0.5 mL 正硅酸乙酯,恒温40 ℃搅拌10 h。至反应完后采用转速9 000 r/min离心机分离,用蒸馏水和乙醇交替洗涤,干燥,然后500 ℃煅烧3 h,得到CuFeMnO4@SiO2粉末。
1.1.3 CuFeMnO4@SiO2@TiO2的制备
称取0.1 g CuFeMnO4@SiO2粉体分散于无水乙醇中,超声振荡30 min;加入1.6 mL 25%氨水与0.2 g CTAB混合,搅拌2 h;超声振荡条件下缓慢滴入1 mL钛酸丁酯,恒温40 ℃搅拌12 h。至其反应完全后采用转速9 000 r/min离心机分离,用蒸馏水和乙醇交替洗涤,干燥,然后500 ℃煅烧3 h,得到CuFeMnO4@SiO2@TiO2磁负载光催化材料。在光催化实验中CuFeMnO4@TiO2样品由CuFeMnO4未进行SiO2包覆经上述制备过程制得。
1.2 材料表征
采用7000S X射线衍射分析仪(XRD)表征材料的晶相组成;采用JSM-7800F场发射扫描电子显微镜(FE-SEM)观察粉体的表观形貌;采用X-Max 50能谱仪分析粉体微区成分元素种类与含量;采用JEM-2100(UHR)透射电子显微镜观察微观形貌,并通过各种材料晶面间距的差异判断复合材料的包覆效果;采用Spectrum 10红外吸收光谱仪(FT-IR)分析化学键的振动;采用PE Lambda35紫外-可见吸收光谱仪测量粉体在200~800 nm范围内的吸光度,从而评价磁负载对TiO2光催化材料在紫外-可见光区域的吸光度影响;采用Shimadzu UV-1800紫外-可见分光光度计对罗丹明B溶液进行定量分析;采用AMH系列磁滞回线仪测定材料的磁性能,说明其磁性回收的性质。
1.3 光催化实验及磁回收循环降解测试
采用300 W氙灯作为光源,罗丹明B溶液作为目标降解物。取50 mL 5 mg/L罗丹明B溶液,加入0.2 g光催化剂,光催化剂分别选取CuFeMnO4@TiO2、CuFeMnO4@SiO2@TiO2、锐钛矿型TiO2,暗反应30 min达到吸附平衡后,开启氙灯进行光降解实验。每隔1 h抽取5 mL反应液,离心后取上清液用紫外-可见分光光度计测定溶液在波长554 nm处的吸光度。为清除光照下染料自行降解的影响,首先在不加入光催化剂条件下对罗丹明B溶液进行光照实验,样品为空白对照。将光降解后的溶液在外部磁场(50 mm×50 mm×25 mm NdFeB磁体)作用下回收催化剂,待干燥处理后,重复5次光催化实验。
2 结果与讨论
2.1 结构与物相分析
图1为纯CuFeMnO4、CuFeMnO4@SiO2与CuFeMnO4@SiO2@TiO2的XRD谱图。图中CuFeMnO4的XRD图谱与JCPDS卡片20-0358相一致,展现的是立方尖晶石结构的衍射峰。CuFeMnO4@SiO2的XRD谱图中未呈现出SiO2衍射峰,推断SiO2是以耦合的非晶层存在。CuFeMnO4@SiO2@TiO2的XRD谱图与前两者比较,在2θ为25.28°、36.95°、37.80°、38.57°、48.05°、55.06°、62.12°、62.69°位置,呈现出锐钛矿型TiO2衍射峰,证明了复合材料中锐钛矿型TiO2的存在。从图1中CuFeMnO4的衍射峰强度变化可以看出,因CuFeMnO4颗粒表面SiO2、TiO2的包覆,降低了CuFeMnO4衍射峰强度。
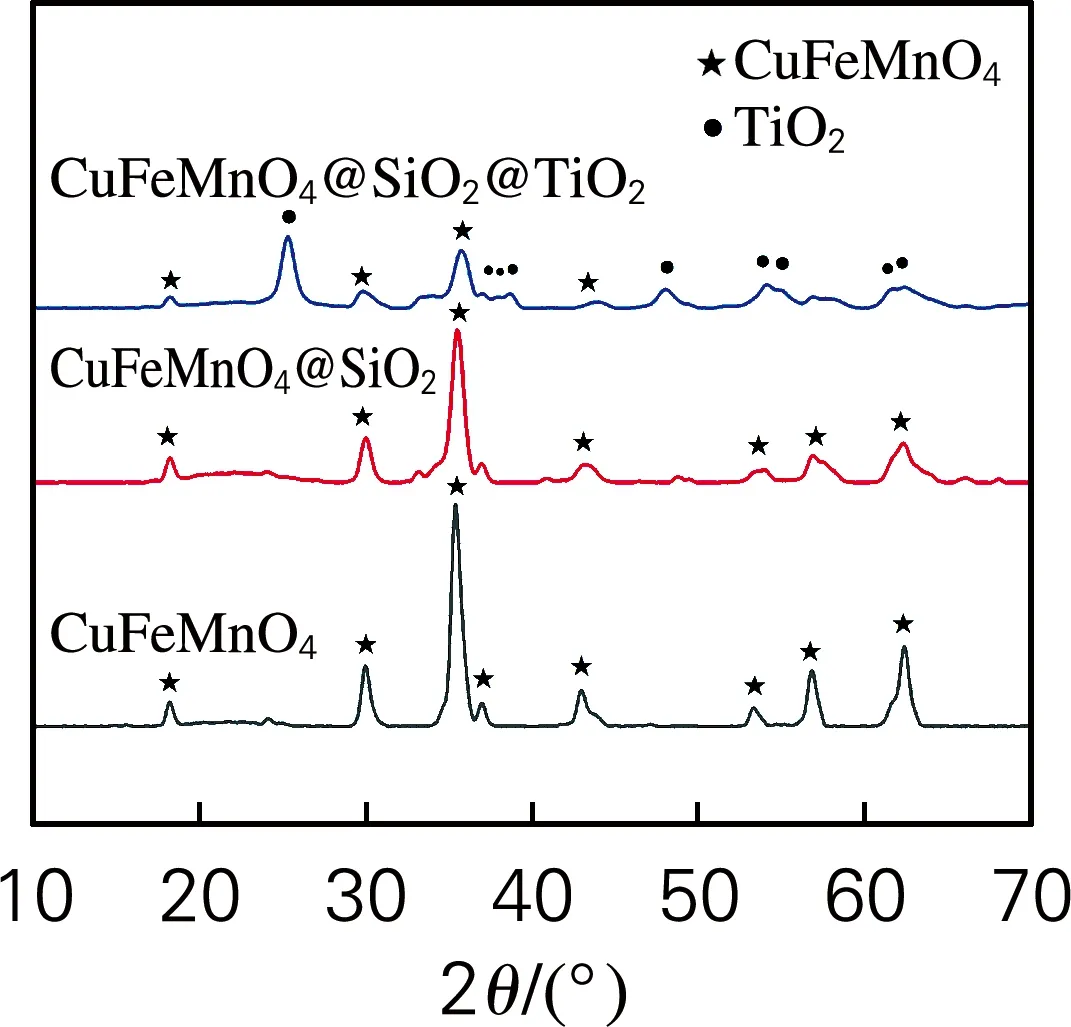
图1 样品的XRD谱图Fig.1 XRD patterns of samples
图2为复合光催化材料的SEM照片,可见CuFeMnO4晶体颗粒呈多边形结构,尺寸分布在50~100 nm,颗粒分散性良好。CuFeMnO4@SiO2因磁性核心CuFeMnO4表面包覆了非晶态的SiO2,使得颗粒从多边形结构变为表面光滑的球形结构,颗粒尺寸略有增加。结合图3中CuFeMnO4@SiO2的EDX能谱分析,检测到材料中除了有Cu、Fe、Mn元素外,硅元素质量分数达到23.63%。进一步对CuFeMnO4@SiO2进行红外吸收光谱分析,如图4所示。发现在799与1 085 cm-1出现了特征吸收峰,分别对应Si—O—Si 的对称振动与Si—O—Si的不对称拉伸[4],表明SiO2纳米粒子可以在CuFeMnO4纳米粒子表面异相成核,但因煅烧温度(500 ℃)低,SiO2以非晶态存在[6],这种非晶态的中间层,有利于降低因晶体包覆对磁性的屏蔽效应,并且可防止磁芯与TiO2半导体直接接触所导致的磁芯光溶解[7]。同时,非晶态中间层表面有很多Si—OH基团,为包覆TiO2提供了反应位点和活性。观察图2(c)发现包覆TiO2后,颗粒尺寸进一步增大至200 nm,表面更加圆滑,而且因钛酸丁酯的水解和缩合导致颗粒之间聚集更加紧密[8],经EDX检测可知Ti元素质量分数为0.81%,如图3(b)所示。从图4(c)的CuFeMnO4@SiO2@TiO2红外光谱观测到源自Ti—O—Ti对称振动在500~900 cm-1产生了特征峰,此外Ti—O—Si共价键的特征峰也在940~960 cm-1被观测到[4],Ti—O—Si 共价键的形成可以使TiO2在颗粒表面包覆更加牢固,但其特征峰不明显主要归因于颗粒表面TiO2量过多[8]。

(a) 纯CuFeMnO4

(a) CuFeMnO4@SiO2
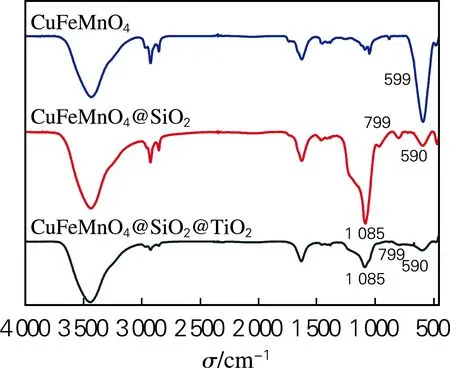
图4 复合光催化剂的FT-IR图Fig.4 FT-IR diagram of composite photocatalysts
对比图5所示的纯CuFeMnO4、CuFeMnO4@SiO2和CuFeMnO4@SiO2@TiO2的TEM照片,可以清晰地观察到CuFeMnO4@SiO2@TiO2磁负载光催化材料中按层分布的3种物质的晶面,经计算其晶面间距分别对应CuFeMnO4(111)、SiO2(033)、锐钛矿TiO2(101),证明了SiO2、TiO2对CuFeMnO4磁性材料的逐层包覆状态,从而形成一种核-壳-壳结构[9]。

(a) 纯CuFeMnO4
2.2 光催化性能分析
通常TiO2的禁带宽度为3.2 eV,只能吸收小于387 nm的紫外光,从图6可以看出,因TiO2形成的是外壳结构,CuFeMnO4@SiO2@TiO2紫外吸收主要由TiO2决定,因此在紫外区的吸光度与TiO2几乎无差别。而可见光透过了TiO2和SiO2壳层被具有较强可见光吸收能力CuFeMnO4核心吸收,使CuFeMnO4@SiO2@TiO2表现出了强于TiO2的可见光吸收能力。
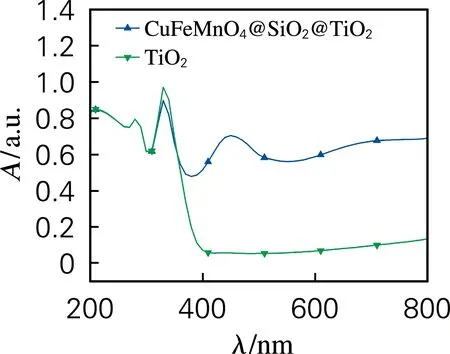
图6 光催化材料的UV-Vis图Fig.6 UV-Vis diagram of photocatalytic materials
图7为光催化剂对RhB溶液的降解曲线,其中未加光催化剂时RhB溶液的吸光度几乎不变,可排除自行降解的影响。CuFeMnO4@SiO2@TiO2磁负载光催化材料经6 h光照后的光降解效率达到88.9%,略低于TiO2的9%,主要因为磁芯的存在一定程度大上增了光生电子与空穴的复合概率[9]。而CuFeMnO4@TiO2的光降解效率只有42.1%,远低于CuFeMnO4@SiO2@TiO2的光降解效率,说明没有SiO2壳层对磁芯光溶解的屏蔽作用,使光生电子与空穴的复合概率大大增加,显著降低了光催化作用[10]。
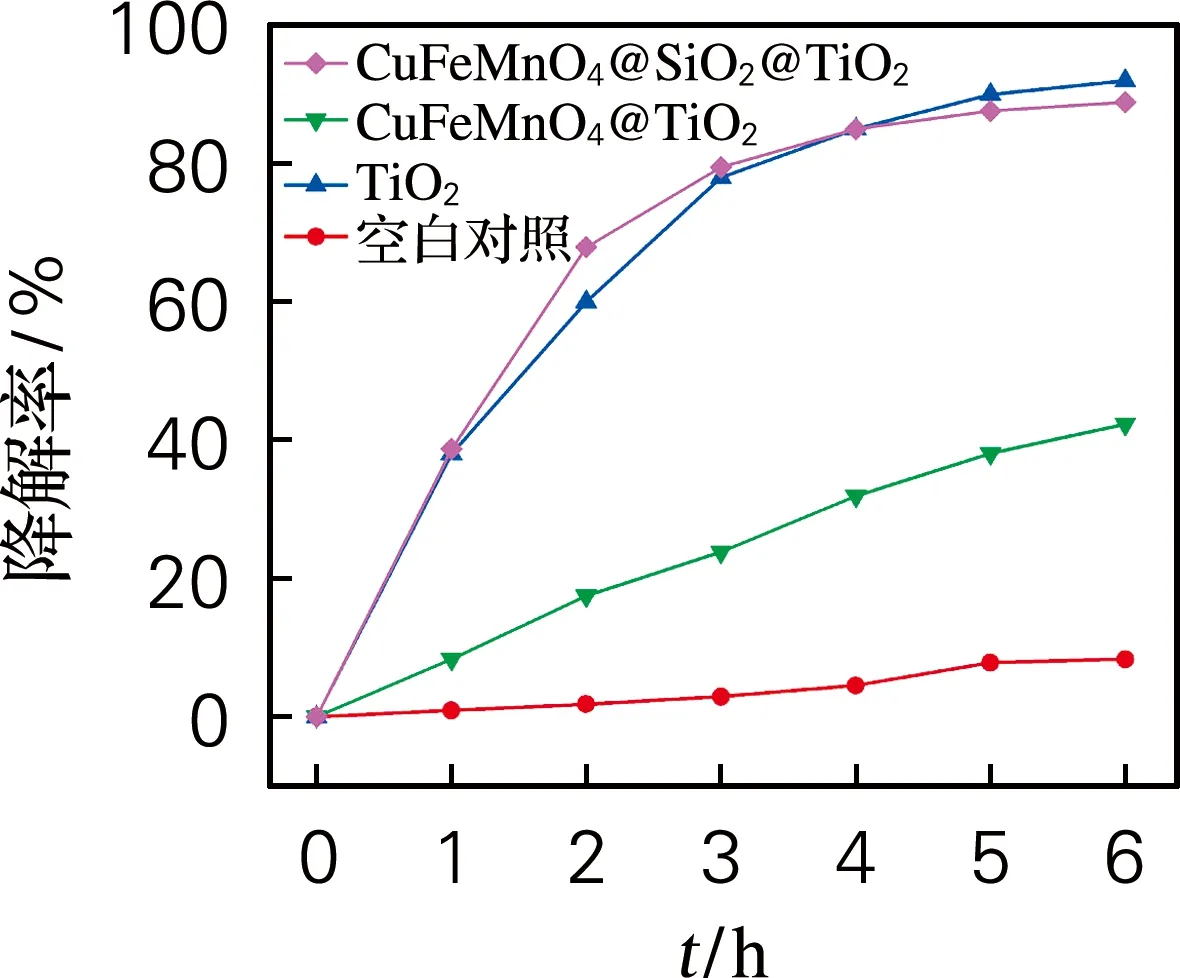
图7 光催化剂对RhB溶液的降解曲线Fig.7 Degradation curves of RhB solution by photocatalyst
就动力学研究而言,纳米复合材料对罗丹明B的光催化分解遵循第一动力学定律,可表示为
ln(c0/c)=kt
式中:c为时间t时的反应物浓度,c0为t=0时的反应物浓度,k为一级速率常数,t为光照时间。
由图8动力学曲线可见ln(c0/c)和照射时间之间呈线性关系。锐钛矿型TiO2,k为0.434 43 h-1;对于CuFeMnO4@TiO2,k较大程度降低至0.094 29 h-1,而CuFeMnO4@SiO2@TiO2纳米复合材料k为0.376 21 h-1,对比单层包覆光催化剂,双层包覆光催化剂的降解效率有了显著的增强[11-12]。
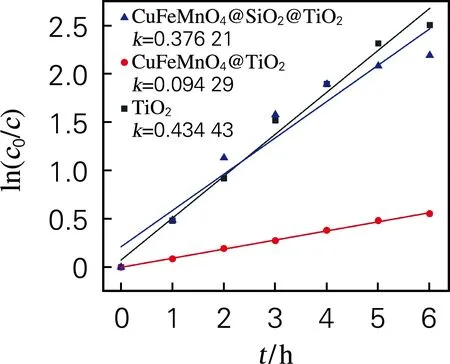
图8 光催化剂对RhB溶液降解动力学曲线Fig.8 Degradation kinetic curves of RhB solution by photocatalyst
2.3 磁回收循环降解测试
由图9可知CuFeMnO4是一种铁磁性材料,因抗磁性壳层SiO2、TiO2的存在[13-14],CuFe-MnO4@SiO2@TiO2的饱和磁化强度较CuFe-MnO4有所降低,并在没有外加磁场存在的条件下,出现了剩余磁化强度。利用这种磁性性能可方便地回收和循环使用[16]。
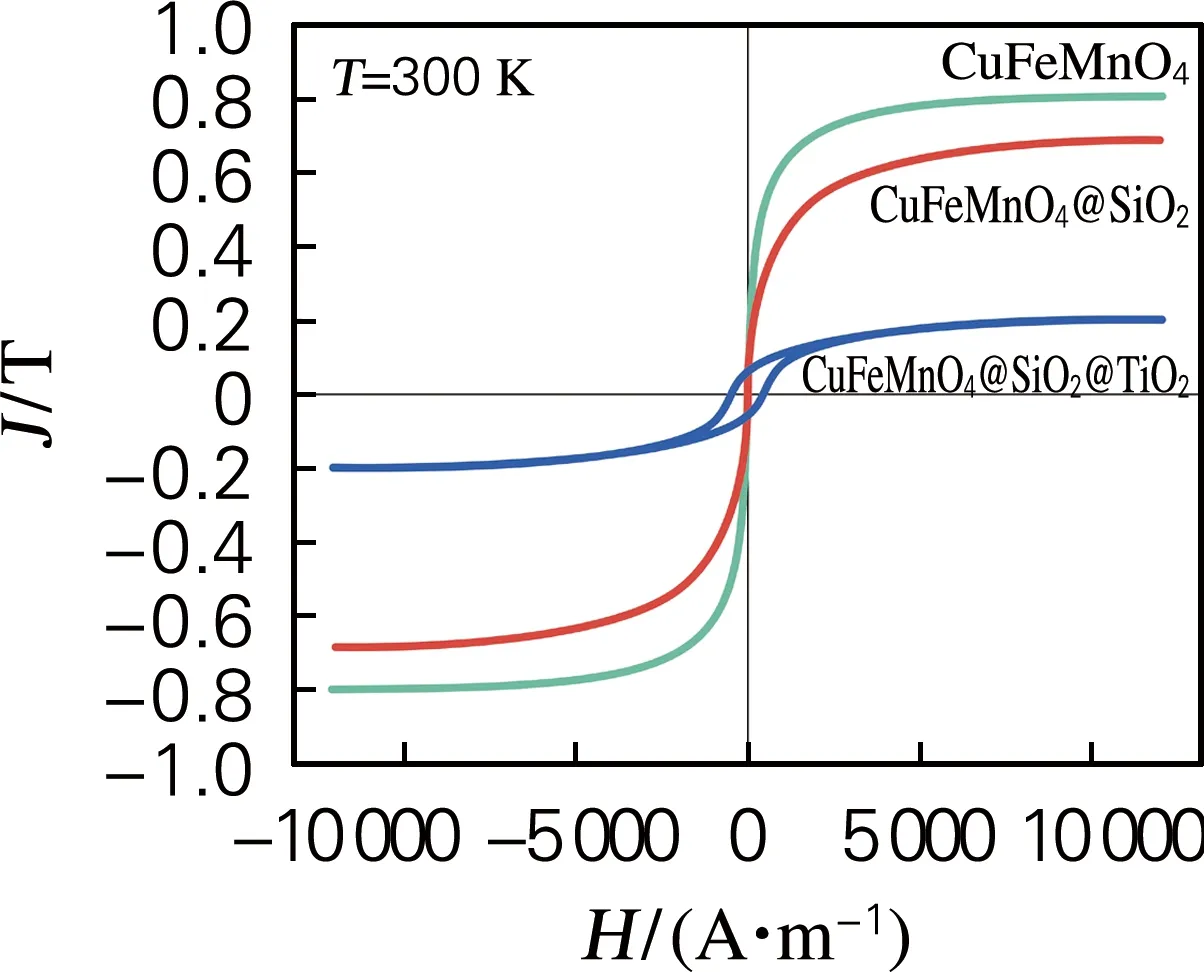
图9 材料的室温磁滞回线Fig.9 Room temperature hysteresis loops of the materials
图10为CuFeMnO4@SiO2@TiO2磁回收循环光降解曲线,经分析得到的光降解效率如图11所示,经5次磁回收降解实验,其光降解效率逐渐降低,但第5次的光降解效率仍能达78.9%。
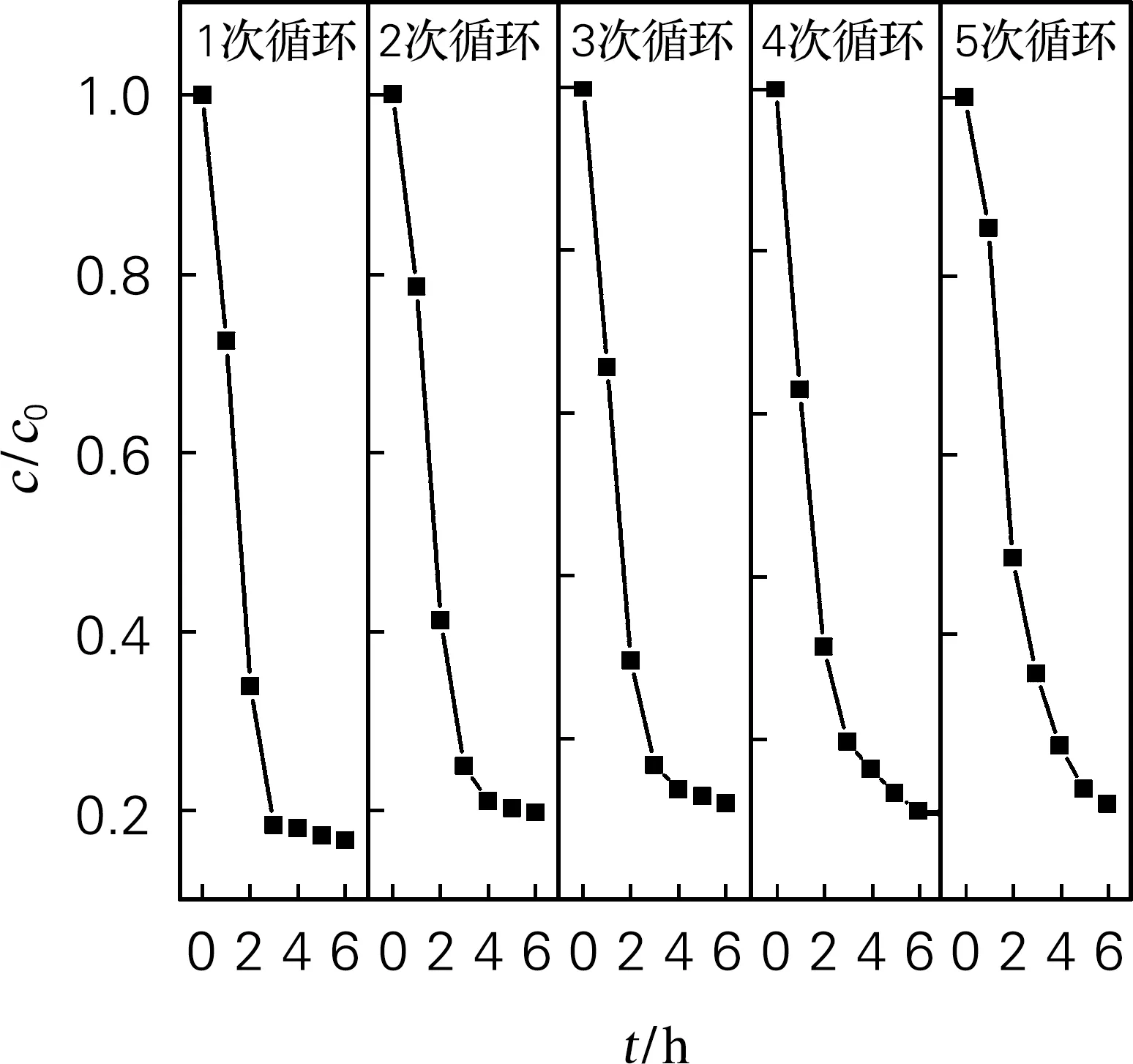
图10 CuFeMnO4@SiO2@TiO2磁回收循环光降解曲线Fig.10 Magnetic recovery cycle photodegradation curves of CuFeMnO4@SiO2@TiO2
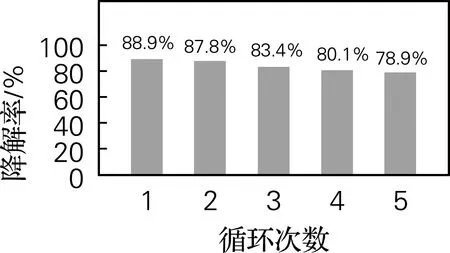
图11 CuFeMnO4@SiO2@TiO2磁回收循环光降解效果图Fig.11 Magnetic recovery cycle photodegradation effect diagram of CuFeMnO4@SiO2@TiO2
3 结 论
通过微乳液煅烧法成功制备了具有高紫外-可见吸收的CuFeMnO4磁性核心材料,再利用层层沉积法合成表面圆滑、具有核-壳-壳结构的CuFeMnO4@SiO2@TiO2磁负载光催化材料,颗粒尺寸从约100 nm增大至200 nm,且颗粒度分布均匀。SiO2中间层的存在屏蔽了CuFeMnO4对TiO2磁芯光溶解的作用,使CuFeMnO4@SiO2@TiO2材料与TiO2对RhB溶液的降解率相当,达到了88.9%。经5次磁回收循环光降解实验,其光催化效率仍能达到78.9%。CuFeMnO4@SiO2@TiO2材料方便的磁回收性能大大提高了TiO2的商业应用前景。
