疲劳运动大鼠骨骼肌代谢组学研究
2021-06-09郭新明吴丽君田俊生
郭新明,吴丽君,孙 卓,向 欢,田俊生
运动作为一种应激源对机体机能会产生重要影响。长时间、中等强度适量运动可促进机体有氧代谢、增强心肺功能、提高机体免疫力。急性大强度或长时间大运动量运动会导致机体氧化还原失衡进而造成机体氧化损伤及肌肉疲劳[1-2],甚至引发各种疾病,如:神经系统疾病、免疫炎症损伤、关节肌肉损伤等[3-5]。
代谢组学(metabonomics/metabolomics)是20世纪90年代末,自人类基因组学、蛋白质组学之后,迅速发展起来的以高通量检测与数据处理为手段、以信息建模与系统整合为目标、以群组指标分析为基础的一门生物学科[6]。可以不预先设定将要检测的具体指标“全景式”扫描所有代谢产物,从而反映药物、环境、运动等外界因素对机体代谢的影响[7-9]。目前,代谢组学技术已经在功能基因组学、生理学、毒理学、疾病诊断、药物疗效与作用机理等方面广泛应用[10]。在体育领域少有学者采用代谢组学方法进行探究。基于疲劳运动对机体产生较大扰动,本研究采用1H-NMR代谢组学技术研究疲劳运动大鼠骨骼肌小分子物质代谢的变化状况,试图从代谢角度阐明疲劳运动对机体机能产生影响的作用途径与机理。
1 材料与方法
1.1 实验对象与分组
20只7周龄健康雄性SD大鼠(体重160~180 g,购自北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)2012-0001)适应性喂养1周后,随机分为对照组C与运动组E(每组10只)。每笼5只分笼饲养,温度为25~28℃,相对湿度为40%~60%,游泳适应训练在(30±2)℃约40 cm的水中进行。
1.2 疲劳模型的建立与判定
疲劳模型参照A.KALANTARⅠ[11]与侯丽娟[12]的大鼠游泳运动方案。实验正式开始前,E组大鼠适应性游泳3天,再分3阶段进行正式游泳训练,每阶段7天共21天。第1阶段:大鼠每天下午自2:30开始游泳100 min;第2阶段:大鼠每天下午自2:30开始游泳3 h;第3阶段:大鼠每天分别于上午8:00,下午2:30开始各游泳3 h。大鼠游泳期间,采用木棒驱使以保证其不停歇地运动。
疲劳判定方法为大鼠游泳时肢体不协调且在10 s内不能上浮至水面进行自主呼吸[12-13]。
1.3 检测方法
1.3.1 试剂与仪器 主要有Brucker600-MHz AVACNCEⅢNMR核磁共振仪(600.13 MHz proton frengnency);可调高速匀浆机;涡旋混合器;高速冷冻离心机;台式真空离心浓缩系统(eppendorf);磷酸盐缓冲液(0.01%的TSP,0.2MOL/L Na2HPO4/NaH2PO4,pH=7.4);甲醇溶液(分析纯≥99.5%)。
1.3.2 骨骼肌样本收集与处理 骨骼肌样本在训练结束后即刻采集。先用生理盐水洗净血液,再用滤纸吸干,用铝箔纸包好后装入密封袋中,于-80℃冰箱中保存、待测。
NMR样本处理:骨骼肌样本经4℃解冻,称量0.2 g置于5 mL EP管中,加入600 mL甲醇与300 mL蒸馏水,在冰上进行匀浆处理。匀浆后再低温离心15 min(13 000 r/min)取上清液500 mL于2 mL EP管内,用真空离心机将样品吹干后加600μL混合磷酸盐缓冲液在超声清洗器作用下复溶,取上清液550μL于5 mm核磁管内4℃保存、待测。
1.3.31H-NMR检测 样本在核磁共振仪上检测,使用配有Bruker 5 mm BBO探头,质子频率为600.13 MHz,光谱为Carr-Purcell-Meiboom-Gil(lCPMG)脉冲序列,自旋弛豫延迟320 ms,64K自由感应衰减数据点在8 KHz谱宽度上共扫描64次。
1.4 数据处理
使用MestReNova软件(version 6.1.0-6224 Mesterlab Research,Santiago de compostella,Spain)对骨骼肌图谱进行处理。使用SⅠMCA-P(version 13.0 Umetric,Sweden)对积分值进行中心化与规格化。然后再进行PLS-DA与OPLS-DA分析,最终结合P值(P<0.01或P<0.05)与V IP值(VI P>1)筛选出差异代谢物。采用SPSS(version 21.0)软件对数据进行独立样本T检验与单因素方差分析对差异物进行统计学比较。
2 研究结果
2.1 NMR数据多元统计分析
对C、E大鼠骨骼肌积分值数据进行PLS-DA有监督模式识别,建立回归模型,模型验证是否成立将决定下一步PLS-DA与OPLS-DA的结果分析是否有意义。为保证实验数据的有效性,首先对建立的PLS-DA模型是否过拟合进行验证,本研究采取200次响应排序检验得到模型验证图1a及验证参数:R2X=0.721,R2Y=0.991,Q2=0.961,参数越接近1表示所建模型可靠性越高。由图1a可见R2与Q2最右侧的点均明显高于其他点,且R2趋势不仅高于Q2并能很好分开,显示本次模型验证参数的解释及预测能力强,且模型验证成立。由图1b可见,两组样本能单独分开,说明疲劳运动的干预使大鼠骨骼肌代谢发生了变化。由图1c可见,3D图中各组所占空间独立区域位置完全分开,说明两组样本数据具有显著性差异。由图1d可见,S-Plots图中远离起点的单个变量V IP值较大,且与其他聚集物有显著区别,说明它可能是潜在的生物标志物。
2.2 1H-NMR检测的差异代谢物指认
结合国际公认数据库Human Metabolome Database(WWW.hmdb.ca)及相关代谢组学文献,从核磁图谱中共指认出18种差异代谢物(见表1),差异代谢物图谱见图2。

图1 大鼠骨骼肌回归模型图Figure1 Rat SkeletalMuscle Regression ModelDiagram
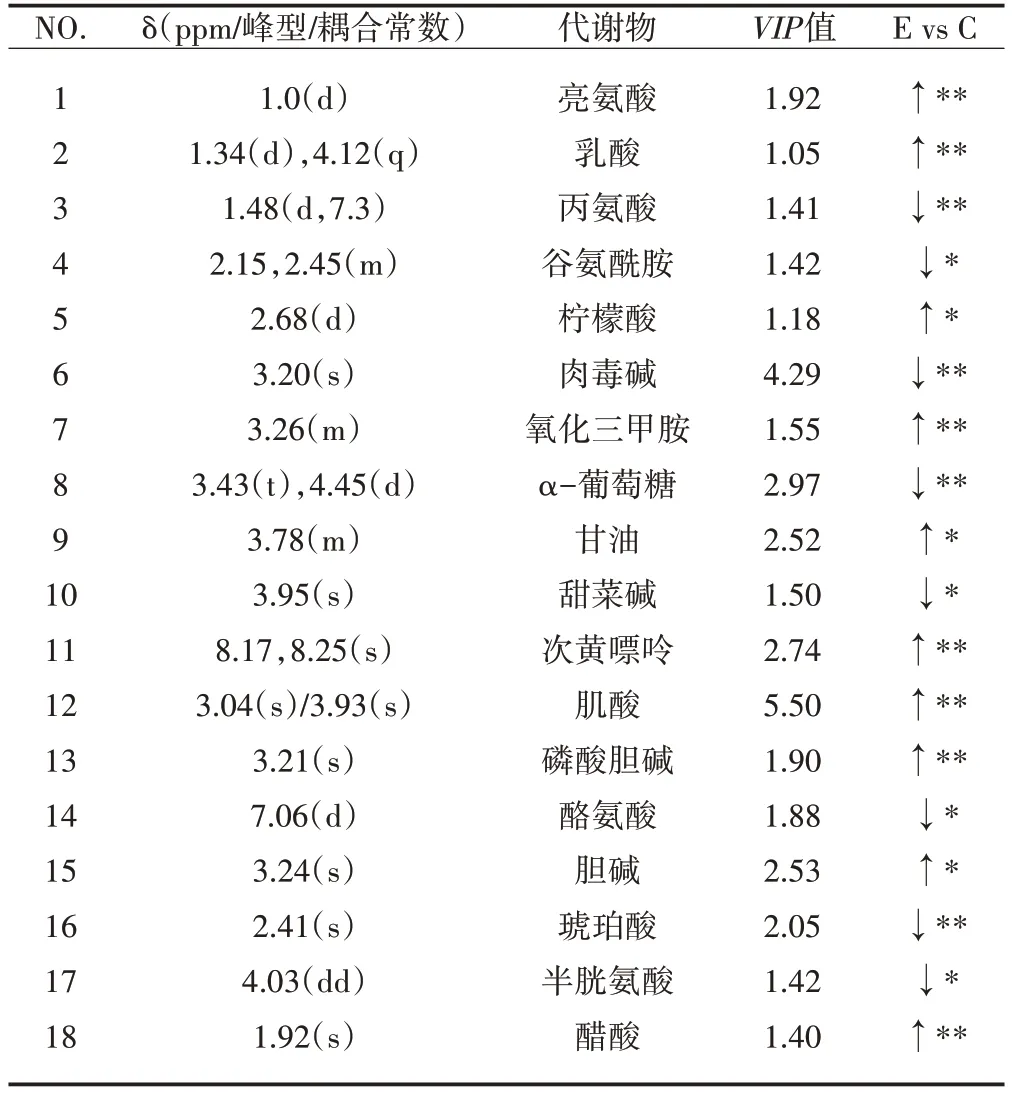
表1 E组与C组差异代谢物及变化趋势(M±S D,n=8)Table1 Different Metabolites and Change Trends of E Group and C Group
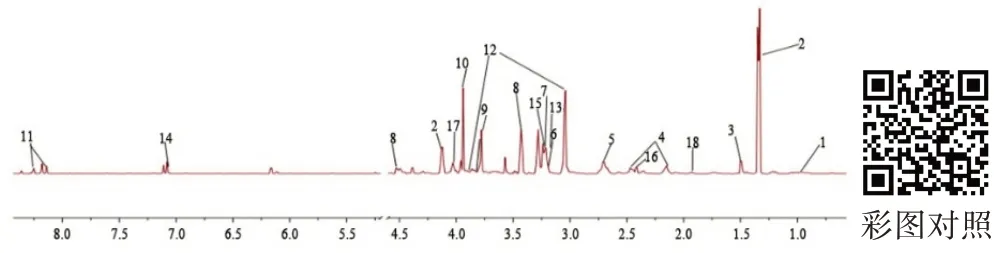
图2 两组大鼠骨骼肌1H-NMR差异代谢物图谱/ppmFigure2 1H-NMR DifferentialMetabolites Map of SkeletalMuscle of Two Groups of Rats/ppm
2.3 两组大鼠骨骼肌差异代谢物变化
疲劳运动后两组大鼠骨骼肌中共有18种差异代谢物:亮氨酸、乳酸、氧化三甲胺、次黄嘌呤、肌酸、磷酸胆碱(P<0.01)、柠檬酸、醋酸、甘油、胆碱(P<0.05)水平显著升高;丙氨酸、肉毒碱、α-葡萄糖、琥珀酸(P<0.01)、谷氨酰胺、甜菜碱、酪氨酸、半胱氨酸(P<0.05)水平显著降低。
2.4 两组大鼠骨骼肌差异代谢物涉及的代谢通路
为明确与运动疲劳相关的代谢通路,先采用KEGG(http://www.genome.jp)和HMDB(http://www.hmdb.ca/)对代谢产物进行分子注释、相关转运酶及参与通路个数进行定量分析(见表2)。再采用MetaboAnalyst 4.0(http://www.metaboanalyst.ca)对本研究两组间差异代谢物进行MetPA分析。将18种差异代谢物数据导入Pathway Analysis进行分析得到图3,两组间18种差异代谢物共涉及30条代谢通路(见表3)。图3中横坐标pathway impact表示由拓扑分析得到的代谢通路的重要性值,纵坐标-logP表示代谢通路富集分析的显著性水平。Pathway impact与-logP值越大,则不同组间代谢差异的相关性越高,圆圈就越大。结合Pathway impact值与P值,筛选出4条P<0.05且impact最高的代谢通路作为本研究潜在的靶标代谢通路。结果显示的4条与运动疲劳明显相关的代谢通路(见图4)分别为:(1)丙氨酸、天冬氨酸和谷氨酸代谢;(2)TCA循环;(3)丙酮酸代谢;(4)苯丙氨酸、酪氨酸和色氨酸代谢。

图3 MetPA数据库构建的相关代谢通路Figure3 Related Metabolic Pathways Constructed by MetPA Database
2.5 疲劳运动对大鼠骨骼肌生物标志物的影响
本研究采用受试者工作特征曲线(ROC)对疲劳运动差异代谢物进行诊断能力评估。ROC曲线下的面积值(AUC)可表示标志物的诊断效果。AUC越接近于1,说明诊断效果越好;在0.9以上时有较高准确性,在0.7~0.9时有一定准确性,AUC在0.5~0.7时有较低准确性,AUC≤0.5时无诊断价值。本研究结合AUC与P(P<0.05)值共筛选出17种差异代谢物,分别是:亮氨酸,乳酸,丙氨酸,谷氨酰胺,柠檬酸,肉毒碱,氧化三甲胺,α-葡萄糖,甘油,次黄嘌呤,肌酸,磷酸胆碱,酪氨酸,胆碱,琥珀酸,醋酸,半胱氨酸;其中参与以上4条疲劳代谢途径的代谢物有丙氨酸(AUC=1.0)、谷氨酰胺(AUC=0.86)、琥珀酸(AUC=1.0)、柠檬酸(AUC=0.83)、乳酸(AUC=1.0)、醋酸(AUC=0.94)、酪氨酸(AUC=0.89)。本研究将这7种代谢物视为影响疲劳代谢的潜在标志物。
3 讨论
代谢组学是近年来生物学领域重要的研究方法之一,从总体代谢物轮廓上进行代谢机制研究,是将分子生物学技术与计算机信息技术相结合的一种重要研究方法。本研究采用代谢组学方法发现疲劳运动可引起大鼠骨骼肌代谢发生差异性改变,差异代谢物共有18种,涉及30条代谢通路,通过代谢途径Met-PA分析,疲劳运动引起大鼠骨骼肌代谢改变与丙氨酸、天冬氨酸和谷氨酸代谢、TCA循环、丙酮酸代谢以及苯丙氨酸、酪氨酸和色氨酸代谢4条靶标代谢通路代谢紊乱有关。

表2 疲劳运动代谢组学差异代谢物基本注释表Table2 Basic Annotation Table of Metabolic Differences in Metabolomics of Fatigue Exercise Group

表3 通过Met PA得到的疲劳代谢差异物通路分析结果Table3 Pathway Analysis Results of Fatigue Metabolic Difference Obtained by MetPA
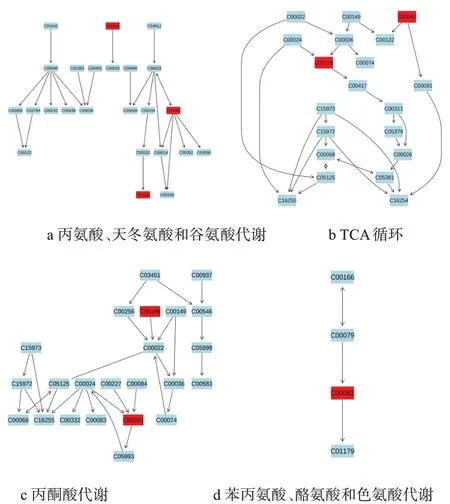
图4 与运动疲劳明显相关的代谢通路Figure 4 Metabolic Pathways Obviously Related to Exercise Fatigue
本研究中差异代谢物丙氨酸(c00041)、谷氨酰胺(c00064)及琥珀酸(c00042)参与了丙氨酸、天冬氨酸和谷氨酸代谢通路(图4a)。在骨骼肌中,丙氨酸(Alanine,Ala)和葡萄糖可通过“丙氨酸-葡萄糖循环”不断在肝脏和肌肉之间转换,将骨骼肌释放的Ala用作肝脏中糖异生的底物[14]。运动训练中补充Ala有利于减轻神经肌肉疲劳、延长力竭时间、改善运动能力[15]。有研究表明递增负荷运动至30分钟Ala水平显即显著降低[16],与本研究结果相似。本研究中疲劳运动后Ala水平显著降低(P<0.01),表明疲劳运动可能引起大鼠骨骼肌中Ala作为糖异生底物被消耗进而影响丙氨酸、天冬氨酸和谷氨酸代谢途径变化。谷氨酰胺(Glutamine,Gln)是体内含量最丰富的氨基酸,在代谢途径中可与上游谷氨酸相互转换,是体内氨代谢的途径之一。同时,Gln还参与机体供能、调节血氨和乳酸水平、合成谷胱甘肽(GSH)、提高机体抗氧化能力和免疫力[17]。K.D.SⅠNGLETON[18]研究表明在进行抗阻训练及耐力运动时,大鼠血浆和组织尤其是骨骼肌中Gln浓度急剧下降。若得不到及时补充肌肉就会发生分解,以满足机体对谷氨酰胺的需求,从而影响肌肉体积,也会由于免疫系统的谷氨酰胺主要来源于骨骼肌的释放导致机体免疫力下降[19]。W.XⅠAO[20]的研究表明过度训练可引起大鼠巨噬细胞功能受损,预先补充谷氨酰胺可以部分逆转这一损伤,进而提高机体免疫力。本研究中大鼠疲劳运动后骨骼肌Gln水平显著降低(P<0.05),这可能是疲劳运动引起机体免疫力降低的原因之一。
三羧酸循环(TCA)是人体有氧供能的基本代谢途径,是三大能源物质糖、脂肪和氨基酸分解代谢的交叉点,TCA循环的中间代谢产物也是许多生物合成途径的起始物质。本研究中琥珀酸(c00042)、柠檬酸(Citric acid,CA)(c00158)参与了此代谢途径(见图4b)。CA通过TCA循环转换为α-酮戊二酸,CA积累的最初阶段并没有阻断TCA循环。延胡索酸与异柠檬酸的减少及草酰乙酸、丙酮酸、CA增加均在CA积累的诱导期间,α-酮戊二酸脱氢酶的减少,可导致琥珀酸、延胡索酸水平降低[21]。CA作为乙酰-CoA进入TCA循环的起始物质,其浓度大小反映着TCA循环代谢水平的高低。S.JOSEPH[22]研究表明,有氧运动大鼠在运动5h后骨骼肌中CA浓度持续累积,与本研究中疲劳大鼠骨骼肌CA水平变化一致。TCA是机体能量代谢的综合反映[23],这些中间代谢产物的变化可引起TCA代谢功能紊乱,本研究中运动组CA水平升高(P<0.05)、琥珀酸水平下降(P<0.01)可能导致TCA代谢紊乱从而导致机体疲劳。在代谢物途径分析中琥珀酸不仅与TCA循环相关也与丙氨酸、天冬氨酸和谷氨酸代谢有关。
本研究中差异代谢物乳酸(c00186)、醋酸(c00033)涉及的代谢途径为丙酮酸代谢(图4c)。代谢途径上游L-乳酸(c00186)、D-乳酸(c00256)以及L-苹果酸(c00149)共同作用生成丙酮酸(c00022);次代谢途径中醋酸由上游物质乙酰辅酶A(c00024)、乙酰磷酸(c00227)及乙醛(c00084)代谢生成。在氧气充足时,骨骼肌、心肌等组织可在乳酸脱氢酶作用下将乳酸直接转化成丙酮酸参与细胞及机体供能。而在缺氧状态下,糖酵解作用增强,丙酮酸在乳酸脱氢酶作用下又转化成乳酸。乳酸在体内堆积会使机体pH下降,从而降低神经系统的调节作用、阻碍ATP合成,导致神经系统兴奋性减弱、肌肉工作能力下降,运动疲劳发生[21]。递增负荷至力竭运动后体内乳酸明显增多[24]。本研究中疲劳运动大鼠骨骼肌中乳酸与醋酸显著升高(P<0.01),表明疲劳运动大鼠骨骼肌乳酸等酸性物质生成速率高于消除率,丙酮酸代谢出现异常。
酪氨酸(Tyrosine,Tyr)是儿茶酚胺(CA)神经递质类物质,也是合成多巴胺(DA)和去甲肾上腺素(NE)的前体。本研究中酪氨酸(c00082)涉及的代谢途径为苯丙氨酸、酪氨酸和色氨酸代谢(图4d)。当CA神经元频繁释放递质时会消耗其储存的递质储备[25]。外源性补充Tyr可防止神经中枢对CA的消耗,且在急性应激条件下Tyr补充可显著改善机体的生理状态及运动能力[26]。此外,有研究表明大脑5-羟色胺(5-HT)和DA都是与疲劳有关的神经递质,即体内较高水平5-HT使运动能力降低、较高水平DA则有利于运动能力的提高[27]。兰晓霞[28]研究显示骨疲劳时实验组DA水平显著低于对照组。CHAOULOFF[29]研究表明脑内DA增加可抑制5-HT合成,而当大脑5-HT/DA比率增大时将引发运动疲劳。脑内多巴胺具有兴奋神经中枢、控制运动肢体协调性及增加运动时间的作用且运动中体内Tyr的变化与DA变化一致[30]。本研究中,疲劳运动后大鼠骨骼肌内Tyr水平明显降低(P<0.05),表明疲劳运动可导致合成DA的前体物质减少从而导致疲劳的发生。
代谢物也可以作为底物对信号通路产生影响,所以下一步的研究可结合相关信号转导通路中蛋白或基因表达等变化,从分子和代谢两个水平探究疲劳运动对特征代谢物和信号转导通路的整体调节作用。
4 结论
本研究采用代谢组学方法与代谢途径分析与对照组相比共筛选出18种差异性代谢物和4条代谢途径。疲劳运动使代谢产物发生差异性变化与运动引起的大鼠骨骼肌丙氨酸、天冬氨酸和谷氨酸代谢、TCA循环、丙酮酸代谢以及苯丙氨酸、酪氨酸和色氨酸代谢途径的变化有关。
