游泳运动对细胞自噬轴诱导生理性心肌肥大形成的影响
2021-06-09齐洁,张波,蒋丽,张钧
齐 洁,张 波,蒋 丽,张 钧
生理性心肌肥大是心肌在细胞、分子层面因受到机械刺激后发生一系列的变化后形成的,表型主要有心脏体积、形态与功能等的改变[1]。有学者[2-4]研究已证实长期规律适宜强度的运动所诱导的心脏肥大对健康人群及心脏疾病患者均具有积极作用,正常健康人群的心脏病患病风险降低,心脏病病人的心功能可得到有效改善。常芸等[5]的研究也早已证实神经-内分泌激素在运动性心脏肥大(exercise-induced cardiachypertrophy,ECH)过程中扮演重要角色。近年来许多学者[6-7]将研究热点关注于自噬在心肌肥厚/心肌重构中的重要作用。此外,马晓雯等[8]通过实验证明了在耐力性运动后心肌自噬的活性增加,但是,在ECH模型中心肌自噬水平与生理性心肌肥大产生的规律及相关机制,仍尚未被完全阐明。
目前,越来越多的研究者开始关注运动训练对于心肌细胞自噬的影响。但鲜有报道系统阐述关于耐力运动训练对心肌细胞自噬及自噬相关基因表达的影响。相关研究表明,自噬的发生是一个动态的过程。这一过程被理解为自噬轴。也有研究[9-11]分析自噬可能成为调控心肌肥厚的靶点。本研究通过建立10周游泳运动诱导的ECH动物模型,观察了ECH中心肌细胞形态与心肌细胞自噬现象的变化,通过实验研究自噬轴中的自噬相关基因LC3B、Beclin1、Atg4B、Atg5、Atg7、Atg12、ULK1、SQSTM1的表达变化,探讨了长期耐力运动对大鼠心肌细胞自噬的影响。而自噬需要精准调控,已有研究[12-13]报道微小RNA(microRNA,miRNA)在不同组织细胞自噬通路调控中扮演着重要角色。本研究我们通过生物信息学预测了在运动性心肌肥大中与自噬相关基因具有靶向调控作用的miRNAs,并验证了相关miRNAs的表达水平,初步确定了长期游泳运动在改变心肌miRNAs表达水平后,通过miRNAs调控自噬而诱导了运动性心肌肥大。为ECH的形成机制提供了依据,也为建立健全运动员心脏的保护机制和心血管疾病人群运动处方的制定提供理论参考。
1 材料与方法
1.1 主要仪器与试剂
主要试剂:ECL发光液购于美国Thermo公司,TRⅠzol、反转录试剂盒及RT-qPCR扩增试剂盒均购自TAKARA公司,兔抗单克隆抗体LC3B、Beclin1、Atg4B、Atg5、Atg7、Atg12、ULK1和SQSTM1等购自美国Cell Signaling Technology(CST)公司,二抗(HRP标记的山羊抗兔和FⅠTC标记的山羊抗兔抗体)也均购自CST公司,PVDF膜购自美国Ⅰnvitrogen公司,DAPⅠ染色剂购自北京索莱宝生物公司,mRNA引物由生工生物工程(上海)股份有限公司设计合成,miRNAs引物由华大基因生物公司设计与合成。
主要仪器:BM-Ⅱ型病理组织包埋机、德国Leica切片机、DHG9000烘烤箱、德国Leica荧光显微镜、美国Bio-Rad电泳仪与转膜槽、Tanon Multi凝胶成像系统、日本OlymPus光学显微镜、日本HⅠTACHⅠ透射电子显微镜、德国Eppendorf低温高速离心机、天根高速组织匀浆机、美国ABⅠ7500 qPCR仪、One Drop*OD-1000超微量紫外分光光度计等。
1.2 实验动物分组及运动性心肌肥大动物建模
健康6周龄雌性Sprague-Dawley大鼠40只,体重(150±20)g(上海斯莱克实验动物有限公司)。大鼠常规分笼饲养(4只/笼),辐照鼠用灭菌饲料(南通特洛菲实验动物饲料有限公司)饲养。室温22~24℃,空气湿度40%~70%,光照时间为12 h/天。大鼠适应性饲养1周后,随机分成对照组(control group,CON组)和运动性心肌肥大模型组(exercise group,EX组),每组20只。分组后再适应性运动1周至雌性大鼠性成熟期(一般为8周龄),此时大鼠情绪较为稳定,之后开始正式建模运动训练。
依据T.G.BEDFORD动物运动训练负荷标准[14],通过参照T.FERNANDES等[15-16]的运动训练方案,建立ECH动物模型。EX组大鼠进行10周无负重游泳运动,游泳运动方案详见下表(见表1)。大鼠游泳运动在150 cm×60 cm×70 cm规格的游泳缸内进行,水温控制在(31±1)℃。

表1 大鼠10周游泳运动方案Table1 A 10-Week Swimming Protocol
1.3 动物取材与样本制备
用10%水合氯醛(40 mg/100 g体重)对大鼠进行腹腔麻醉。迅速打开胸腔,摘取心脏,生理盐水漂洗后、滤干,并称量全心重量。分离左心室后,并称量、记录左心室重量。取心尖处1 mm×1 mm×1 mm大小心肌组织放入2%戊二醛固定液,用于透射电镜检测。切取左心室壁,经多聚甲醛固定后,组织经石蜡包埋、切片后,待用。剩余组织-80℃保存,用于心肌组织RT-qPCR和Western blot实验。
1.4 心肌组织染色
心肌LC3B免疫荧光:常规石蜡切片制片,用柠檬酸钠进行抗原修复,PBS洗涤3次,3 min/次。5%封闭液37℃孵育120 min后,每个待测样品滴加LC3B(1:1 000,CST)40 uL,4℃过夜。次日复温后PBST洗涤3次,10 min/次。荧光二抗Alexa55(51:800)于37℃避光孵育120 min,PBS避光洗涤3次,5 min/次。加入DAPⅠ(1:1 000,北京索莱宝)充分混匀、孵育。PBS洗涤后用抗荧光淬灭封片剂封片,荧光显微镜镜下关观察(绿色荧光为阳性颗粒)。
心肌苏木素-伊红(HE)染色:所取心肌组织在酒精梯度脱水和常规梯度酒精脱水后,依次进行二甲苯透明、浸蜡、石蜡包埋,切片(5μm厚),HE染色,在中性树胶封片后于光学显微镜下观察,并进行图像采集。
1.5 透射电镜观察大鼠心肌超微结构
取大鼠左心室心尖部约1 mm×1 mm×1 mm大小组织块,于4℃戊二醛磷酸缓冲液固定液中,固定24 h。常规脱水、浸透、包埋、染色后制成50 nm左右的超薄切片,透射电镜下观察心肌组织自噬小体及心肌超微结构。
1.6 大鼠心功能检测
游泳运动结束后24 h,大鼠吸入异氟醚麻醉。待大鼠稳定后将其固定,取仰卧位,左心区脱毛。通过使用高分辨率动物超声系统(Visual Sonics Vevo770)对实验大鼠进行超声心动图检测,采集两维超声图像,进行心脏M型超声检测,心脏功能分析检测等。记录:二尖瓣口血流E峰与A峰比值(MV E/A)、室间隔厚度-舒张期(ⅠVS-d)、室间隔厚度-收缩期(ⅠVS-s)、左室舒张末内径(LVⅠD-d)、左室收缩末内径(LVⅠD-s)、左室后壁厚度-舒张期(LVPW-d)、左室后壁厚度-收缩期(LVPW-s)、左室质量(LV mass)、全心指数(HMⅠ)、左室指数(LVMⅠ)、射血分数(EF)、左室缩短分数(FS)、左室容量-舒张期(LV Vol-d)、左室容量-收缩期(LV Vol-s)等指标后,综合评定大鼠心功能。
1.7 Western blot
采用RⅠPA强裂解液提取大鼠心肌组织总蛋白,使用BCA法对心肌组织进行蛋白定量。在10%或12%SDS-PAGE电泳分离后,进行转膜,5%脱脂牛奶室温封闭2 h,而后在TBST洗膜后依次加入1:1 000兔抗大鼠LC3B、Beclin1、Atg4B、Atg5、Atg7、Atg12、ULK1和SQSTM1一抗,室温孵育60 min后置于4℃过夜。次日加入HRP标记的羊抗兔ⅠgG二抗抗体(1:5 000)孵育90 min,再次用TBST洗膜后,进行ECL发光。GAPDH设定为内参。
1.8 RT-qPCR
用TRⅠzol试剂提取心肌总RNA,测定总RNA的浓度与纯度。严格按照TaKaRa反转录试剂盒说明书操作步骤合成cDNA,RT-qPCR法测定心肌ANP、α-actin、α-MHC、β-MHC、SERCA-2α及自噬相关基因LC3和Beclin1的mRNA表达量,内参为GAPDH。RT-qPCR扩增反应条件如下:95℃10 min,1个循环;95℃15 s,60℃30 s,72℃30 s,40个循环;72℃10 min。利用2-△△Ct法计算相对基因表达量。引物由上海生工生物技术公司合成,各基因上下游引物序列见表2。
用TRⅠzol试剂提取心肌总RNA,按microRNA反转录试剂盒(TaKaRa)说明书进行加尾反转录合成cDNA,再以此cDNA为模板进行qPCR反应。引物由华大基因生物工程有限公司合成,U6为内参。反应条件如下:95℃30 s,1个循环;95℃5 s,60℃20 s,39个循环。每个样品重复检测3次。利用2-△△Ct法计算mi RNAs的相对表达量。

表2 基因上下游引物序列Table2 Gene Forward and Reverse Primer Sequences
1.9 数据统计
所有数据均采用SPSS 23.0统计软件进行处理,采用独立样本T检验进行统计学分析。显著性差异选择P<0.05和P<0.01水平。所有数据以均数±标准差表示。
2 实验结果
2.1 运动性心肌肥大动物模型评价
10周游泳运动训练后,从HE染色结果可观察到,CON组大鼠心肌排列整齐、紧密,EX组大鼠心肌纤维明显变粗,排列规律但有间隙,心肌细胞直径显著增加(P<0.05)。

图1 各组大鼠心肌HE染色图(×400)Figure1 HE Staining of Left Ventricle in Rats
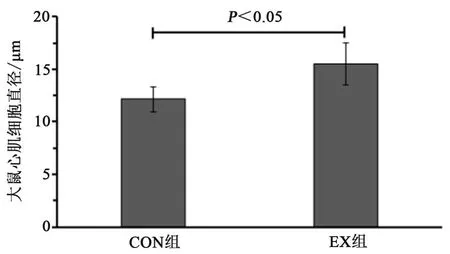
图2 各组大鼠心肌细胞直径比较Figure2 Cooperate with the Myocyte Diameter in Rats in Various Groups
本研究通过心动超声综合评定了运动组大鼠的心功能,表3结果显示,与CON组大鼠比较,EX组大鼠MV E/A比值、LVⅠD-d/s、LVPW-d、HMⅠ和LVⅠM均极显著性提高(P<0.01),LV mass、LV Vol-d、EF和FS均显著上升(P<0.05),提示10周运动后,运动组大鼠心功能显著增强。
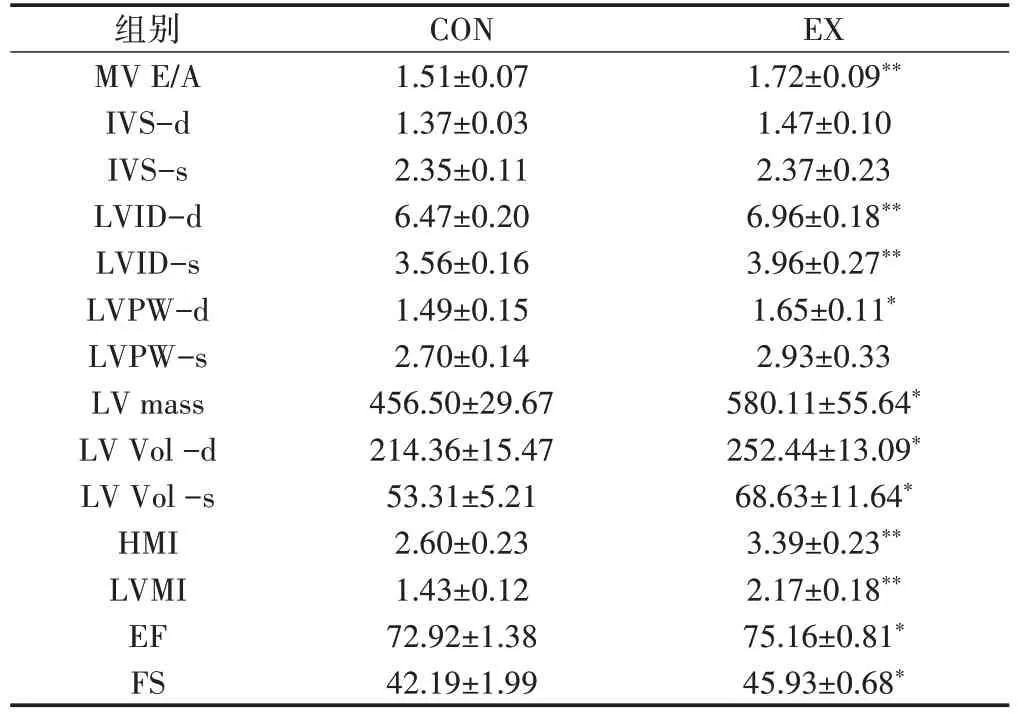
表3 大鼠超声心动指标比较Table3 Comparison of Echocardiography Indicators of Rats
为了排除病理性心脏形成,本研究检测了心肌病理标志物的表达水平。如图3结果所示,10周游泳运动训练后,CON组与EX组大鼠心肌ANP、α-actin、SERCA-2αmRNA的表达量以及α-MHC/β-MHC比值均无显著差异(P>0.05)。
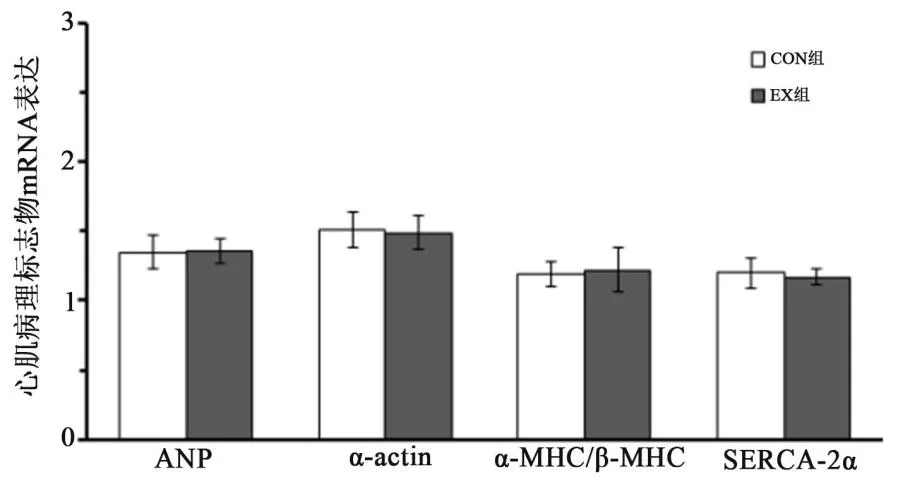
图3 心肌病理性标志物的mRNA表达量Figure3 mRNA Expression of PathologicalMarker in Rats'Left Ventricle
2.2 运动性心肌肥大大鼠心肌自噬变化
透射电镜结果显示,EX组大鼠心肌组织出现典型的双层膜结构,而CON组大鼠心肌排列规律整齐,未观察到有典型的双层结构出现(见图4)。心肌LC3B免疫荧光结果表明,LC3B阳性颗粒呈绿色荧光,DAPⅠ为细胞核标记物,呈蓝色荧光(见图5)。与CON组比较,EX组心肌细胞LC3B阳性颗粒数量显著增加(P<0.01)。RT-qPCR结果所示(见图6、图7),10周游泳运动训练促进了大鼠左心室LC3ⅡmRNA的表达水平,且与CON组相比EX组大鼠心肌LC3Ⅱ/LC3Ⅰ比值显著升高(P<0.01)。同时,10周游泳运动训练也显著提高了大鼠左心室Beclin1 mRNA的表达量(P<0.01)。由Western blot结果可知,10周游泳运动训练后,与CON组相比,EX组大鼠左心室LC3、Beclin1、Atg4B、Atg5、Atg7、Atg12、ULK1蛋白表达水平均显著上调(P<0.01或P<0.05),左心室SQSTM1蛋白表达水平显著下调(P<0.01)。表明ECH大鼠心肌自噬水平增强。

图4 各组大鼠心肌透射电镜图(×15 000)Figure4 Transmission electron microscope of Left Ventricle in Rats to Observe Autophagosome

图5 大鼠心肌LC3B免疫荧光Figure5 LC3B Immunofluorescence in Rats

图6 各组大鼠左心室LC3和Beclin1 mRNA表达水平比较Figure6 mRNA Expression of LC3 and Beclin1 of Rat Left Ventricle in Various Groups
2.3 运动性心肌肥大大鼠左心室miRNAs表达量变化
图8显示了ECH动物模型中具有差异表达的miRNAs,通过生物信息学在线预测软件Targetscan(http://www.targetscan.org)和miRDB(http://mirdb.org/)预测,我们靶定了与自噬相关的miRNAs。结果表明10周游泳训练后,与CON组相比,EX组大鼠左心 室miR-26b-5p(靶 向ULK1)、miR-204-5p(靶 向LC3B)、miR-497-3p(靶 向Atg7)和let-7a-5p(靶 向Atg4B)表达水平均显著下调(P<0.01,P<0.05,P<0.01,P<0.01),而预测靶向作用于自噬受损蛋白SQSTM1的miR-181a-5p表达量发生显著上调(P<0.01)。

图7 各组大鼠左心室自噬相关基因蛋白表达水平的变化Figure7 Protein Expression Changes of Autophagy-related Genes of Rat Left Ventricle in Various Groups

图8 各组大鼠左心室miRNAs表达水平的变化Figure8 miRNAs Expression Changes of Rat Left Ventricle in Various Groups
3 分析与讨论
通过对运动组大鼠左心室壁进行HE染色,结果发现,10周游泳运动训练后,运动组大鼠心肌细胞排列较整齐,大小、分布均匀,心肌细胞核有所增大,肌纤维虽出现少许断裂,但总体结构仍很规律、正常。本研究在设定运动强度时参照了前人[14]研制的动物运动负荷标准,因此大鼠进行60 min游泳运动属于中等强度运动。有学者[15]通过对比与评价2种游泳方案建立的运动性心肌肥大模型,发现本研究中所参考的运动方案比每天一次60 min为期10周的方案所建立的心肌肥大模型表型更明显。且从本研究中运动性心肌肥大组大鼠心肌病理学指标检测结果来看,运动组大鼠心肌并未显示有病理学改变,由此可见,10周中等强度游泳运动可使心肌细胞增大增粗,发生生理性改变,形成运动性心肌肥大。相关研究[17]认为,在一定范围内心肌细胞体积增加的程度与运动强度、运动时间等呈正相关。虽然病理性心肌肥大与生理性心肌肥大的外部表型特征相差甚微,但是病理状态下,心肌细胞内的收缩蛋白α-MHC呈现向β-MHC转化的显著趋势,提示心肌细胞受损。而ECH心肌细胞中的转化则是相反的[18]。本研究通过此种方案建立模型,排除了10周游泳运动导致的病理性心肌肥大,提示10周游泳训练成功建立了运动性心肌肥大动物模型。
细胞自噬,是物种在进化过程中表现出的高度保守的代谢机制。已有研究表明,心肌细胞的自噬水平上调可以由适宜强度的运动训练来实现,不仅可以维持心肌细胞稳态,还可以减少心肌细胞凋亡。当外界刺激(如低氧、机械力等)细胞或细胞处于饥饿条件下时,细胞自噬起始信号被触发。研究发现,ULK1是启动细胞自噬的重要门控开关。哺乳动物同源物Beclin(l酵母Atg6)被磷酸化后从细胞内质网解离、释放,与ⅠⅠⅠ类磷酸肌醇3激酶(classⅢphosphatidylinositol-3-kinases,classⅢPⅠ3K)Vps34相结合,从而形成两个泛素样系统:即Atg12-Atg5和微管相关蛋白Ⅰ轻链3(microtubule-associated proteinⅠlight chain 3,LC3)-磷脂 酰 乙 醇 胺(phosphatidylethanolamine,PE);通 过classⅠⅠⅠPⅠ3K的催化,Atg7与Atg10分别发挥El、E2泛素酶作用,而后促进Atg12与Atg5共价结合,并在招募Atgl6后形成三聚体,结合到自噬前体上,参与自噬小体的扩张;LC3的羧基端被Atg4切割,产生LC3-Ⅰ,在Atg3、Atg7及Atgl6复合体发挥E3泛素连接酶的作用下,LC3-Ⅰ与PE以酰胺键形式,结合形成LC3-PE/LC3-Ⅱ[19-21],继而与自噬小体膜紧密联合,促进形成自噬小体。已有研究[21]表明,LC3-Ⅱ是细胞自噬泡膜的标记物,LC3-Ⅱ的表达水平可直接反映某一时刻自噬激活的程度。由此可见,自噬启动后,其整个过程有Beclin1、Atg4B、Atg5、Atg7、Atg12等这些关键蛋白的参与。
有学者[22]在Atg5-/-小鼠心肌及沉默Atg7-/-基因后发现,心肌细胞自噬水平均显著降低,心肌产生肥大表型。由此可见,自噬异常导致心肌蛋白质和细胞器的异常聚积,可能是导致心肌肥大的重要机制。而运动作为一种机械性刺,可通过影响心肌细胞的自噬活性而平衡运动中或运动后恢复期心肌细胞的代谢。还有研究[23]发现,耐力运动可能会通过阻止小鼠心肌Beclin1-BCl2复合物解离,从而使自噬活性极度减弱。此外,有研究通过5周运动干预发现CHⅠP-/-小鼠由于自噬的代偿性激活(表现为Atg5、Atg7表达水平显著增加,LC3-ⅠⅠ显著上调,自噬活性大幅度提高),使心肌蛋白质质量提高,最终参与抑制了小鼠心肌纤维化的发生发展。提示在ECH中心肌细胞自噬扮演着重要角色,其不仅可以控制正常水平的心肌蛋白质质量,还能够保持心肌细胞正常的结构与生理功能。自噬,能够通过ALP途径清除运动刺激下心肌产生与代谢后异常的蛋白质、自由基等产物[24],将其转换成能源物质(如ATP、氨基酸、游离脂肪酸、核苷酸等),平衡与调节心肌细胞能量代谢,保证心肌蛋白质质量;另一方面,还能够逆转蛋白质合成与降解的失衡,而抑制心肌过度肥大[25-26]。已有研究[27]认为,心肌细胞分化与再生能力有限,自噬可以作为其促进物质循环及细胞自我更新的途径之一。因此,心肌细胞自噬不仅可以维持心脏功能还可以维持心肌细胞活力[28-29]。
Beclin1是最早自定位在自噬前体结构中的自噬相关基因,可调控自噬水平。同时,目前大多数自噬研究所采用的检测是LC3,尤其是LC3Ⅱ表达水平。LC3Ⅰ转化成LC3Ⅱ后,其定位在自噬体膜上,是公认的自噬发生的标志,所以LC3Ⅱ表达水平及LC3Ⅱ/LC3Ⅰ的比值与自噬水平呈正相关。P62又称为SQSTM1,在降解胞浆中错误重叠的蛋白时,p62是自噬过程中底物识别的重要配体蛋白。有研究表明,SQSTM1作为自噬过程中的选择性接头蛋白,也在自噬中发挥了重要作用。SQSTM1在泛素化后可促进自噬活性下降。在正常的自噬过程中,细胞质中SQSTM1蛋白可不断被降解。当自噬活性减弱或在自噬功能缺陷时,SQSTM1蛋白会在细胞质中不断堆积,因此,SQSTM1/p62被认为是自噬活性受损的标记蛋白之一。本研究的结果也证明了:10周中等强度游泳训练使大鼠左心室自噬标记基因Beclin1和LC3Ⅱ表达水平显著上调。ECH模型大鼠左心室自噬相关蛋白ULK1、Atg4B、Atg5、Atg7和Atg12表达水平均显著上调,左心室SQSTM1表达水平显著下调。
微小RNA(microRNA,miRNA)的发现在近来的研究中为阐明和研究ECH的发生机制提供了新的视角。一些研究通过功能获得和缺失的方法进一步确认了miRNA的调控路径,在ECH和病理性心肌肥大心脏模型中,某些miRNA表现出不同的变化趋势,这也为阐释两种不同的心脏肥大调节机制提供了新的证据。miRNA已成为心血管疾病治疗潜在的靶点,应用前景广泛。前期,我们已通过建立ECH动物模型,利用microarray生物芯片分析了运动组大鼠心肌具有表达差异的miRNAs[30]。
自噬过程需要非常精准的调控。已有研究[20-21,31-32]表明,miRNA在不同组织细胞自噬通路调控中具有重要作用。我们通过Targetscan和miRDB在线生物信息学软件预测分析发现:ULK1、SQSTM1、Atg4B、LC3 B、Atg7的3’UTR区可能分别与rno-miR-26b-5p、rno-miR-181a-5p、rno-let-7a-5p、rno-miR-204-5p、rno-miR-497-3p存在结合位点,这些miRNA可能通过作用于其预测靶基因,从而实现miRNA通过自噬调控运动性心肌肥大的功能。本研究结果表明,10周游泳运动训练后,ECH大鼠左心室miR-26b-5p表达量显著下调,其预测靶基因ULK1蛋白表达水平显著上调;miR-181a-5p表达量显著增加,其预测靶基因SQSTM1表达水平显著下降;miR-204-5p、miR-497-3p、let-7a-5p表达量均显著减少,其预测靶基因LC3B、Atg7、Atg4B表达水平均显著提高。该结果与前人在心肌组织的相关研究结果一致[33-34]。提示10周游泳运动可通过调控miRNAs的变化影响自噬而诱导生理性心肌肥大发生。
4 结论
10周耐力游泳运动可诱导生理性心肌肥大形成。运动诱导的生理性心肌肥大使心肌细胞自噬水平显著提高,心肌自噬轴发生显著变化可能是通过miRNAs靶向作用于自噬轴相关基因,实现对心肌细胞自噬水平的调控,从而促进运动诱导的生理性心肌肥大形成。
