强化建模过程的课例研究
2021-06-08李海芳莫宇锋何琳孙可平
李海芳 莫宇锋 何琳 孙可平

摘要:盐类水解是高中化学电解质溶液体系的重要内容之一。其反应机理、规律与应用对学生来说都具有一定的深度和难度,是电解质理论、离子反应及平衡理论的综合运用。通过聚焦盐类水解第1课时“探究盐溶液的酸碱性”,将盐类水解内容及其相关特性进行分析,辨析并建构盐类水解的观念模型,设计盐类水解模型建构的水平进阶教学模式。最后,通过强化模型建构的教学实践促进学生对盐类水解知识体系的深层次理解,获得模型认知能力的发展。
关键词:观念模型建构;盐类水解;建模教学;水平进阶模式
文章编号:1005-6629(2021)04-0054-06 中图分类号:G633.8 文献标识码:B
1引言
模型是对要素之间关系的抽象化表征,具有外显的思想沟通与表达作用,在教学中用于提升学生的科学思考能力。我国在《普通高中化学课程标准(2017年版)》(以下简称“2017版课程标准”)中明确将“模型认知”作为化学学科核心素养的重要组成部分,并要求能根据物质及其变化的信息建构模型,建立解决复杂化学问题的思维框架。在美国,也将模型与建模作为科学教育核心素养的重要构成部分,并认为它可以提升学习者对复杂现象的理解和问题的解决能力。由此可见,科学教育领域对模型及建模的教育功能已达成普遍共识。模型是对一个复杂系统的简化和抽象表示,其目的是用来解释或预测某些科学现象;而建模则是建立模型的动态过程。模型与建模对培养科学认知和思考能力是极为重要的。
化学知识中包含许多由现象、概念、理论、定律等诸多要素及其相互关系构成的复杂体系。一个有效的建模过程不仅可以清晰地表征这个复杂的体系,也能够在建模进程中更深入地理解这个复杂体系的要素和关系。“盐类水解”是高中化学的重要内容,它包含了溶液、电解质、电离、平衡移动等诸多概念和原理。学生在学习该主题时常常倾向于机械记忆水解方程式与规律,却不清楚微观粒子在溶液中的变化过程。换言之,学生无法将实验现象、电解质理论以及水解微观本质联系起来,建立并把握盐类水解的本质观念。
为了解决学生对“盐类水解”观念理解不够深入的问题,我们以“盐类水解”的第1课时“探究盐溶液的酸碱性”教学作为探索对象,通过引导学生逐步建构盐类水解的观念模型,促进他们深入思考,真正理解和掌握盐类水解的本质。
2教学设计分析
盐类水解的本质观念中包含诸多概念及其内在联系。建构盐类水解的观念模型就是将溶液体系中诸多要素的关系简化再抽象地表征出来。本研究从两个方面来考察教学中盐类水解的观念建模。一是从教学内容来看,盐类水解概念从宏观特性发展到微观表征渐近地体现其本质特性;二是从建模过程来看,学生的模型认知水平的进阶特性也显现出来。根据这两方面的分析形成一个凸显盐类水解观念认知建模的教学设计框架。
2.1教学内容分析
“盐类水解”是2017版课程标准主题3中“水溶液中的离子反应与平衡”的组成内容。课标要求通过认识盐类水解的原理和影响盐类水解的主要因素,关注水溶液体系的特点,结合测定溶液pH的实验现象、数据等证据素材,通过微观表征、解释宏观现象等具体任务,了解水溶液中的离子反应与平衡在物质检测、化学反应规律研究以及物质转化中的应用。根据课标要求,“盐类水解”的观念模型可以从三条观念发展线索上构建:一是知识的表征形式,从测定溶液pH等宏观实验现象到粒子问的相互影响与作用的微观表征;二是概念抽象形式,从宏观现象的具象到本质关系的模型抽象;三是“盐类水解”本质的理论发展,从解释现象特征到阐释和预测水解本质的运用(如图1所示)。
从图1的分析可以看出,“盐类水解”观念形成过程是从丰富具体的实验事实中抽取出水解的关键特征,获得概念;并进一步认识这些特征与概念间的关系,形成相关理论;最后,认识盐溶液的本质,形成和把握“盐类水解”的大观念。然而,在高中阶段,“盐类水解”概念却常采用与概念形成相逆的演绎方式进行教学,即理论输入在先,实验验证在后。这种教学设计的目的是,期望通过理论阐释让学生辨别“盐类水解”概念中的盐类物质本身属性、溶入水后微粒相互作用等诸多变量,建立起水溶液体系中核心要素及多变量间的关联,结合对实验现象的分析,能够对溶液行为进行正确的解释和预测。这种教学实施过程中存在的最大问题是,学生的认知逻辑受归纳惯性的影响,錯误地用“果”解释“因”——因为盐水解后溶液显酸(碱)性导致水的电离平衡移动;再有,由于学生对水解相关理论把握不够,对溶液体系的核心要素的认识都是割裂、零散的,以致有效、简明、整体地理解“盐类水解”的本质观念就存在一定难度。
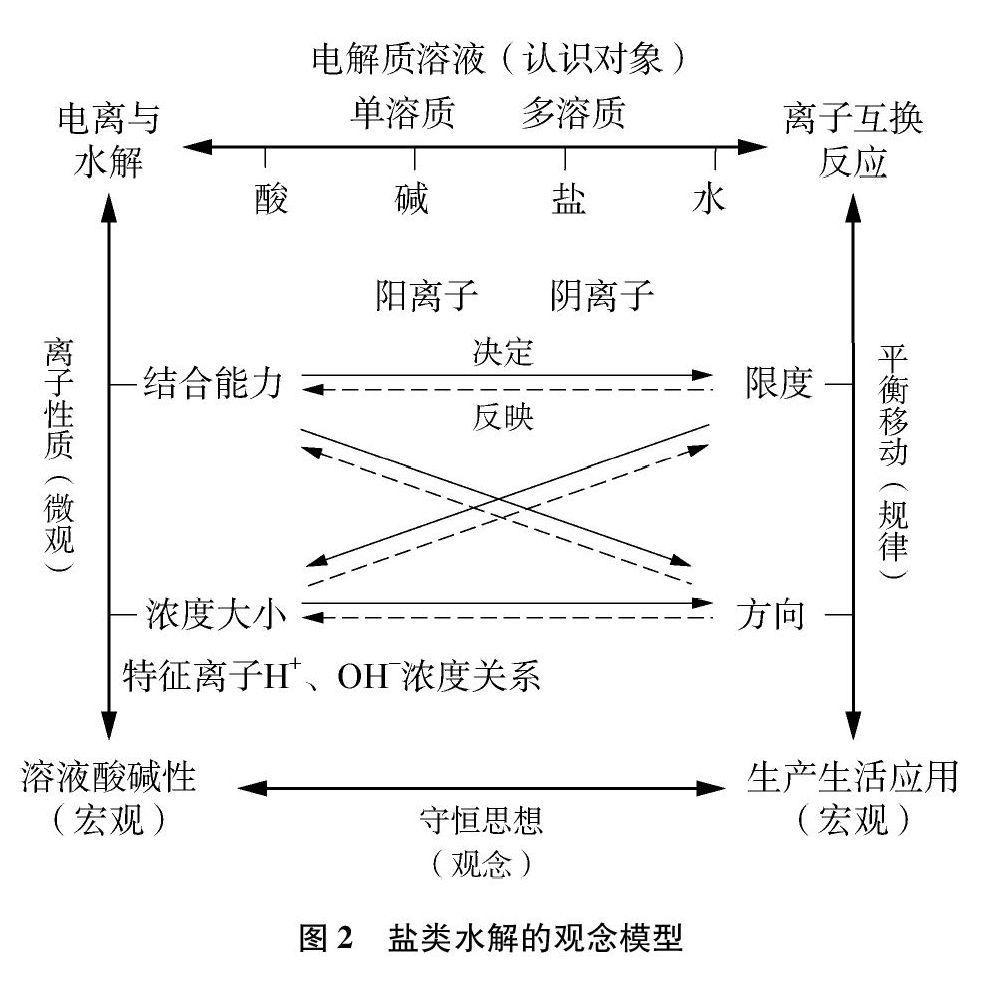
因此,引导学生建立一个清晰的“盐类水解”观念模型是解决以往教学困境的一个重要策略。鉴于电解质电离、盐类水解、离子互换反应都是“物质在水溶液中的行为”,反应机理、规律及应用均涉及溶液酸碱性本质、电解质概念、平衡移动、守恒观念等多个相关核心概念与思想,本研究从电解质溶液、离子性质、平衡移动、守恒思想四个方面人手构建盐类水解的观念模型,如图2所示。
图2的模型中,针对“盐类水解”的认识对象电解质,从三个维度逐渐建构观念模型。一是电解质构成的水溶液体系即水解过程中强弱电解质的溶液特性;二是水解过程中的微粒特性,即离子的结合难易、浓度大小;三是水解溶液的动态特性,即从平衡移动限度、方向,推断溶液中各微粒的行为。所建构的电解质在溶液中相互作用的观念模型,再通过水解溶液酸碱性的实验证据及应用于生产生活实践的例证,使其模型的综合表现显性化。通过这个盐类水解的观念模型,有利于学生表征溶液体系中各要素的关系,在深入认识溶液中可逆反应特性的过程中,进一步形成化学平衡观念。
2.2建模水平进阶分析
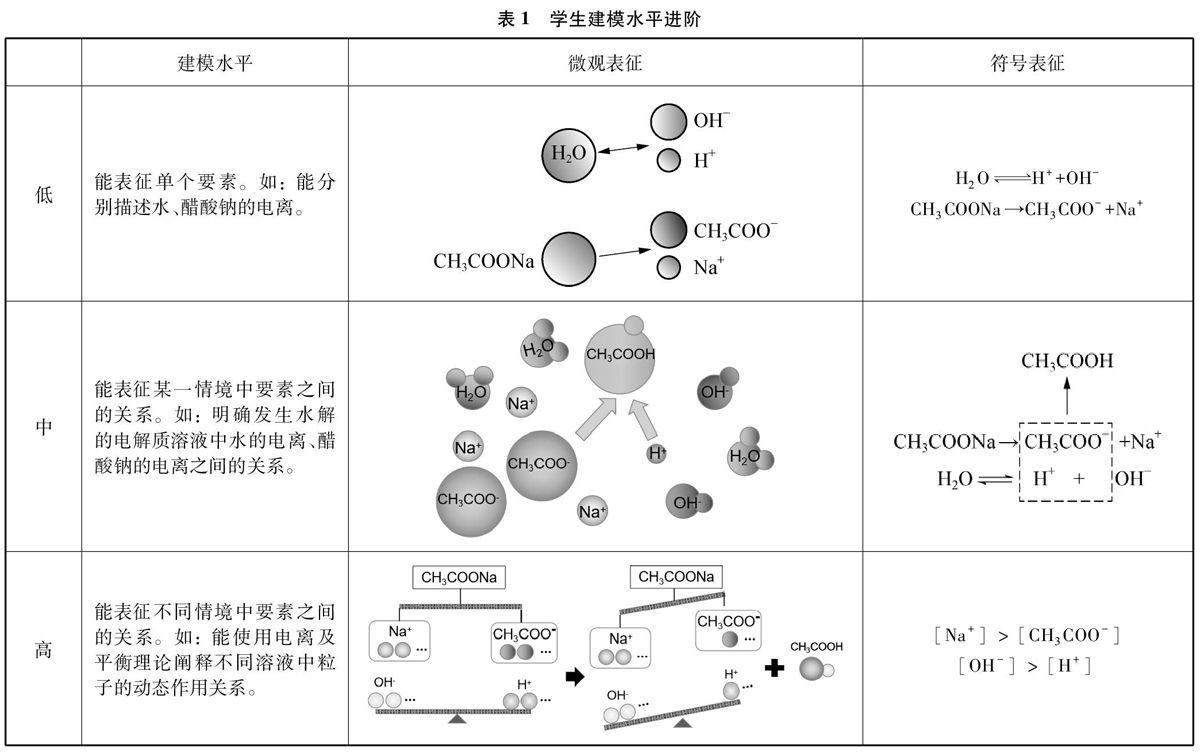
“盐类水解”观念模型的建构过程,本质上讲,是一个从低水平到高水平的认知进阶过程。依据学生的认知水平发展,教学中需要设计一系列有层次的模型建构环节,以便学生逐级地使用适当的表征方式形成一定的模式,解释问题并趋近问题本质。曾有研究者将“模型认知”能力水平用微观表征和符号表征等思维外显方式进行界定。本研究则从“盐类水解”观念模型的特性出发,强调学生模型建构的水平进阶更具可操作性。因此,将建模水平的进阶与表征方式联系起来,以醋酸钠溶液为例,进阶分析如表1所示。
表1中的“低、中、高”三个建模的进阶水平分别是:(1)辨明构成观念模型中的各个概念及其特性;(2)明确有关水解的概念和特性在溶液体系中的关系;(3)使用理论阐释水解在水溶液体系中的关系,形成对盐类水解的本质认识。依据这样的建模的水平进阶,教师可以在教學设计中将建模的认知序列转化为具体的教学环节。
3强化建模过程的教学设计
通过对教学内容、建模水平的分析,在教学设计中需要将“盐类水解”观念模型的发展与学生建模水平的进阶有效地联系起来,引导学生在一系列建构模型的过程中更深入地把握“盐类水解”本质的大观念。为此,要将以学生认识发展为依据的教学环节序列、建模过程和教材中化学知识的表征进阶相协调(如图3所示)。
图3中的建模教学序列中,初构原型环节是指在学生感知“盐类水解”的相关实验基础上,抽取出宏观表征的盐溶液的酸碱特性,初步形成具象的观念模型,即原型(prototype);形成模型环节则是通过分析微粒的特性,引导学生从微观角度探索离子的性质与电解质溶液特性的关系,形成观念模型的轮廓;模型进阶环节是引导学生综合把握电解质溶液中离子的动态变化,根据相关理论预测未知盐溶液的特性,趋近盐类水解观念模型的本质认识。课堂教学中将这三个建模环节按照教学的认知进程逐一展开,将建构模型的活动具体地体现在教师和学生活动中。本案例的教学设计如图4所示。
4强化模型建构的教学实践
强化模型建构的教学实践中,每个环节的教与学活动都要促成学生去辨明构成“盐类水解”观念模型中的各个关键特征和概念,并依据理论去建立它们之间的关系。因此,本节课的教学目标强调:(1)通过测定盐溶液pH实验,能说出盐类水解应具备的条件、特征;(2)通过分析实例,能运用平衡移动原理解释溶液水解行为,构建并完善盐类水解模型;(3)通过探究新情境,能表征盐类水解中离子的复杂行为,形成对水溶液体系的整体认识。这三个主要目标通过四个教学环节加以实现。
[环节1]建模准备
教师:提问1——纯水呈中性的本质原因是什么?
学生:水电离产生的c(H+)=c(OH-)。
教师:提问2——水中加入盐酸、醋酸后呈酸性的本质原因是什么?
学生:盐酸、醋酸都能电离出H+,增大H+浓度,c(H+)>c(OH-)。
学生:学习任务1——写出水、盐酸、醋酸的电离方程式。
教师:投影——水、盐酸、醋酸电离的微观动态图。
设计意图:这个环节的重点是激活学生头脑中有关“盐类水解”的相关概念或特性。在建构盐类水解的观念模型前,引导学生回顾各种关于水、酸溶液、碱溶液的特性和概念,有利于学生建构模型时辨别和思考盐溶液的特性及其关系。展示微观粒子的动态图则提供了表征粒子行为模型的方法,有利于学生分析和理解盐溶液中微粒的行为和关系。
[环节2]初构原型
教师:提问3——NaCl、CH3COONa、NH4Cl分别溶于水后,溶液会显中性吗?
学生:猜测均为中性,理由是未提供H+、OH-。
学生:学习任务2——分组实验测定三种盐溶液的pH,书写电离方程式,讨论盐溶液酸碱性差异的原因。
学生:学习任务3——画出三种盐在溶液中的微观图示,并尝试用符号表征该过程。
教师:提问4——其他盐溶于水后溶液酸碱性会怎样?能找出其中的规律吗?
学生:盐溶液酸碱性差异的本质原因是盐提供的离子与H+、OH-结合生成弱酸、弱碱。
学生:学习任务4——分组实验测定KNO3、Na2CO3FeCl3Al2(SO4)3多种盐溶液的pH,找出盐溶液酸碱性的规律。
设计意图:这个环节强调从宏观现象抽象并形成具象的模型,或者构建原型。通过测定盐溶液酸碱性的实验引发学生的认知冲突,让学生直观地感受盐溶液的酸碱性不同于酸、碱溶液,并在头脑中抽象形成一种描述性的模型雏形。然后,引导学生利用微粒图表示盐溶液中的粒子,初步探索溶液中H+、OH-与盐提供的离子的关系,使学生推断盐溶液中阴、阳离子的相互作用会影响溶液的酸碱性,从而为探索粒子的动态关系作铺垫。
[环节3]形成模型
学生:学习任务5——尝试分析NaCl、CH3COONa、NH4Cl溶液中的离子浓度大小关系。
学生:任务提升,尝试画出对水解概念的理解。
设计意图:这个环节强调引导学生分析和辨别盐类水解体系中的各种变化关系。在明确强弱电解质溶液特性的基础上,通过分析盐溶液中的离子浓度大小关系,根据电离平衡原理推断阴、阳离子的变化,从而明确溶液体系中各类粒子相互作用的关系,形成关系图(如图5所示)。通过鼓励学生分析和表征盐溶液中各要素的关系,使他们体会建构模型的思维操作。
[环节4]模型进阶
教师:学习任务6——推测弱酸弱碱盐CH3COONH4溶液的酸碱性,并通过实验验证。
学生:阴、阳离子均水解生成弱酸、弱碱,可依据各自电离程度的不同,推导出溶液酸碱性。
教师:提问5——如何比较弱酸CH3COOH、弱碱NH3·H2O的电离程度大小?
学生:可查阅弱酸CH3COOH、弱碱NH2·H2O的电离常数,通过比較Ka、Kb的大小,能说明电离程度的差异。
学生:实验验证醋酸铵溶液呈中性。
学生:举一反三,利用电离常数数据,比较同浓度NaF与CH3COONa溶液的碱性强弱,推导出碱性:NaF>CH3COONa。
学生:任务提升,尝试画出NaF、CH3COONa溶液中各离子微观变化图示。
教师:归纳并总结盐类水解的规律。
教师:建议学生绘制“盐类水解”的观念模型图。
教师:(课后)学习任务7——氯化铁在加热时能水解生成氢氧化物胶体。设计实验,探究促进或抑制FeCl3水解的因素。
设计意图:该环节强调引导学生在应用水解模型解决问题过程中对观念模型的整体把握。教师引导学生预测并比较未知盐溶液的酸碱性,使学生对电解质的溶液特性、微粒特性、溶液的动态特性三者之间的关系,即他们观念模型中的关系有一个更“精细化”的认识。然后,让学生在新情境中表征离子间的动态关系,进一步使他们认识到“弱”是电解质水溶液行为的特征即水解过程的本质,进而从整体上把握盐类水解中各要素间的关系即图2所示的观念模型。最后,通过设计探究实验方案诊断学生的认知水平,并为后继学习从水解平衡的限度、方向等角度讨论实际问题中反应条件的选择和优化做好铺垫。
5结论与启示
本研究的教学实践表明,为促进学生建模能力的提升,依据学生已有的理论和认知基础,引导他们利用多种表征逐步地提取模型构成之间的各类要素,使学生在不断明确要素问关系的过程中形成观念模型。与以往使用的演绎式“盐类水解”的教学模式相比,建构观念模型的教学策略更能够使学生把握盐类水解的本质,也更有效地表征理论之间的复杂关系。
强化建模过程的化学教学呈现了以下几个特性:(1)“盐类水解”的观念模型具有简化的特征,有利于学生逐步厘清盐溶液体系中的关键要素并把握其本质;(2)“盐类水解”的观念模型具有抽象化表征的特征,便于教师依据学生表征模型的水平推测他们的思维过程;(3)“盐类水解”的观念模型具有进阶的特征,有助于提高教学设计的有效性。这些特性从我们的课后访谈中略见一斑:问及“在面对NaA、NaB两种未知钠盐溶液时,你如何去比较它们的酸碱性”,大部分学生能快速找到关键特征即“水的电离是关键”,并提及“该离子对应的是弱酸吗、会发生水解吗”“你能告诉我HA、HB的酸性哪个更弱吗”“A-、B-离子与H+结合能力谁强谁弱”等关键要素,进一步做到有效关联。可见,建模教学能够有效促进学生对盐类水解概念的理解,一定程度上提升了学生的模型认知能力。
总之,强化建模的化学教学可以促进表面的“知识点”到“大概念”或者“大观念”的实质性转变;促使学生理解化学事实、概念、理论之间的关系并形成整体性的学科思想,切实地帮助学生获得认识化学世界的重要方法和途径。
