春砂仁内生真菌Letendraea helminthicola A696的次级代谢产物研究
2021-06-07刘洪新刘昭明李赛妮陈玉婵章卫民郭波红
张 捷,刘洪新,刘昭明,李赛妮,陈玉婵,章卫民*,郭波红
1广东药科大学药学院,广州 510006;2广东省科学院微生物研究所 省部共建华南应用微生物国家重点实验室广东省菌种保藏与应用重点实验室 广东省微生物应用新技术公共实验室,广州 510070
中药砂仁属于姜科(Zingiberaceae)植物成熟的果实,广泛分布于中国南方地区,老挝、越南、柬埔寨、泰国。以广东省阳春市所产的阳春砂仁最为有名,春砂仁具有化湿和胃,理气安胎等功效[1-3]。寄生于春砂仁根部内生真菌也成为发现结构新颖及活性显著的研究对象,植物内生真菌是寄居在植物组织与植物共生的真菌种类[4],植物内生真菌具有丰富的物种多样性,能产生结构新颖复杂、活性多样的次生代谢产物,因此已成为发现新天然活性物质的重要资源[5]。真菌Letendraeahelminthicola属于稀缺的种属[6],有研究报道[7,8]表明与海绵相关的该种属真菌产生了两个具有污水防治作用的化合物3-methyl-N-(2-phenylethyl) butanamide和cyclo(D-Pro-D-Phe);Huang等[9]报道了从海蟹肠道真菌Letendraeasp.分离到两个新的含有苯二氢比喃环和四氢呋喃环骨架的螺环聚酮立体异构体letenketals A和B,经过抗菌和抗肿瘤活性测试显示几乎没有抗菌活性,在40 μM时有较弱的抗肿瘤作用;Xu等[10]从海洋来源的真菌Letendraeasp.5XNZ4-2中分离得到七个新的聚酮类化合物,分别是phomopsiketones D~G和letendronols A~C,其中phomopsiketone E显示较弱的抑制脂多糖活化巨噬细胞中一氧化氮的产生的活性。本课题组以从春砂仁中分离得到的一株内生真菌LetendraeahelminthicolaA696为研究对象,对其化学成分及抗肿瘤和抗菌活性进行研究。
1 材料与方法
1.1 实验仪器
核磁共振波谱仪(AVANCE Ⅲ型400 MHz或AVANCE Ⅲ型600 MHz,瑞士Brucker公司);液质联用仪(12900-6430A三重四级杆型,美国Agilent Technologies公司);高效液相色谱仪(LC 3000制备型,北京创新通恒科技有限公司);高效液相色谱仪(LC-20A半制备型,日本岛津公司);YMC-pack ODS-AQ制备柱(250 mm × 20 mm,5 μm);YMC-pack ODS-AQ半制备柱(250 mm × 10 mm,5 μm)(日本YMC公司);旋转蒸发仪(OSB-2100型,日本东京理化器械株式会社);大容量普通摇床(PZ1000B旋转式,武汉瑞华仪器设备有限公司);Sephadexdex LH-20(18~110 μm,瑞典Amersham Bioscience公司);C18反相硅胶(40~75 μm,日本富士硅化学株式会社);柱色谱硅胶(100~200、200~300目,山东青岛海洋化工厂);薄层层析硅胶板(GF254,德国 Merck公司);石油醚、乙酸乙酯、正己烷、二氯甲烷、甲醇(分析纯,广州化学试剂厂);甲醇、乙腈、正己烷、异丙醇(色谱纯,美国BCR公司)。
1.2 实验材料
春砂仁内生真菌A696于2016年4月自广东省阳春市马水镇采集的春砂仁根分离得到,春砂仁由广东药科大学严寒静教授鉴定为Amomumvillosum。将分离得到的菌株通过液氮冻融法提取菌株的基因组DNA,采用引物ITS1和ITS4扩增其rDNA ITS区,并对产物进行测序,测序结果提交GenBank,登录号为KU529827,通过BLAST(核苷酸序列比对程序)进行序列比对,结果显示该菌株与LetendraeahelminthicolaB1A0062SNA2CC1081(GenBank号:KP263123)的序列相似度为100%,因此该菌株被鉴定为Letendraeahelminthicola,菌株保藏于广东省科学院微生物研究所。
1.3 发酵培养
1.3.1 培养基
发酵培养基为马铃薯葡萄糖液体培养基(PDB):马铃薯 200 g/L、葡萄糖 2%、KH2PO40.3%、MgSO4·7H2O 0.15%、VitB110 mg/L、海盐 0.3%。
1.3.2 发酵条件
在无菌条件下,将活化后的菌株接种至装有250 mL马铃薯葡萄糖培养基的500 mL三角瓶中,在28 ℃、120 rpm条件下振荡培养5天,获得种子液。将适量种子液转接到装有1.5 L马铃薯葡萄糖培养液的3 L三角瓶中,在相同条件下培养20天,共发酵55 L。
1.4 分离纯化
将A696菌株发酵液经多层纱布过滤,分别得到滤液和菌丝体。用等体积的乙酸乙酯萃取滤液3次,再减压回收溶剂后得浸膏7.5 g。浸膏经硅胶柱层析(100~200目),以石油醚-乙酸乙酯,体积比1∶0→1∶3梯度洗脱,并用薄层色谱(TLC)检测,合并相似组分,得到7个粗组分Fr.1~7。Fr.1经正相硅胶柱层析(正己烷-乙酸乙酯,体积比20∶1→5∶1)得到Fr.1.2,Fr.1.2通过Ace 5 C18PFP半制备柱(乙腈-水,体积比7∶1,2.0 mL/min)到化合物2(2.2 mg)。Fr.3经硅胶柱层析(正己烷-乙酸乙酯,10∶1→3∶1)得到Fr.3.1,Fr.3.1通过Ace 5 C18PFP半制备柱(乙腈-水,体积比60∶40,2.0 mL/min)得到化合物3(1.2 mg)。Fr.5组分通过硅胶柱正相柱层析(正己烷-乙酸乙酯,体积比10∶1→1∶1)得到Fr.5.1、Fr.5.2和Fr.5.3。Fr.5.1通过Sephadex LH-20纯化得到化合物8(3.5 mg);Fr.5.2通过半制备柱(正己烷/异丙醇,体积比5∶1,2.0 mL/min)得到化合物6(2.4 mg);Fr.5.3通过C18半制备柱(甲醇-水,体积比45∶55,2.0 mL/min)分别得到化合物5(1.8 mg),化合物4(1.2 mg),化合物7(1.5 mg)。Fr.7经正相硅胶柱层析(正己烷-乙酸乙酯,体积比5∶1→1∶3)得到Fr.7.2;Fr.7.2通过Schiral A半制备柱(正己烷-异丙醇,体积比5∶1,2.0 mL/min)得到Fr.7.2.1。Fr.7.2.1经Sephadex LH-20柱纯化后得到化合物1(3.1 mg)。
2 实验结果
2.1 结构鉴定

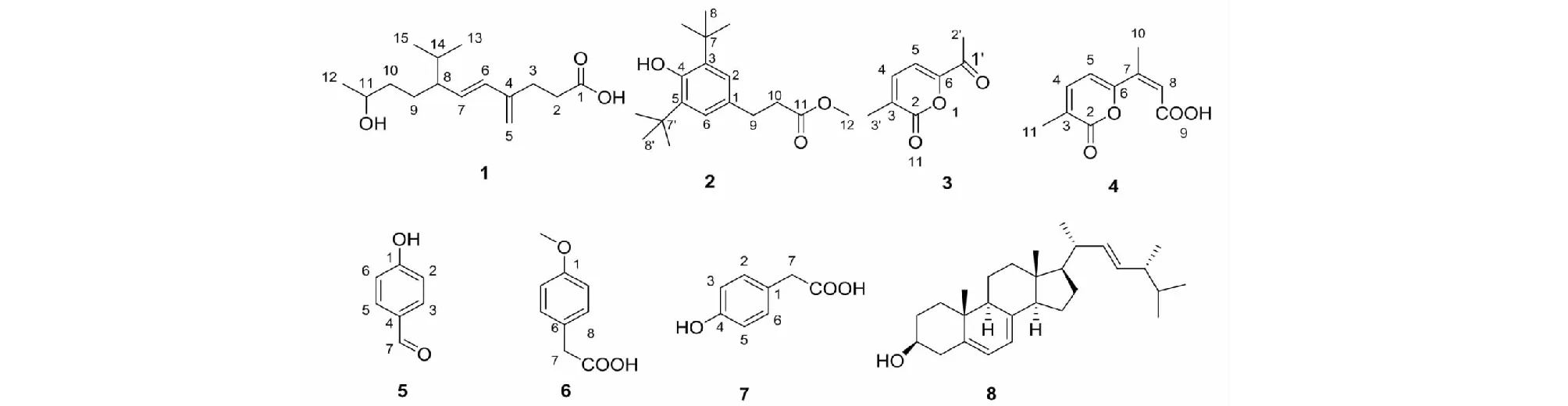
图1 化合物1~8的结构式Fig.1 Structures of compounds 1-8

表1 化合物1的1H NMR和13C NMR数据(CD3OD)

续表1(Continued Tab.1)

图2 化合物1的1H-1H COSY and HMBC的主要相关Fig.2 Key 1H-1H COSY and HMBC correlations of compound 1
化合物2棕色油状物;ESI-MS:m/z291.3 [M-H]-,分子式C18H28O3。1H NMR(600 MHz,CDCl3)δ:6.84(2H,s,H-2,6),1.42(18H,s,H-8,8′),2.87(2H,m,H-9),2.61(2H,m,H-10),3.69(3H,s,H-12);13C NMR(150 MHz,CDCl3)δ:151.9(C-4),135.8(C-3),131.1(C-1),124.4(C-2,6),34.2(C-7,7′),30.9(C-8,8′),36.3(C-9),30.9(C-10),51.5(C-12),173.6(C-10)。以上数据与文献[12]报道基本一致,故鉴定化合物2为3-(2,6-二叔丁基-4-羟基苯基)丙酸甲酯。
化合物3黄色油状物;ESI-MS:m/z175 [M + Na]+,分子式C8H8O3。1H NMR(600 MHz,CDCl3)δ:7.23(1H,dq,J=6.7,1.4 Hz,H-4),6.93(1H,d,J=6.7 Hz,H-5),2.46(3H,s,H3-2′),2.14(3H,s,H3-3′);13C NMR(150 MHz,CDCl3)δ:161.3(C-2),137.8(C-3),138.0(C-4),107.3(C-5),153.0(C-6),191.4(C-1′),25.6(C-2′)17.5(C-3′)。以上数据与文献[13]对照基本一致,故鉴定化合物3为gibepyrone F。
化合物4无色油状物;1H NMR(600 MHz,CD3OD)δ:7.41(1H,dt,J=7.1,1.1 Hz),6.71(1H,d,J=7.0 Hz),6.61(1H,s,H-8),2.36(3H,s,H-7),2.11(3H,s,H-3);13C NMR(150 MHz,CD3OD)δ:172.02(C-9),166.78(C-2),161.06(C-6),146.06(C-7),143.79(C-4),130.55(C-3),122.60(C-8),109.76(C-5),19.23(3-CH3),16.09(7-CH3)。上述数据与文献[14]对照基本一致,故鉴定化合物4为gibepyrone D。
化合物5白色粉末;分子式C7H6O4。1H NMR(600 MHz,CD3OD)δ:9.78 (1H,s,H-7),7.79(2H,d,J=8.6 Hz,H-2,5),6.93(2H,d,J=8.6 Hz,2H,H-3,5);13C NMR(150 MHz,CD3OD)δ:192.8(C-7),165.2(C-4),133.4(C-2,6),130.3(C-1),116.9(C-3,5)。以上数据与文献报道[15]基本一致,将鉴定化合物5为对羟基苯甲醛。
化合物6白色粉末;ESI-MS:165 [M-H]-,分子式C9H10O3。1H NMR(600 MHz,CD3OD)δ:7.14(2H,d,J=8.4 Hz,H-2,6),6.77(2H,d,8.4 Hz,H-3,5),3.69(3H,s,OMe),3.55(2H,s,H-7);13C NMR(150 MHz,CD3OD)δ:172.8(C-8),155.1(C-4),130.8(C-1),126.4(C-2,6),115.8(C-3,5),52.4(OMe),40.6(C-7)。以上数据与文献报道[16]一致,将化合物6鉴定为对甲氧基苯乙酸。
化合物7白色粉末;ESI-MS:m/z175.1 [M+Na]+,分子式为C8H8O3。1H NMR(600 MHz,CD3OD)δ:3.55(2H,s,H-7),7.09(2H,m,H-2,6),6.74(2H,t,J=7.5,H-3,5);13C NMR(150 MHz,CD3OD)δ:176.2(C-8),156.6(C-4),131.9(C-2),129.0(C-6),122.7(C-1),120.2(C-3),115.8(C-5),36.5(C-7)。以上数据与文献[17]报道一致,故鉴定化合物7为间羟基苯乙酸。
化合物8棕色固体物质;ESI-MS:m/z395.1 [M-H]-,分子式为C28H44O。1H NMR(400 MHz,CDCl3)δ:0.62(3H,s,H3-18),0.83(6H,d,J=6.4 Hz,H3-26,H3-27),0.9(3H,d,J=6.9 Hz,H3-28),0.94(3H,s,H3-19),1.03(3H,d,J=6.7 Hz,H3-21),3.63(1H,m,H-3),5.19(2H,dd,J=9.2,7.1Hz,H-22/H-23),5.38(1H,m,H-7),5.57(1H,m,H-6);13C NMR(100 MHz,CDCl3)δ:12.2(C-18),16.4(C-19),17.8(C-28),19.8(C-21),20.1(C-26),21.2(C-11,C-15),23.1(C-27),28.4(C-12),32.1(C-2),33.2(C-25),37.1(C-10),38.5(C-1),39.2(C-16),40.6(C-20),40.9(C-4),42.9(C-24,C-13),46.3(C-9),54.7(C-14),55.8(C-17),70.6(C-3),116.4(C-7),119.7(C-6),132.1(C-23),135.7(C-22),139.9(C-8),141.5(C-5)。以上数据与文献[18]报道的基本一致,故鉴定化合物8为麦角甾醇。
2.2 细胞毒和抗菌活性测试
采取SRB法[19]测试化合物1~5对四种肿瘤细胞株包括人神经癌细胞(SF-268)、人乳腺癌细胞(MCF-7)、人肝癌细胞(HepG-2)和人肺癌细胞株(A594)的细胞毒活性,结果显示:化合物1~5在100 μg/mL下对四种肿瘤细胞株的增殖抑制率均在20%以下,阳性对照为顺铂(IC50:3.20 μM),表明无细胞毒活性。
采用微量稀释法[20]测定化合物1~5对铜绿假单胞杆菌CMCC10104(Pseudomonasaeruginosa)、大肠杆菌CMCC44102(Escherichiacoli)、金黄色葡萄球菌CMCC26003(Staphylococcusaureus)和枯草芽孢杆菌CMCC63501(Bacillussubtilis)的抗菌活性,结果显示化合物1~5在浓度为100 μg/mL时对上述受试菌的抑制率低于40%,阳性对照为氨苄西林(MIC:1 μg/mL),表明化合物1~5无抗菌活性。
3 讨论与结论
真菌Letendraeahelminthicola属于稀缺的微生物种属,本文是关于该属真菌关于次级代谢产物的第四次报道,该属真菌产生过二酮哌嗪类、螺环聚酮类化合物[7-10],本研究从春砂仁内生真菌A696发酵液中分离得到8个单体化合物,丰富了该属真菌的次级代谢产物类型,其中化合物1为新的倍半萜类化合物;化合物2是一种抗氧化剂,也是合成抗氧化剂1076和1010等的主要原料;化合物3和4均为α-吡喃酮结构化合物,化合物3被报道是首次从天然产物中分到的α-吡喃酮结构,通常以gibepyrone B为原料进行合成;化合物5、6、7均为芳香苯环小分子化合物;化合物8为麦角甾醇,在医药化学上已经得到应用,已经做为维生素D2的前体,也是生产激素类药物中间体。该菌的粗提物显示一定的抗菌抗肿瘤活性,但化合物1通过活性测试发现没有抗菌和抗肿瘤活性,很可能是一些具有抗菌抗肿瘤活性次级代谢产物并没有从粗提物中成功分离到。因此,可以从发酵产物量上进行大规模发酵,以期得到活性次级代谢产物;本次液体发酵的时间长达20天可能也是导致培养基中产生一些结构简单的基本代谢产物的原因,这为以后的发酵时长提供前车之鉴;另一方面,研究表明倍半萜类化合物具有抗菌、抗癌、杀虫、调节植物生长等活性[21],今后可以对该化合物进行其他活性测试,以挖掘该化合物其他的生物活性。
