基于LF-NMR/MRI的丹参加工过程水分变化与色差相关性研究
2021-06-07刘沁荣王一硕张振凌石延榜林竹一
刘沁荣,王一硕,2*,张振凌,2,石延榜,2,林竹一
1河南中医药大学;2河南省中药生产一体化工程技术研究中心,郑州 450046;3苏州纽迈电子科技有限公司,苏州 215000
低场核磁共振(low field nuclear magnetic resonance,LF-NMR)是利用氢原子在磁场中的自旋弛豫特性,通过横向弛豫时间(transverse relaxation time,T2)的变化微观解释物料内部水分、油脂及蛋白质等物质的分布变化和迁移情况,具有快速、准确、无损的优点[1]。低场核磁共振技术是一种磁共振检测方法,由核磁共振原理解释水中含有大量氢原子,样品中氢的横向弛豫时间随外界化学环境变化而不同,对应T2大小反映水分自由度的大小,T2越长表示水分结合度越小,流动性越强,常被用来表征样品干燥/复水过程中水分迁移规律[2]。低场核磁共振技术能够提供内部水分信息而不会对样品造成干扰,现已广泛应用于工业、食品领域,主要为观察物料在干燥/浸润过程中水分、油脂的存在形式变化,或通过测定水分比例进行掺假鉴别研究[3,4]。已有研究将低场核磁共振技术应用于中医药相关领域[5-8],如在天麻干燥过程进行检测,验证该技术可以成为快速测定中药材水分分析方法[9];以不同品牌的黄明胶为检测对象,利用低场核磁共振技术和主成分分析方法区别不同品牌的黄明胶[10]。
鲜药采挖后经过干燥成中药材,再根据用药目的加工炮制成饮片,干燥指标与炮制工艺影响着饮片品质疗效。总结历版中国药典及各省市地方炮制规范干燥指标设定限于“阴干、晒干”,具体参数尚未确定。已有研究表明干燥工艺条件、水分含量状态对药材的品质和外观均有影响[11],尤其是根茎类中药材因质地坚硬,水分控制是加工炮制过程中重要质控指标。丹参为唇形科植物丹参SalviamiltiorrhizaBge.的干燥根及根茎,始载于《神农本草经》列为上品,有“一味丹参饮,功同四物汤”之称,在心血管疾病的防治上占据重要地位[12,13]。丹参种植成熟后经采收干燥形成药材,干药材经洗润透切制成干燥饮片,具体流程示意见图1。在传统浸润过程中需水进入药材,浸润不当易损失有效成分含量,不透彻则切制困难影响饮片外观性状。已有文献表明[14,15]低场核磁共振技术可以为中药材复水条件、终点判断提供技术支持,为水分变化规律提供直观参考依据,基于此借低场核磁共振技术研究丹参药材浸润过程中的水分变化规律。鉴于中药材加工工艺繁琐,整合开展中药材产地加工与炮制一体化研究,已有学者进行丹参产地趁鲜切制可行性初探[16],将丹参鲜药材干燥至一定含水量后切制,所得切片外观与传统方法相近,活性成分含量高于传统方法,认为丹参产地趁鲜切制是可行的。但是在该过程中水分控制模糊、状态不直观,不能科学合理界定终点指标,亟待采用科学技术进行深入解析。本实验通过低场核磁共振成像(magnetic resonance imaging,MRI)技术监测丹参浸润和干燥过程的水分变化,为深入规范产地加工规程提供技术方法和理论依据。
图1 丹参生产加工示意图Fig.1 Produciton processing methods of S.miltiorrhiza
中药的色泽与中药药性、药效密切相关,外观色泽与中药品质优劣存在重要的相关性。丹参传统评价有“色红者佳”、“皮丹肉紫”之说,说明其“皮”、“肉”的颜色特征尤为重要。有研究表明丹参外观色泽与其所含丹参红色素相关,丹参红色素又称总丹参酮,颜色与脂溶性成分存在正相关,表皮颜色深浅间接反映药材品质差异[17],故本研究借用精密色差分析技术,比较不同加工过程中丹参样品的色差值,对水分规律和色差值进行相关性分析,为保障中药材质量评价提供科学参考。
1 材料与方法
1.1 样品
样品采集河南省中药生产一体化工程技术研究中心丹参种植基地,经河南中医药大学生药学董诚明教授鉴定为唇形科植物丹参SalviamiltiorrhizaBge.的干燥根及根茎。
浸润:取粗细一致、大小相同丹参药材(约0.5~1.0 cm)平行3份,在0.5倍量水浸润4次,达到药材以润透不伤水为度。分别取不同浸润程度的药材单根,快速进行T2和MRI成像检测。另外将浸润不同程度的丹参药材切制2~4 mm,放置在HF8812型红外干燥箱(电热设备有限公司)50 ℃红外干燥。
干燥:取粗细一致、大小相同鲜丹参根条(约0.5~1.0 cm)平行3份,于红外干燥箱50 ℃干燥,在不同干燥点取样切制2~4 mm饮片,放置室温后进行称量,并取单个丹参饮片进行T2测定及MRI成像检测后并50 ℃红外干燥。
1.2 低场核磁共振方法
采用MesoMR21-060H中尺寸核磁共振成像分析仪分析(苏州纽迈电子科技有限公司,苏州),将样品装入中尺寸玻璃管放进永久磁场中心位置,磁体强度0.5 T,磁体温度为32 ℃;利用硬脉冲自由感应衰减(free induction decay,FID)序列获得样品中心频率,再利用脉冲序列(carr-purcell-meiboom-gill,CPMG)测样品横向弛豫时间,连续测量3次取平均值;CPMG序列设置参数为:SFO1(MHz)=21.239 643 MHz,P90(μs)=5.6,P180(μs)=12.8,SW(kHz)=250,TW(ms)=3 000,TE(ms)=0.2,RG1=10,DRG1=2,PRG=1,NECH=7 000,NS=32。
采用多脉冲回波序列CPMG扫描采集核磁信号,通过调整序列的选层梯度、相位编码梯度和频率编码梯度,分别获取样品成像数据。利用sirt算法,迭代次数为10万次进行反演得到T2加权成像谱图;MRI加权成像列设置参数为:SFO1(MHz)=21.239 643 MHz,RFA90o=2.2,RFA180o=3.5,TR(ms)=1 200,TE(ms)=50,Slice width(mm)=3.0,Slices=1,Average=4,Read Size=256,Phase Size=192。
1.3 色差仪方法
采用HP-C220精密色差仪(上海图新电子科技有限公司),照明光源D65,狭缝宽度1 nm,视场选择10°,以色空间L、a、b进行色泽量化。其中L表示明度,取值0~100数值为正,越接近0就越黑,值越大亮度越大;a、b有正负之分,其中红色表示a正值,绿色表示a负值;b正值表示黄色,b负值表示蓝色。
测定方法:取丹参样品,打粉过筛(四号),将药材粉末平铺在仪器测试处,测量其表面颜色,随机扫描多次取平均值。
1.4 数据处理
利用LF-NMR系统软件对数据进行采集,自动反演后系统进行结果曲线统计,得出弛豫时间T2与信号量幅值之间的关系;用SPSS、Origin软件分析作图。
2 结果与分析
2.1 FID信号量和水质量相关性分析
在LF-NMR检测过程中,实体物质的弛豫时间在60 μs后的FID信号强度为自由水与结合水的总信号强度,根据低场核磁共振反演图谱得出的信号量与标准品纯水的质量进行相关性分析。为了验证LF-NMR测量含水确性,将纯水在与样品同一测试条件参数下,进行拟合对比,所得拟合曲线见图1。图1中横坐标是标准样品对应水的质量,纵坐标是标准样品的信号量,拟合后线性方程为y=1 678.6x+75.522,相关系数r2=0.999 6,呈显著的线性关系,可采用LF-NMR技术测定丹参药材在加工过程中水分含量变化。

图2 低场核磁信号量与标准品相关性分析Fig.2 Correlation analysis between low field nuclear magnetic semaphore and standard
2.2 药材浸润过程中水分变化规律
在传统丹参药材炮制过程中,需将干燥丹参药材根条进行浸润复水软化,至出现“弯折不断”状态,表示在此状态下水分含量适中,可切制饮片作为临床使用。通过观察丹参药材在不同浸润时间的水分状态与变化,进行弛豫谱图和数据采取,得到结果表1和图3。在图3和表1中样品中弛豫时间分布表明在该组织结构中存在多个水分群,通过计算弛豫时间T2对应的峰面积定量计算药材中水份相对含量。
由表1可知丹参药材浸润前所含水份主要为结合水,浸润开始弛豫峰逐渐右移形成两个峰,自由水增加了50.64%,水分开始渗透药材组织内部。随着时间增加流动水增加至88.76%,且药材内部明显呈现出两个水分峰,分别是结合水和自由水。图3是丹参浸润过程中水分迁移变化的弛豫谱图,每个峰代表着1种类型的水分,峰面积表征该相态水的相对量大小,峰面积越大则该相态水含量越多。在图3中横坐标为弛豫时间,纵坐标为信号量振幅强度,根据浸润时间不同,弛豫图谱逐渐由一个吸收峰逐渐变成两个吸收峰:在T21(0.01~10 ms)之间,对应流动性差的结合水;在T22(10~1 000 ms)之间,流动水浸入药材内部,药材组织发生变化;逐渐结合水和自由水的峰位置逐渐向右移动,自由水对应的信号幅值最大,说明丹参药材内部水的自由程度在持续增加并形成规律性。
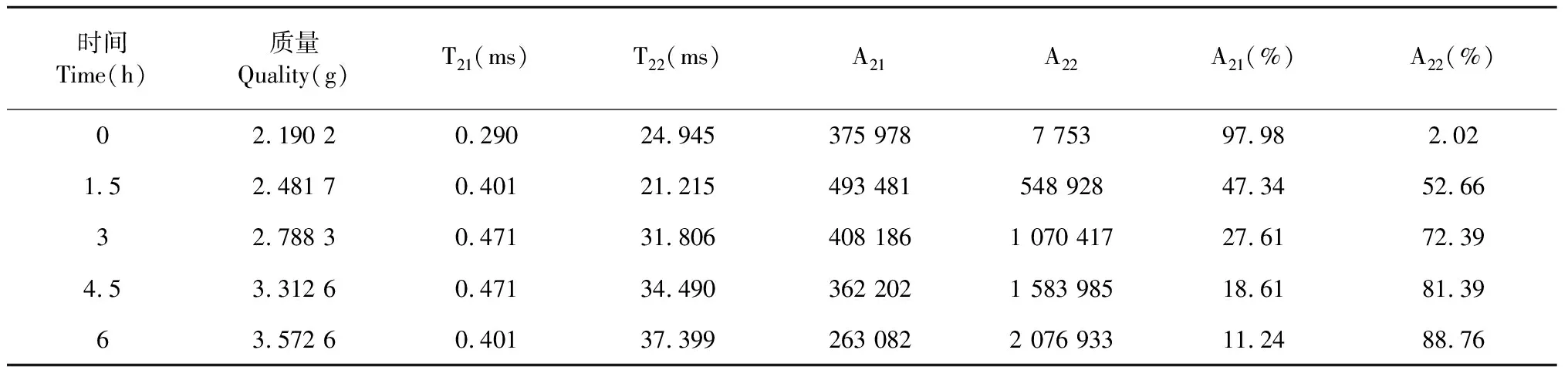
表1 丹参浸润过程中弛豫时间和弛豫峰面积变化(n=3)Table 1 Relaxation time and peak area in the processing of S.miltiorrhiza (n=3)

图3 丹参浸润过程中T2 弛豫图谱Fig.3 Relaxation spectrum of S.miltiorrhiza during processing
2.3 药材浸润过程中MRI图像
利用MRI技术获得的丹参药材在浸润过程中水分变化图像见图4。图像中红色代表的水分含量高,绿色代表水分含量较合适,由MRI图像得出:丹参药材浸润过程中总体水分含量明显增加,逐渐成像呈现浸润渐湿的状态;随着浸润时间加长,水分含量增加明显并渗透内层;浸润4.5 h时水分浸润内部聚集并呈现扩散趋势,此时丹参药材呈现折不断状态,根据外观指标与传统经验“弯曲法”基本相符;浸润6 h后,药材呈现两头水分充满,断面层呈黑褐色。
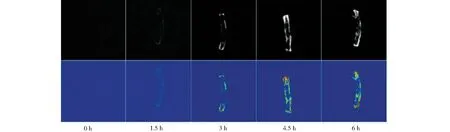
图4 药材浸润过程中MRI图像Fig.4 MRI image of S.miltiorrhiza during processing
2.4 鲜根干燥过程中水分变化规律
采挖后的丹参鲜根,若直接切制成饮片,极易出现饮片外观性状差、化学成分含量减少等问题。将丹参趁鲜切制待干燥至适当一定水分含量加工成饮片,既保证化学成分含量,又优化加工工艺,省时快捷。在丹参鲜根样品干燥过程中,横向弛豫时间T2的大小反映不同状态的水分分布与变化情况,T2越小水分自由度越小,水与所处环境中的大分子结合越紧密;T2越大表明水分自由度越大越容易除去。丹参鲜根在干燥过程中水分状态和变化的弛豫时间和峰面积见表2,从表2可知随着干燥时间的延长水分峰向左移动,水分的流动性变差,峰面积逐渐变小。干燥初始时,丹参鲜根样品中含结合水约2.26%,流动水约97.74%;随着干燥时间的延长,流动水峰面积逐渐下降,结合水峰面积逐渐升高,说明丹参鲜根样品中流动水向结合水方向转化;干燥12 h后水分状态大部分转化为结合水。
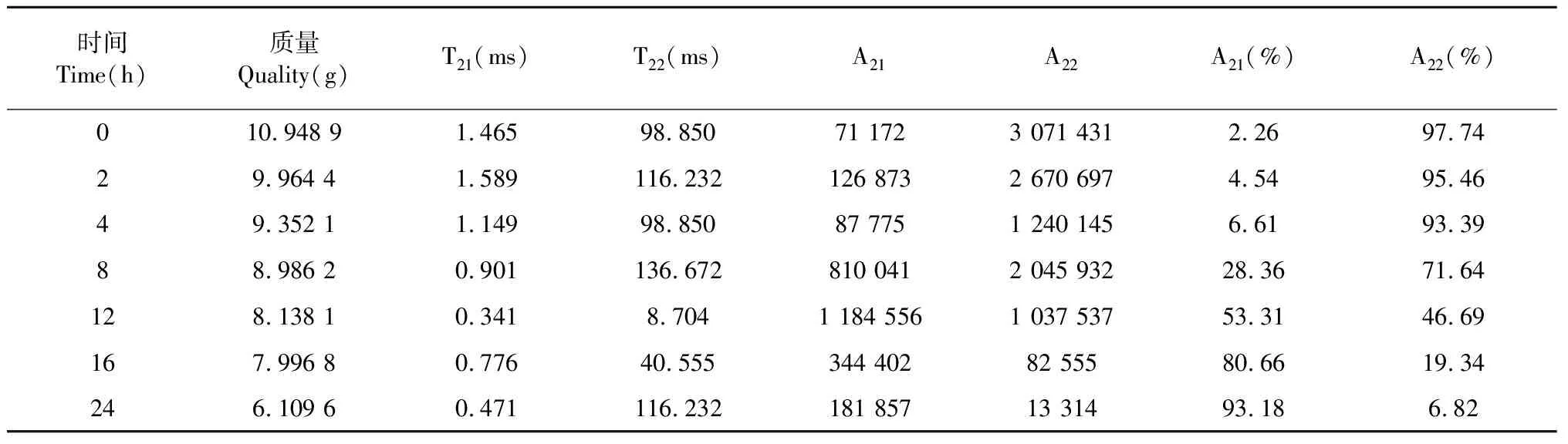
表2 丹参鲜根干燥过程中弛豫时间和弛豫峰面积变化Table 2 The time and peak area of fresh root of S.miltiorrhiza were changed during processing
丹参鲜根在干燥过程中水分状态和变化的弛豫图谱变化见图5。从图5可知不同时间段测得的T2弛豫图谱均有2个较为明显的吸收峰:在T21(0.01~10 ms)范围内,呈现丹参鲜根中结合水分布状况;在T22(10~1 000 ms)范围内,呈现丹参鲜根中自由水分布状况。结果表明随着干燥时间的延长,丹参鲜根内部水分分布发生变化。

图5 丹参鲜根干燥过程中T2 弛豫图谱Fig.5 Relaxation spectrum of fresh root of S.miltiorrhiza during processing
2.5 鲜丹参干燥过程中MRI图像变化
利用MRI技术获得的丹参鲜根干燥过程中图像变化(见图6),其中红色代表的水分含量高,黄色代表水分含量低,绿色代表水分含量减少。MRI图像表明丹参鲜根干燥过程水分含量由内向外减少,12 h时丹参饮片成像逐渐边模糊,此时中药材组织被破坏说明内部水分含量和状态发生缺省变化,内部自由水消失剩下少量结合水;随着干燥时间延长24 h后水分集中内层且内部组织被破坏,达到干燥临界点,且水分含量太低成像模糊。

图6 丹参鲜根干燥过程中MRI图像Fig.6 MRI image of fresh root of S.miltiorrhiza during processing
2.6 色差技术评价丹参药材质量
2.6.1 浸润前后色度值测定
利用色差仪以传统方法所得丹参为参比,借用色差值对不同浸润时间的丹参进行客观颜色分级。根据色差技术结果显示随着浸润时间延长(见表3),丹参表皮颜色变深,由砖红色逐渐变成棕红色,根据色差仪检测结果显示随着浸润时间延长a值持续升高,其丹参外表皮颜色越红,当浸润至4.5 h后颜色与传统表皮颜色相符。
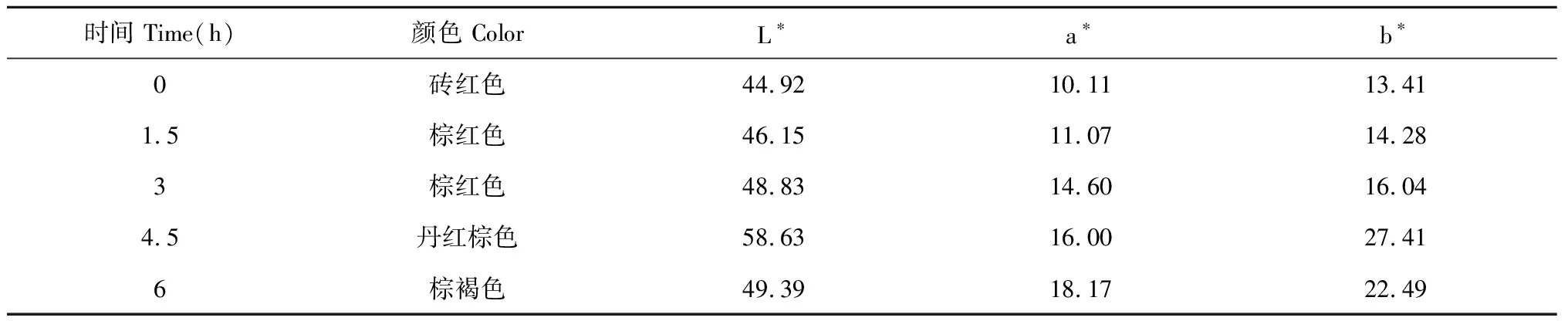
表3 丹参药材浸润品L*、a*、b*均值(n=10)Table 3 Mean value of L*,a* and b* of infiltration product(n=10)
运用分析软件对浸润品弛豫峰面积与色度值进行相关性分析,结果表明不同丹参浸润品的水分状态与色度值呈一定相关性。在此相关性中结合水与色差a值呈显著负相关,相关系数-0.723;流动水与L值和a值呈正相关,相关系数分别为0.635和0.986。同时不同状态水分之间呈现相关关系,结合水与自由水呈对立关系(见表4)。

表4 弛豫峰面积与色度值的相关性分析Table 4 Correlation analysis of relaxation peak area and chromaticity value
2.6.2 鲜丹参干燥前后色度值测定
根据色差仪规定,L正值表示偏白,a正值表示偏红,b正值表示偏黄,数值越大颜色越深。在鲜丹参干燥过程中,随着干燥时间延长a、b值逐渐减少,这与实验中鲜丹参表皮颜色逐渐变浅结果相符,见表5。
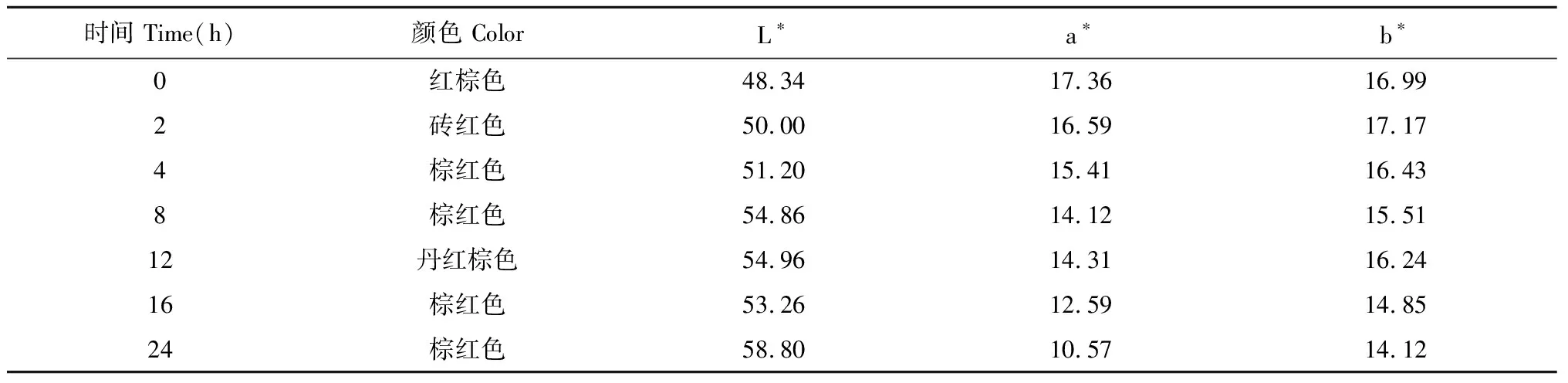
表5 鲜根干燥品L*、a*、b*均值(n=10)Table 5 Mean value of L*,a* and b* of fresh root products(n=10)
运用分析软件对丹参鲜根不同干燥时间时的弛豫峰面积与色度值进行相关性分析,结果表明在不同干燥品水分状态与色度值呈一定相关性,见表6。流动水与a值和b值呈正相关,相关系数分别为0.757和0.686;但是与L值呈极显著负相关。
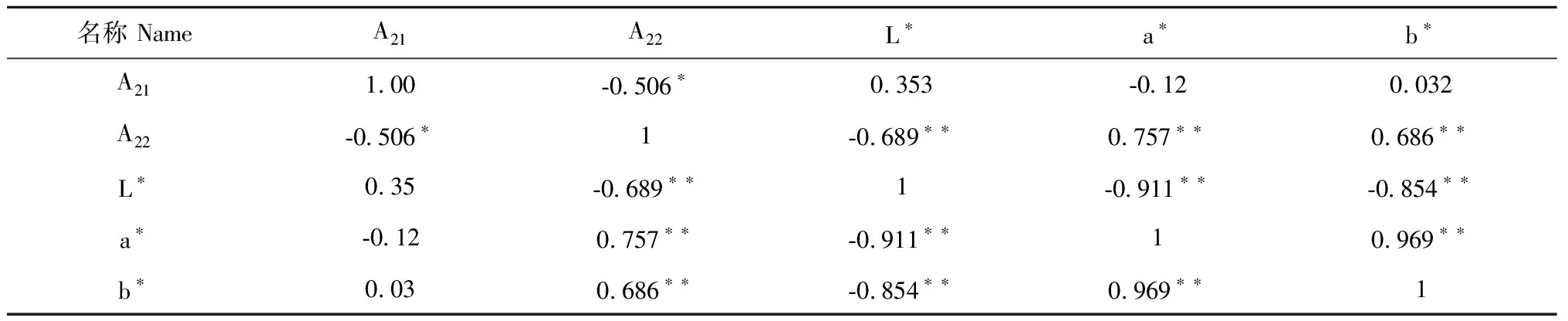
表6 弛豫峰面积和色度值的相关性分析Table 6 Correlation analysis of relaxation peak area and chromaticity value
3 讨论
本实验以水质量和低场核磁信号量进行定标,拟合后水质量与信号量吸收峰面积呈显著的线性关系,r2值为0.999 6,表示该法可靠。本研究通过低场核磁共振技术研究丹参在不同加工过程中的水分含量与变化规律,由T2弛豫图谱显示在不同状态下出现两个峰,初步说明丹参内部水分状态分为两种:结合水和流动水;随加工方法不同水分所对应信号幅值发生变化,吸收峰呈现不同方向的迁移。丹参药材在浸润6 h后,外界水开始渗透药材内部,自由水与结合水开始汇合转化,最后水分含量增加至88.76%;随着水分含量变化,药材外观形状、表皮颜色皆发生变化,且易切制;鲜丹参药材在50 ℃恒温干燥12 h后,自由水含量下降至46.69%,约24 h后接近干燥终点,此时组织内部中剩余少量结合水,MRI图像已不能辨识。有研究表明不同干燥方法下丹参脱水率与各成分含量呈负相关[18],这也表示含水量控制对干燥具有较大的影响。丹参传统加工过程繁琐,已有学者对丹参趁鲜切制工艺优化进行研究认为趁鲜切制是可行的,但具体药材含水量及工艺参数尚未完善[16]。本研究表明低场核磁共振技术,可以快速检测出丹参干燥或浸润过程中内部水分变化规律,也为药材干燥/浸润的终点控制进行科学评判。
中药色泽是中药质量的重要指标之一,自古以来人们就依靠实践经验总结出根据颜色鉴别中药真伪优劣的方法,即所谓“辨色论质”。丹参“皮丹肉紫”,因主要含有红色菲醌类衍生物,药材表现出强烈的红色色泽。在丹参药材浸润过程中,色差a值随着时间延长逐渐升高,药材外表皮颜色逐渐加深,并且结合水与a值呈显著负相关,表示水分含量与脂溶性丹参酮类成分存在一定关系。在丹参鲜根干燥过程中,随着时间延长a、b值逐渐减少,表皮颜色随之逐渐变浅,当干燥24 h时a值剧烈减少,流动水比例与a值和b值呈显著正相关,与L值呈极显著负相关,反映在此状态下丹参酮类成分剧烈减少。水溶性成分丹酚酸B是鲜丹参采收干燥后的产物,但随着时间延长含量逐渐减少[19],作为水溶性成分这一变化极可能与样品含水量有关,是否能通过低场核磁共振检测药材水分临界点从而控制化学成分含量,这对中药材质量控制有参考意义。
植物根据分子状态及环境影响,内部可分为两种状态水:结合水和自由水,结合水被植物细胞中大分子吸附,不能随意自由流动;自由水存在于植物细胞间隙,能够自由移动或消失。根系是中药从生长环境中获取养分的重要部位,由于根内部结构复杂且非均匀,在水分分布和控制方面较为困难。植物根茎富含大量水分,而氢在水分中丰度极高,低场核磁共振谱图中对氢原子有较强的信号值,这也成为低场核磁可广泛应用研究根茎类药材水分规律的特色。低场核磁作为新兴研究方法,与常规传统分析方法相比,具有结果直观、数据准确、检测快捷等优点,在水分测定研究中显示出独特的优越性。本研究以根茎类药材丹参为研究对象,阐述丹参浸润和干燥过程中水分变化规律,为根类药材加工提供了更为直观的评价方法,也为研究炮制加工过程中水分变化提供一种快速无损可视化的技术手段,同时在中药水分控制、加工工艺优化方面提供科学依据。不足之处未能结合化学成分含量进行综合分析,后期会结合活性成分变化,就炮制加工过程中药材水分与化学成分的差异规律进行科学系统阐述,为中药研究与应用提供新思路。
