MRI和骨扫描及相关因素诊断前列腺癌骨转移的价值分析
2021-06-05罗丽萍胡珊仝慧敏黄楠李晓倩李丽娜余飞燕吴波程艳
罗丽萍 胡珊 仝慧敏 黄楠 李晓倩 李丽娜余飞燕 吴波 程艳
山西医科大学第一医院1核医学科,2磁共振影像科,4泌尿外科(太原030001);3山西医科大学口腔医学院(太原030001)
前列腺癌(prostate cancer,PCa)属于常见恶性肿瘤,早期临床症状不典型,近70%的患者初诊时已发生远处骨转移,导致骨痛、病理性骨折等骨骼相关事件,是造成全球癌症相关死亡的主要原因[1]。早期明确患者PCa 骨转移有助于治疗工作的尽早开展,对提高临床疗效、改善生活质量与降低病死率意义极大。目前核素骨扫描是临床判断骨转移公认的首选方法,其敏感性较高,但特异性欠佳[2]。本研究探讨该中心51 名PCa 患者的年龄、总前列腺特异性抗原(total prostate specific anti⁃gen,tPSA)、游离前列腺特异性抗原(free prostate specific antigen,fPSA)、Gleason 评分对全身骨转移的诊断价值,同时从患者水平比较MRI 与核素骨扫描对骨盆区域骨转移的诊断价值,以期为临床提供一种更准确的诊断参考依据。
1 资料与方法
1.1 一般资料回顾分析2018年1月至2020年1月于山西医科大学第一医院确诊的51 例PCa 患者资料。选取标准:经手术或穿刺活检病理证实PCa,测量PSA,接受核素骨扫描、且近期行骨盆MRI 检查,诊断资料完整者。排除标准:其他恶性肿瘤病史,PSA 化验前3 ~5 d 内接受直肠指诊等医疗操作,合并急慢性泌尿系感染史、尿储留者。
1.2 诊断标准符合以下任何一项骨转移病灶的临床标准者均可纳入骨转移组:(1)存在穿刺或手术的病理学依据;(2)存在两种及以上的影像学方法都诊断骨转移灶;(3)可疑病灶间隔6 个月经骨扫描、MRI 或CT 随访,病灶增大呈明显进展或积极治疗后病灶明显减小呈缓解状态者[3]。
核素骨扫描诊断标准:病变部位放射性明显高于健侧及邻近正常组织,或累及多个部位,且仅符合肿瘤骨转移;MRI 诊断标准:病灶于不同序列上所呈现出的信号存在较大的差别,T1 加权呈低信号,其他加权呈高信号或高低混杂信号,增强扫描呈明显强化[4]。
1.3 仪器与方法核素骨扫描:仪器为西门子Symbia T6 双探头单光子发射断层显像⁃X 线计算机体层成像(single⁃photon emission computed tomog⁃raphy/computed tomography,SPECT⁃CT)仪,选用低能高分辨率准直器。在专业医师指导下,排除禁忌症后经肘静脉注射骨显像剂99Tcm⁃亚甲基二膦酸盐(99Tcm⁃Methylenediphosphonate,99Tcm⁃MDP)740 ~1 110 MBq(20 ~30 mCi),嘱其饮水1 000 mL 以上,3 h 排空膀胱后扫描全身骨扫描,扫描速度为15 ~25 cm/min。亦可确定感兴趣区后行局部SPECT/CT 断层融合显像,SPECT 采集矩阵128 × 128,CT采集矩阵512×512,层厚5 mm。
MRI:采用西门子3.0T HDx 磁共振成像设备,用体线圈扫描,8 mm 层厚,10 mm 层间距。扫描序列包括T1WI、脂肪抑制T2WI、非脂肪抑制T2WI 及DWI,部分行增强扫描,对比剂采用Gd⁃DTPA。DWI检查使用单次激发EPI 序列,b 值为1 500 s/mm2,矩阵256 × 256,NEX 6 次。检查前嘱病人适度充盈膀胱,仰卧位,扫描层面位于耻骨联合上方。
两名资深放射科及核医学科医生在了解患者临床病史但各影像检查信息互不参考的情况下对MRI 及全身骨扫描图像的骨盆区域(双侧髂骨、髋臼、耻骨、坐骨、L4⁃5 椎体及骶尾骨)进行盲法分析,判断是否存在骨转移,见图1。
1.4 PSA 检测清晨空腹抽取静脉血3 mL,采用罗氏化学发光法检测血tPSA(正常:0 ~4 ng/mL)与fPSA(正常:0 ~0.65 ng/L)。
1.5 Gleason 病理评分标本送病理科处理后由专职病理科医师阅片,按国际泌尿病理协会规定的Gleason 分级系统[5]分为低危组(≤6)、中危组(=7)和高危组(≥8)。
1.6 统计学方法使用SPSS 20.0 统计软件,数据均为计量资料,以均数±标准差表示,组间比较采用t检验;MRI 与骨扫描的诊断价值用χ2检验。P<0.05 差异有统计学意义。
2 结果
2.1 临床资料共纳入51 例PCa 患者,平均年龄、tPSA、fPSA 及Gleason 评分分别为(72.29±1.04)岁、(314.04 ± 117.48)ng/mL、(45.53 ± 13.39)ng/mL,8.06 ± 0.16。所有患者MRI 与核素骨扫描的检查时间间隔为(9.57±8.67)d,中位数为6 d。
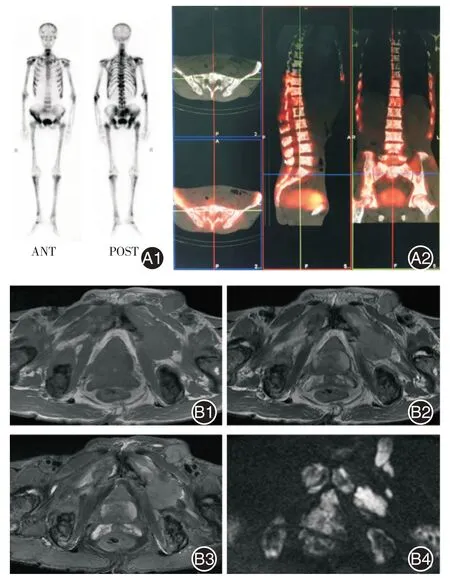
图1 骨扫描、MRI 诊断骨转移骨盆区域骨转移Fig.1 Diagnosis of bone metastasis in pelvic area by bone scintigraphy and MRI
2.2 年龄、tPSA、fPSA、Gleason评分诊断PCa全身骨转移的价值分析PCa患者依据诊断标准分骨转移者24 例(47.06%)与非骨转移者27 例(52.94%)。其中,单一转移灶者4 例(16.67%),分别位于骨盆(2例)、胸椎及肋骨;两处转移病灶者3例(12.5%);多处转移灶者有17 例(70.83%)。两组间年龄的差异无统计学意义(P= 0.104);骨转移组具有较高的tPSA、fPSA 及Gleason 评分,其差异均有统计学意义(P<0.05),见表1。
tPSA、fPSA对PCa骨转移诊断的ROC曲线分析显示,tPSA 的最佳诊断临界值为68.59 ng/mL,诊断敏感度和特异度分别为75.00%和81.50%;fPSA 的最佳临界值为6.42 ng/mL,此时敏感度和特异度分别为83.30%和81.50%(图2、表2)。
2.3 MRI 和核素骨扫描诊断骨盆区域骨转移确诊临床骨转移的24 例患者中2 例仅存在骨盆区域外的骨转移灶(分别于第8 胸椎、第6 前肋骨)。MRI 确诊骨转移21 例,核素骨扫描诊断的患者为24 例。以临床诊断为金标准,MRI、核素骨扫描及二者联合诊断骨盆区域骨转移的敏感性、特异性、准确度均具有统计学意义(χ2= 32.616、29.861、28.068,P<0.05,表3)。MRI 与核素骨扫描诊断准确度的差异不具有统计学意义(表4);此外Kappa检验发现:二者诊断骨转移的一致性水平较强(Kappa=0.643,P<0.05)。
表1 PCa 骨转移组与非骨转移组组间比较Tab.1 Comparison between PCa bone metastasis group and non⁃bone metastasis group ±s
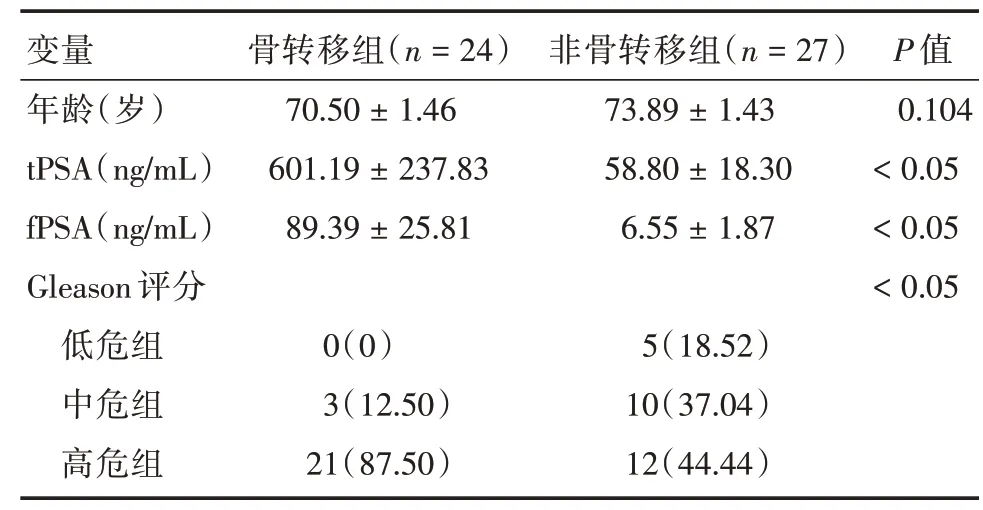
表1 PCa 骨转移组与非骨转移组组间比较Tab.1 Comparison between PCa bone metastasis group and non⁃bone metastasis group ±s
变量年龄(岁)tPSA(ng/mL)fPSA(ng/mL)Gleason 评分低危组中危组高危组骨转移组(n=24)70.50±1.46 601.19±237.83 89.39±25.81 0(0)3(12.50)21(87.50)非骨转移组(n=27)73.89±1.43 58.80±18.30 6.55±1.87 5(18.52)10(37.04)12(44.44)P 值0.104<0.05<0.05<0.05
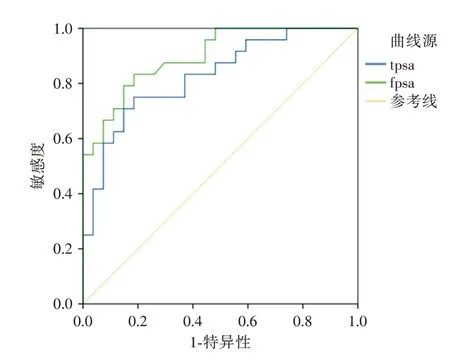
图2 tPSA、fPSA 诊断PCa 骨转移的ROC 曲线Fig.2 The ROC Curve of tPSA and fPSA in diagnosis of bone metastasis of PCa

表2 tPSA、fPSA 对PCa 骨转移的ROC 曲线结果Tab.2 ROC curve results of tPSA and fPSA in bone metastasis of PCa例(%)
3 讨论
PCa 是常见的男性恶性肿瘤,发病率居第二,病死率排第五,随着我国人口老龄化及生活方式的改变,发病率及病死率仍不断上升[6-7]。前列腺组织与低位腰椎间存在Batson 静脉丛,与肋间静脉、腔静脉交通广泛,PCa 易转移到富含血管的承重骨,以低位腰椎、骨盆最为常见[8]。PCa 生长缓慢且隐匿,患者因骨痛就诊时多步入晚期,因此骨转移的早期明确,对选择治疗方案及改善预后意义重大[9]。
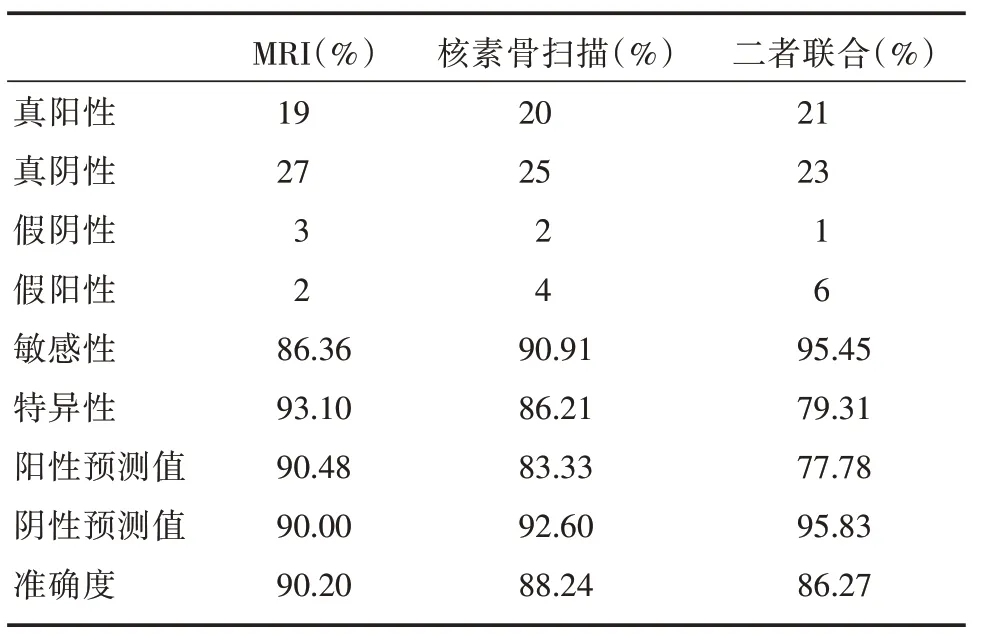
表3 对比金标准,MRI、核素骨扫描及二者联合对PCa 骨盆区域骨转移的诊断价值Tab.3 The diagnostic value of MRI,bone scintigraphy and their combination in PCa pelvic bone metastasis compared with the gold standard

表4 核素骨扫描与MRI 对PCa 骨盆区域骨转移的诊断效能比较Tab.4 Comparison of bone scintigraphy and MRI in the diagnosis of bone metastasis in PCa pelvic area 例
理论上骨转移瘤的诊断金标准是病理组织学检查,但穿刺活检骨盆、椎骨有创伤性和危险性,临床多根据循证医学原则,采用临床病史同多种影像学资料结合辅以随访的诊断标准。MRI 是评价骨髓浸润的首选工具,诊断骨转移灶拥有极好的敏感性(96%)与特异性(98%)[10],但早期应用的临床收益并不明确,大多数中心骨转移的筛查诊断主要依赖全身骨显像,其可检测95%以上的骨转移灶。本研究51 例PCa 患者分骨转移组24 例与非骨转移组27例,既往研究[11-12]对年龄与PCa 骨转移的关系尚不统一,本研究骨转移组的年龄小于非骨转移组,与低龄患者骨组织微环境更利于肿瘤细胞生长有关,但差异无统计学意义(P=0.104)。
Gleason 评分是最常用的PCa 病理分级系统,与生物学行为及预后关联密切,临床常用来评估肿瘤浸润范围、分期、淋巴结及远处转移。研究发现PCa 骨转移的比例与Gleason 评分呈正相关[13];2017年国立综合癌症网络临床实践指南推荐Gleason 评分≥8 分时[14]考虑骨转移,建议行骨扫描。本研究高危组骨转移者21 例(87.50%),无骨转移者仅12 例(44.44%),且骨转移组中Gleason 评分均值明显高于非骨转移组(P<0.05)。
PSA 是前列腺腺上皮分泌的血清糖蛋白,是目前诊断PCa 的公认肿瘤标志物。正常前列腺导管系统作为屏障可维持血清PSA 的正常水平,炎症或肿瘤恶变时屏障作用破坏使PSA 释放入血,PSA 值与PCa 骨转移的发生呈正相关[13]。既往研究[15-16]发现PCa 骨转移组的tPSA、fPSA 水平显著高于非骨转移组,是诊断骨转移的有力指标(AUC = 0.820、0.829)。本研究tPSA、fPSA 于骨转移组均明显高于非骨转移组(P<0.05),当分别取界值68.59 ng/mL、6.42 ng/mL 时,诊断PCa 骨转移的效能最佳,敏感性和特异性分别为75.00%和81.50%、83.30%和81.50%。
核素骨扫描可对全身骨骼一次性显像,转移病灶的检出率为95% ~97%,表现为病灶异常显像剂浓聚,呈点状、条状或不规则状,特征表现为全身骨骼“超级影像”,是临床判断PCa 骨转移的首选方法。MRI 作为形态学成像方式,扫描速度快、组织分辨率高、定位精确且无电离辐射,可显示局限于骨髓腔内无骨皮质受损的病灶,对诊断早期骨转移很敏感[17]。骨转移时受侵骨组织的脂肪和水含量增高,病灶区肿瘤细胞取代脂肪组织T1WI 呈低或混杂信号;T2WI 和抑脂序列成骨性病变呈略低或等信号,周围多有高信号带环绕,溶骨性病变因周围细胞水肿呈高信号;DWI 呈骨髓腔内斑片样高信号[18]。全身T1WI、短时反转恢复、高b 值DWI 及其序列的任意组合均具有很高的骨转移瘤诊断准确率[19],CHEN 等[20]发现全身MRI 诊断PCa 骨转移的AUC 明显高于全身骨显像(0.778vs.0.634);沈国华等[21]经Meta 分析发现MRI 诊断PCa骨转移显著优于骨显像(AUC:0.9901vs.0.6241),均表明MRI 诊断PCa 骨转移的优越性。
本研究骨转移者24 例,病灶以骨盆、中轴骨为主,其中骨盆区域转移者22 例。该研究骨扫描诊断骨转移存在一定的假阴性(许多退行性变、炎症感染等也表现放射性浓聚)及假阴性(单纯的溶骨性转移灶增长迅速或代谢缓慢)病例。MRI 诊断骨转移亦如此,可能与仅扫描骨盆相关。分析发现MRI 诊断PCa 骨转移的敏感性比骨扫描低,但特异性高,与李倩倩等[4]结果相仿;两者对骨转移的诊断准确度均很高(P= 0.547),诊断一致性水平亦较强(Kappa 值= 0.643);此外,二者联合诊断的敏感性及阴性预测值均高于单一诊断,表明二者诊断PCa 骨转移虽各有优势,但准确度高且一致性强,联合诊断可早期发现病灶,有效排除骨转移风险。目前全身MRI 扫描成本高,未广泛用于临床,而局部MRI 扫描视野小,易漏诊;核素骨扫描作为高敏感性的全身成像技术,可首选进行全身骨骼的诊断,疑诊时行局部MRI 进一步证实或评价骨质破坏程度及软组织浸润范围。
本研究有以下不足:此为单中心回顾性研究且样本量少,后期需扩大样本量;此研究仅针对骨盆区域研究,可能致结果偏倚,若针对全身系统性比较结果将更为精确。
综上,tPSA、fPSA 和Gleason 评分是明确PCa 骨转移的危险因素,其水平增高对预测PCa 骨转移有较好的指示意义,特别是当tPSA>68.59ng/ml、fPSA>6.42ng/ml 且Gleason 评分>8 分时诊断价值更大;同时针对骨盆区域,发现MRI 和骨扫描诊断PCa 骨转移各有优势,于临床实践中联合使用,实现优势互补可实现PCa 患者骨转移的早期精确诊断。
