假睛东方鲀肝脏中河豚毒素的分离纯化
2021-06-04王瑞瑞张小军曾军杰卢义博方双琪陈思
王瑞瑞,张小军,曾军杰,卢义博,方双琪,陈思
(1.浙江省海洋大学食品与药学学院,浙江舟山 316021)(2.浙江省海洋水产研究所,浙江舟山 316021)(3.浙江省海洋渔业资源可持续利用技术研究重点实验室,浙江舟山 316021)
河豚毒素(Tetrodotoxin,TTX)是一种非蛋白的神经毒素,毒性很强的生物碱[1]。TTX得分子结构为氨基全氢喹唑啉型化合物,分子式为C11H17O8N3,相对分子质量为319.30。TTX不溶于水和有机试剂,溶于弱酸性水溶液和醇溶液,在强酸和强碱溶液中容易被破坏,有机酸条件下可稳定存在。河豚毒素最早是在河豚鱼中发现的,毒素主要分布在卵巢、肝脏、皮肤等组织中[2]。不同生长期的河鲀鱼体内毒素分布并不相同,幼年时期的河鲀鱼的卵巢发育不成熟,TTX主要蓄积在皮肤中;而成年河鲀鱼的主要蓄积器官是卵巢,肝脏次之[3]。除河鲀鱼外,在其他动物体内也检测到了TTX及其衍生物的存在,如蓝环章鱼[4]、蝾螈[5]、纽虫[6]、织纹螺[7]等。在日本、中国、东南亚等地常有误食河鲀鱼中毒事件发生[8],近些年来我国沿海地区也有食用织纹螺、河豚鱼导致中毒的案例,其中毒表现通常为口腔麻木感觉异常,运动性麻痹,身体不协调,言语不清,严重者出现缺氧,心率过缓,意识不清,最终因呼吸衰竭和心脏衰竭而死亡[9]。虽然摄入过量的河豚毒素会导致肌体中毒,但它也具有重要的药用价值。河豚毒素具有高效选择性和高效亲和性,可迅速阻断神经纤维上的钠离子通道,从而抑制神经和肌肉间的兴奋传导,使神经和肌肉麻痹[10]。河豚毒素可作用于特定的钠离子通道(VGSCs)亚型,VGSCs在疼痛中起着关键作用,河豚毒素具有高度选择性可阻断VGSCs超蛋白家族,使其在缓解疼痛方面有潜在作用[11]。因此经过提纯的TTX也常用于镇痛、镇静和麻醉等神经性病患的治疗[12]。
河豚毒素的生产最早起源于日本,1909年田原良纯以红鳍东方鲀的卵巢首次提取出河豚毒素粗品,并命名为河豚毒素(Tetrodotoxin)。1950年,一些日本学者横尾晃、津田恭介、河村正郎等也相继分离出河豚毒素[13]。1958年我国上海水产研究院开始相关TTX的提取工作。70年代末,由解放军药物化学研究所与河北省水产研究所合作共同研制出生产TTX的新工艺[14]。随着TTX的进一步研究,Noguchi[15]等从石灰藻及毒蟹中分离出能产生TTX的细菌。Thuesen[16]和Wu[17]等人也从携带河豚毒素的生物体内分离到越来越多的产毒菌株。Yasumoto[18]等人利用微生物发酵法生产得到TTX,岳田芳等人[19]利用海藻希瓦氏菌(Shewanellaalga)发酵得到TTX。发酵法通过产毒菌株代谢来获得TTX,在一定程度上是节省资源,减少了对环境和生态系统的破坏,但是细菌生产的TTX产量低,不能工业化发酵生产。2019年日本的Keigo Murakami等人通过一系列化学合成了一种TTX[20],但TTX同系物种类多,结构复杂,目前人工合成TTX的方法操作难度大,合成经验不足,尚不能推广应用。TTX纯品生产工艺复杂,产量低,价格昂贵,限制了河豚毒素在医疗等领域的推广应用。本文以假睛方鲀肝脏为原料,对肝脏中的河豚毒素进行粗提,在中性氧化铝、活性炭、离子交换树脂和Bio-Gel P2凝胶柱中选取合适的纯化柱对河豚毒素粗提液进行在分离纯化,确定分离纯化过程中柱子的最适pH、洗脱液浓度,回收率等条件,研究出一种操作简单,成本低廉,更容易大量得到河豚毒素的工艺流程。
1 材料与方法
1.1 材料与试剂
假睛东方鲀(Takifugupseudommus),2018年采购于浙江舟山、温州等地。经浙江省海洋水产研究所专家对假睛方鲀进行确认后,将鱼体解剖取出肝脏,用干净无污染的绞肉机将肝脏混合搅拌均匀后,保存在-20 ℃冷库中备用。
河豚毒素标准品,TTX免疫亲和柱(3 mL),江苏美正生物科技有限公司;乙腈、甲醇,Merck德国;乙酸铵、甲酸,Sigma美国;乙酸、十二水合磷酸氢二钠、二水和磷酸二氢钠、氯化钠、氢氧化钠、中性氧化铝,AR上海国药集团;CM-High Performance离子交换树脂(简称CM HF),武汉晶诚生物科技有限公司;HILIC亲水树脂,天津艾杰尔科技有限公司;Bio-Gel P2凝胶,美国Bio-Rad公司;D152离子交换树脂,上海一基实验有限公司;活性炭粉末(目数:200)。
1.2 仪器和设备
ACQUITY超高效液相色谱-质谱仪Quattro Premier XE,美国Waters公司;氮吹仪、MS2涡旋混合器,德国IKA公司;20通道固相萃取装置,美国Supelco公司;Centrifuge5810高速离心机,德国Eppendorf公司;冷冻干燥机,美国LABCONCO公司;层析柱,武汉晶诚生物科技有限公司;旋转蒸发仪,瑞士Buchi公司;Waters 600 Controller,美国Waters公司。
1.3 方法
1.3.1 标准溶液的配置
称取5.00 mg TTX标准品,用0.10%甲酸乙腈-水溶液1:1(V/V)溶解并定容至50 mL,得到浓度为100 μg/mL的标准储备液,-20 ℃避光保存。用0.10%甲酸乙腈-水溶液1:1(V/V)对储备液逐级稀释,得到100、50、20、10、5、2 ng/mL的标准曲线工作溶液。
1.3.2 TTX提取方法
取匀浆好的肝脏20 g,按液料比1:3(V/W)加入1%乙酸甲醇60 mL,涡旋振荡5 min,在60 ℃恒温水浴锅内提取20 min,水浴过程中每5 min取出震荡一次,待样品冷却至室温,7000 r/min高速离心6 min,取上清液,55 ℃下旋蒸至体积不再变化,得到假睛方鲀肝脏的粗提液。
1.3.3 样品的纯化
取100 μg/mL的TTX标准溶液,用1 M氢氧化钠分别将pH调为3、4、5、6、7、8,将中性氧化铝柱(2 g)、活性炭柱(2 g)、CM HF和D152弱酸性阳离子交换树脂树脂(2 g)的4种柱子分别用两个柱体积的纯净水活化,随后取1 mL上述TTX标准溶液(100 μg/mL)进行上样吸附,收集每个组分的淋洗液,用高效液相色谱法-串联质谱法测定其中TTX含量,计算四种柱子在不同pH值下的吸附率。
将装好的中性氧化铝柱(20 g)、活性炭柱(20 g)、CM HF(20 g)和D152(20 g)净化柱用纯水平衡12 h。取TTX标准溶液(100 μg/mL)10 mL用氢氧化钠(1 mol/L)调pH后上样,流速为1 min/L。上样结束后,先用纯净水淋洗两个柱体积,然后用1%~4%的乙酸水溶液进行梯度洗脱,分别洗脱两个柱体积,流速为1 mL/min,收集洗脱液,每2 mL收集一次。最后用高效液相色谱-串联质谱法测定不同浓度洗脱液中TTX含量,并计算TTX在中性氧化铝柱、活性炭柱、CM HF离子交换柱和D152离子交换树脂柱中的回收率。
1.3.4 色谱及质谱条件
色谱柱:Waters ACQUITY UPLC BEH Amide柱(50 mm×2.1 mm,1.7 μm);柱温:40 ℃;初始流动相(A:B=1:9)A:0.10%甲酸的5 mmol/L乙酸铵溶液,B:乙腈;样品室温度:10 ℃;进样体积:10 μL;洗脱方式:梯度洗脱(0~0.50 min,10% A,90% B;1.50~4 min,60% A,40% B;4.50~5 min,10% A,90% B),流速:0.30 mL/min。
质谱条件:电喷雾离子源正离子扫描(ESI+);多反应检测模式;毛细管电压:3.50 kV;脱溶剂气温度:385 ℃;离子源温度;119 ℃;锥气孔:高纯氮气,流速55 L/h;脱溶剂气:高纯氮气,流速800 L/h;TTXm/z320→m/z302.10;锥孔电压:30 V;碰撞能量:25 V。
1.3.5 数据处理
TTX含量以高效液相色谱法检测,吸附率和回收率曲线由Origin 9进行绘制。吸附率和回收率按下列公式计算[21]:

式中:M:TTX的吸附率;m0:TTX上样液浓度;m1:TTX上样接收液浓度;N:洗脱液回收率;n1:TTX上样液浓度;n2:柱子洗脱液浓度。
2 结果与分析
2.1 上样液pH对不同柱子吸附率的影响
如图1所示,中性氧化铝柱在酸性条件下吸附率仅为35%左右,酸性条件下TTX不能吸附在中性氧化铝上,随着pH值的增大,中性氧化铝的吸附能力变大,pH值为中性时,吸附率最大为86.42%;当pH=3时,活性炭的吸附率最低,几乎不吸附,随着pH的增大,河豚毒素在极性变小,活性炭对TTX得吸附量逐渐增加,在pH=7时吸附率最大为92.73%。CM HF离子交换柱对TTX的吸附率也随pH值的增大而增大,在pH=7时最大为90.15%。D152柱在pH=3时对TTX的吸附率较低,pH=5时,达到最大吸附率为91.97%,当pH继续增大,吸附力变小。综上所述,中性氧化铝柱、活性炭柱、CM HF和D152离子交换柱的最高吸附率分别为86.42%、92.73%、90.15%、91.97%,而此时四种柱子吸附率最高时与之相应的上样液pH分别为7、7、7、5。因此,为保证上述四种柱子能够最大吸附TTX,上样时中性氧化铝柱、活性炭柱和CM HF离子交换柱应将pH调为7,D152离子交换柱上样液pH应调为5。
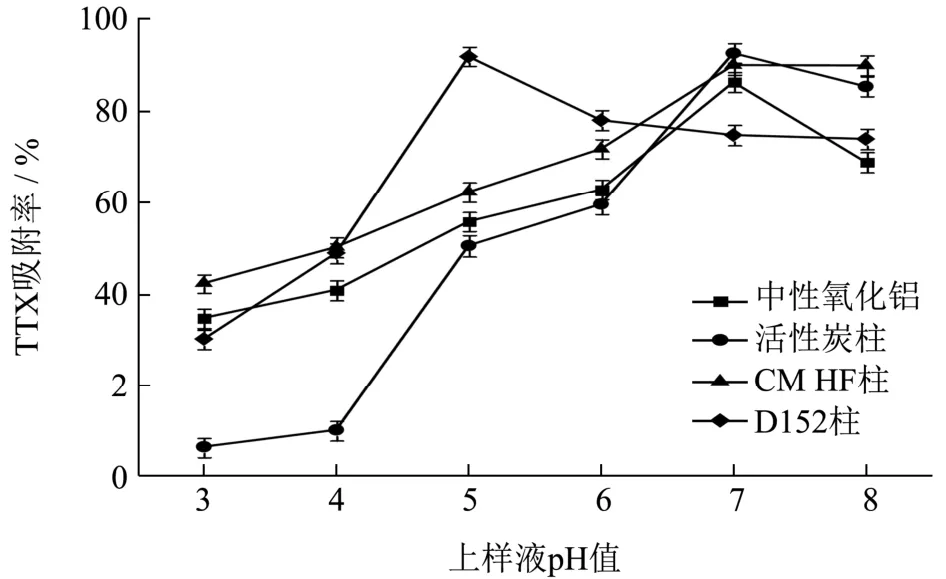
图1 四种柱子在不同pH中的吸附率Fig.1 Adsorption rates of the four columns at different pH
2.2 不同净化柱对TTX回收率条件的影响
假睛东方鲀肝脏粗提液中基质复杂,含有大量的蛋白质、色素、油脂等大分子杂质,需要通过层析柱的处理,对河豚毒素粗提液进行分离纯化,去除色素、蛋白质等其他杂质,得到目标物质。本实验比较了TTX溶液分别在中性氧化铝柱、活性炭柱、CM HF和D152离子交换柱净化时的效果,确定不同柱子在洗脱时洗脱液的乙酸浓度,并根据洗脱液回收率选择适合纯化河豚毒素的柱子。如图2所示,中性氧化铝柱在乙酸浓度为2%~3%区间被洗脱出来,在洗脱液为2%乙酸溶液时存在一个较大的洗脱峰,当洗脱液乙酸浓度为3%时仍有少量TTX被洗出,计算得到中性氧化铝柱纯化时TTX的总回收率为78.75%;图3为活性炭柱纯化时TTX的回收率曲线图,由图可知,当洗脱液的为2%乙酸溶液时存在一个洗脱峰,计算活性炭柱的回收率为88.57%,且在洗脱过程中发现有部分活性炭会进入洗脱液中,增加后续实验难度;图4为CM HF柱纯化时洗脱曲线,由图可知TTX在洗脱液浓度为在1%乙酸溶液时较多洗脱出来,洗脱液乙酸浓度为2%乙酸溶液时仍有部被洗脱出来,当浓度继续增加不再有TTX洗脱下来,计算CM HF柱纯化时的总回收率为83.13%;根据图5中D152离子交换柱洗脱曲线图可知,TTX在乙酸浓度为3%~4%存在洗脱峰,且测得洗脱液中TTX的总回收率总93.98%。综上所述,D152离子交换柱在在四种柱子中的回收率最高,洗脱液浓度为3%~4%乙酸溶液,活性炭柱的回收率次之为88.57%,为减少纯化过程中有效物质的损失,D152离子交换柱和活性炭柱更符合纯化柱的选择。中氧化铝柱和CM HF柱的回收率较低,吸附率也较低,纯化过程中容易造成有效物质的流失,降低纯化效率,增加纯化成本,因此不考虑后两者进行纯化。

图2 中性氧化铝柱TTX洗脱曲线图Fig.2 TTX elution diagram of neutral alumina column

图3 活性炭柱TTX洗脱曲线图Fig.3 TTX elution diagram of activated carbon column

图4 CMHF离子交换柱TTX洗脱图Fig.4 TTX elution diagram of activated carbon column

图5 D152离子交换柱TTX洗脱曲线图Fig.5 TTX elution diagram of D152 ion exchange column
2.3 实际样品的验证

表1 不同型号柱子测定结果对比Table 1 The measurement results of different types of columns were compared
根据表1可知,活性炭柱的吸附率最高,D152柱的吸附率次之,但对比两者解吸率D152柱的洗脱能力更强一些,且活性炭柱在洗脱过程中会引入新的杂质,增加了纯化的难度。在实际应用中,净化柱的吸附率和洗脱率越高,其有效成分损失越少,分离效率越高,降低了生产成本。综合以上因素,选用D152离子交换柱作为河豚毒素粗提液的纯化。
河豚毒素具有镇痛、麻醉等作用,在医学领域有重要作用,但目前河豚毒素纯品稀少,且价格昂贵,使河豚毒素应用受到限制。目前河豚毒素的生成方法主要有海洋细菌生物合成法[22]、人工合成法[23]和以河鲀鱼为原料的提取分离法。但微生物生产的TTX含量低且存在副产物较多,目前应用于实际生产较为困难;人工合成技术难度较大,且该技术尚未成熟,应用推广难度大,尚不适合工业推广。目前市场河豚毒素的主要来源还是从有毒河鲀中提取和纯化得来的。本实验选取匀浆好的假睛东方鲀肝脏10 g,按照1.2.3步骤进行提取,将粗提液调pH,然后用D152离子交换柱纯化得到洗脱液,最后对洗脱液浓缩,用8%~10%的氨水调节pH至中性,有白色固体析出,将白色固体洗涤3遍,进行冷冻干燥,得到TTX粗品(粗品中含TTX及同系物),纯度达80%。将纯化后的河豚毒素样品通过超高效液相色谱柱检测,由图6可知纯化后的河豚毒素粗品与河豚毒素标准品保留时间相同,是目标产物。

图6 河豚毒素液相色谱图Fig.6 Liquid chromatography of tetrodotoxin
3 结论
本实验利用层析技术对河豚毒素进行分离纯化,比较了中性氧化铝柱、活性炭柱、CM HF柱和D152弱酸性阳离子交换柱分别对河豚毒素的纯化效果,最终确定D152离子交换柱作为河豚毒素粗提液的纯化柱,其中D152柱的上样液最适pH为3,洗脱液为3%~4%乙酸水溶液两个柱体积。并且经过实际样品验证得到纯度为80%的河豚毒素粗品。通过一系列的提取,分离纯化等步骤,将肝脏粗提液中的脂类,蛋白质,色素等大分子杂质得以除去,得到白色的河豚毒素粗品。粗品可经过进一步的分离纯化得到TTX纯品及TTX同系物纯品,此项技术有待继续研究。本实验以河鲀鱼肝脏为原料提高资源利用率,减少有毒河鲀鱼造成的环境污染,且实验操作流程简单,成本低廉,富集纯化效果好,为进一步制取河豚毒素纯品提供便捷。
