太子参醇提物的肠道益生及增强抗氧化作用
2021-06-04孔钰婷何洪安凤平宋洪波黄群
孔钰婷,何洪,安凤平,2,宋洪波,2,黄群,2
(1.福建农林大学食品科学学院,福建福州 350002)(2.福建省特种淀粉品质科学与加工技术重点实验室,福建福州 350002)
太子参为石竹科植物孩儿参的块根,全国各地均有种植,主要产自于福建、江苏、贵州等地,具有益气健脾,生津润肺之功效,已被卫计委确定列入 “ 可用于保健食品的中药材名单 ” ,以饮食养生为主的药膳食用习惯更为普遍,具有良好的药用价值和保健作用[1]。已研发生产典型的药品、功能与保健食品有太子参复方颗粒、口服液、养生酒等。随着太子参生物活性研究的不断深入,其在药品和功能食品方面的研究与应用前景广阔。已报道具有环肽、多糖、皂苷、氨基酸等多种活性成分,而关于太子参的功能研究则主要集中在太子参粗提物的心脏保护作用[2]、降血糖[3]、免疫调节[4]和抗疲劳[5]作用,但对肠道功能特性的研究较少有报道。
当机体细胞内的自由基累积到一定程度会破坏机体氧化/抗氧化的平衡,产生氧化应激,生物细胞内DNA、RNA、脂质和蛋白质等生物分子就会发生改变甚至被破坏,如DNA修复机制受到破坏从而增强DNA突变的产生,蛋白结构发生改变从而丧失蛋白质功能等,因此氧化应激与人类系统疾病的发生有着密切联系,而肠道作为物质吸收和能量代谢的主要器官,极易受到自由基攻击造成功能异常,影响机体代谢从而引发多种慢性疾病。许多研究已经证明肠道菌群能影响宿主的氧化/抗氧化水平,益生菌产生的超氧化物、过氧化氢酶及抗氧化代谢物[6],刺激宿主的抗氧化系统,可保护宿主细胞免受氧化应激等多种因素的影响[7],激活抗氧化信号通路[8]。
本研究以太子参为原材料,通过实验室提取与初步纯化得到太子参醇提物,利用D-半乳糖致损动物模型初步研究太子参醇提物提高脏器抗氧化酶活的同时明确其对抗氧化相关肠道菌群具有积极作用。
1 材料与方法
1.1 材料与试剂
太子参购自福建咸康药业有限公司,粉碎过40目备用。清洁级ICR小鼠购自福建医科大学试验动物中心,许可证号为SCXK(闽)2016-0002。
香草醛,α-萘酚阿拉丁试剂(上海)有限公司;冰醋酸,亚硝酸钠,苯酚,国药集团化学试剂有限公司;氯化铝,上海泰坦科技股份有限公司;Rb1标准品,安徽西青果生物科技有限公司;芦丁,北京索莱宝科技有限公司;D101大孔树脂,艾美科健(中国)生物医药有限公司。
D-半乳糖,Sigma公司;注射用生理盐水,福州海王福药制药有限公司;蛋白定量测定试剂盒,总超氧化物歧化酶(T-AOC),谷胱甘肽过氧化物酶(GSH-PX),总抗氧化能力(T-AOC)测定试剂盒,南京建成科技有限公司。
1.2 仪器与设备
UV-1780紫外分光光度计,日本岛津公司;HH-2数显恒温水浴锅,常州国华电器有限公司;N-1100旋转蒸发仪,FDU-1200冷冻干燥机,上海爱朗仪器有限公司;HL-2S恒流泵,上海泸西分析仪器厂有限公司;SpectraMax PLUS酶标仪,美国Molecular Devices公司;MS 3涡旋震荡,德国IKA公司;Heraeus Fresco17离心机,Thermo Fisher Scientific公司;M199型切片刀,德国莱卡仪器(中国)有限公司;BMJ-A包埋机,常州中威电子仪器有限公司;BA210T型显微镜,Motic公司。
1.3 方法
1.3.1 太子参醇提物的制备
粉碎过40目筛的太子参按料液比1:8加入70%乙醇,60 ℃水浴锅中回流提取两次,每次1 h,两次滤液合并于50 ℃旋蒸浓缩至1/4。太子参浓缩液用石油醚萃取后旋蒸去除石油醚,用水补足体积,稀释8倍后上大孔树脂D101,水洗至Molish反应至阴性,30%乙醇洗脱,收集洗脱液减压浓缩,冷冻干燥得粉末。
1.3.2 总糖、黄酮和皂苷含量的测定
1.3.2.1 总糖的测定[9]
采用苯酚-浓硫酸法。取1 mL样品溶液,加5%苯酚1 mL,混匀后加5 mL浓硫酸,混匀,室温避光反应30 min后于490 nm处测定吸光度。以葡萄糖为标品,绘制标准曲线。
1.3.2.2 黄酮的测定
参考Karen Pitura等[10]的方法测定,以芦丁为标准品,绘制标准曲线。
1.3.2.3 皂苷的测定
取适量样品溶液于10 mL具塞试管中,60 ℃水浴挥干溶剂,加入0.2 mL 5%香草醛-冰醋酸溶液,0.8 mL高氯酸,混匀,密塞水浴加热15 min后冰水浴冷却,加入5 mL冰醋酸,摇匀,于560 nm波长处测定吸光度。以人参皂苷Rb1为标准品,绘制标准曲线[11]。
1.3.3 体内抗氧化能力的测定
1.3.3.1 试验动物的分组与试验方法
72只雄性ICR小鼠(20±2 g)适应性喂养3 d后随机分为6组,分别为正常组(NC)、模型组(DG)、阳性对照组(PC)、低剂量组(LPEs)、中剂量组(MPEs)和高剂量组(HPEs),每组12只。除NC组外,其余各组每天颈后背皮下注射1000 mg/kg D-半乳糖致氧化损伤,NC组注射生理盐水。LPEs组、MPEs组和HPEs组小鼠每天50、100、300 mg/kg[12]太子参醇提物灌胃,PC组小鼠每日灌服50 mg/kg Vc,DG组和NC组每日灌胃等体积生理盐水,试验周期为5周[13]。试验期间每天早上8:40~9:40称量体重,观察小鼠的一般体征。所有动物试验均遵照 “ 试验动物护理和使用指南 ” 进行,并得到福建省医科大学动物伦理委员会的审查和批准(编号:FJMUIACUC 2019-0075)。
1.3.3.2 脏器指数的测定
试验周期结束后,小鼠禁食不禁水12~14 h,摘眼球采血后颈部脱臼处死小鼠,迅速取出肝脏、肾脏、脑、脾脏,用预冷的生理盐水冲洗干净后用滤纸吸干,称重。计算公式为:

1.3.3.3 脏器抗氧化酶活性测定
CAT、SOD、GXH-PX和MDA的检测根据南京建成试剂盒说明书的要求进行,对小鼠肝脏、肾脏、脑部匀浆与血清抗氧化酶活性和MDA含量的检测。
1.3.3.4 肝脏切片
将小鼠肝组织用10%中性福尔马林固定然后用乙醇梯度脱水。二甲苯洗脱,然后依次在100%、95%、85%和75%乙醇,依次放置5 min;再用蒸馏水浸洗5 min,石蜡包埋,切片(5 μm)。苏木素对肝组织进行染色5~10 min,蒸馏水冲洗,伊红染3~5 min,蒸馏水冲洗;梯度酒精(95%~100%)脱水,取出后置于二甲苯10 min,重复操作2次,中性树胶封片,显微镜下放大100倍观察。
1.3.3.5 小鼠盲肠内容物的微生物分析
试验周期结束后,无菌环境取出小鼠盲肠内容物装入无菌冻存管,液氮速冻后置-80 ℃保存。使用TIANamp Stool DNA kit试剂盒从小鼠盲肠内容物中提取微生物总DNA,对16S rDNA基因V3V4区进行扩增。扩增体系:5×reaction buffer 5 μL,5×GC buffer 5 μL,Dntp 2 μL,正向引物1 μL,反向引物1 μL,DNA模板2 μL,ddH2O 8.75 μL,Q5 DNAPolymerase 0.25 μL。PCR扩增参数:初始变性98 ℃ 2 min,变性98 ℃ 15 s,退火55 ℃ 30 s,引物延伸72 ℃ 30 s,延伸72 ℃ 5 min, 10 ℃ Hold,25~30个循环,利用IlluminaMiSeq平台对群落DNA片段进行双端测序。
1.3.3.6 小鼠小肠组织形态
小心取出小肠,用预冷的生理盐水将内容物冲洗出来后放入中性福尔马林,用于病理切片分析。
1.2.3.7 数据统计分析
利用DPS 7.5软件进行统计分析,测定结果以x±s(平均值±标准差)表示。采用单因素方差分析并用LSD法进行多重比较。
2 结果与分析
2.1 太子参醇提物总糖、黄酮和皂苷的含量
从表1可以看出,经大孔树脂D101富集、30%乙醇的洗脱物中,主要含有皂苷类、黄酮类和糖类物质,其中皂苷类物质含量达到613.48 mg/g干物质。

表1 太子参醇提物总糖、黄酮、皂苷的含量(mg/g干物质)Table 1 Total sugar, saponin and flavonoids in the extract of radix pseudostellariae
2.2 小鼠体重和生长状况
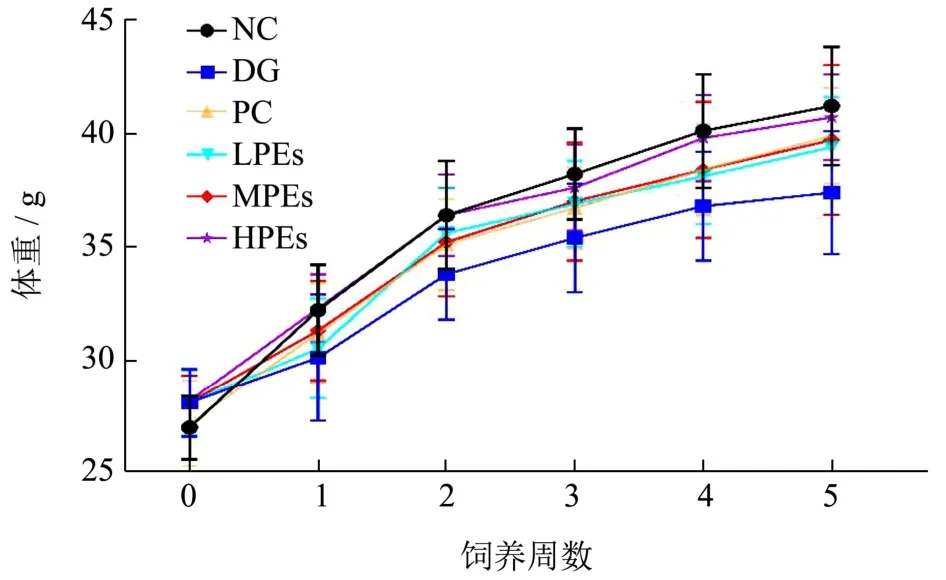
图1 太子参醇提物对小鼠体重变化的影响Fig.1 Effects of PEs on body weight changes of mice
如图1所示,各组小鼠经适应喂养后体重稳定,未见显著差异(0周)。随着试验的进行,DG组与各试验组小鼠体重开始逐渐产生差异,表现为行动迟缓、毛发枯燥缺少光泽,说明皮下注射D-半乳糖对小鼠生长会造成一定影响[13]。试验第5周时,NC组和PC组体重为41.20 g和39.20 g,经低、中、高剂量太子参醇提物喂养小鼠的体重分别为39.40 g、39.70 g和40.60 g,而DG组为38.60 g,说明灌胃太子参醇提物和Vc对模型小鼠生长缓慢具有明显促进作用。
2.3 脏器指数
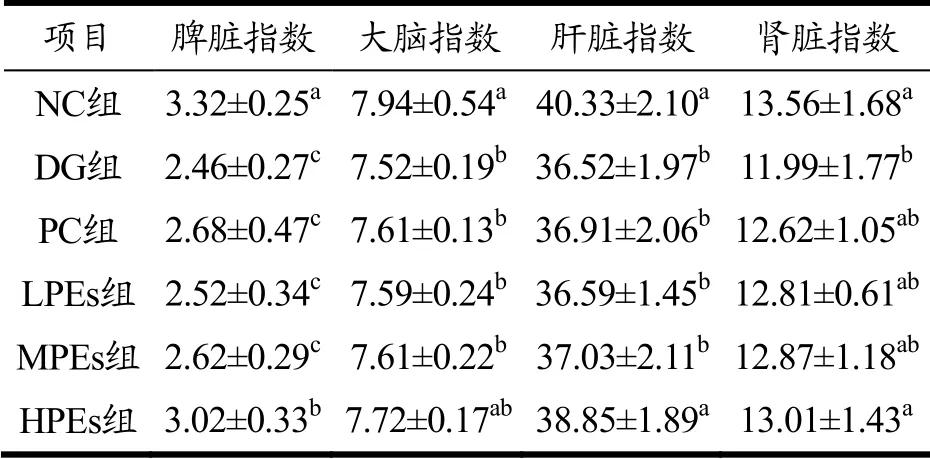
表2 小鼠各脏器指数的测定结果(mg/g)Table 2 The determination of organ index in mice (mg/g)
由表2可知,与NC组相比,DG组小鼠各脏器指数显著降低,说明皮下注射D-半乳糖小鼠确实发生了机体损伤。通过灌胃Vc和太子参醇提物均可提高致损小鼠的脏器指数,其中高剂量效果显著(p<0.05),与DG组相比,分别提高了22.76%(脾脏)、2.66%(大脑)、6.38%(肝脏)和8.51%(肾脏),基本达到了正常水平,效果好于Vc。PC组各脏器指数与DG组差异不显著,其原因有待进一步研究。
2.4 体内抗氧化酶活和MDA含量
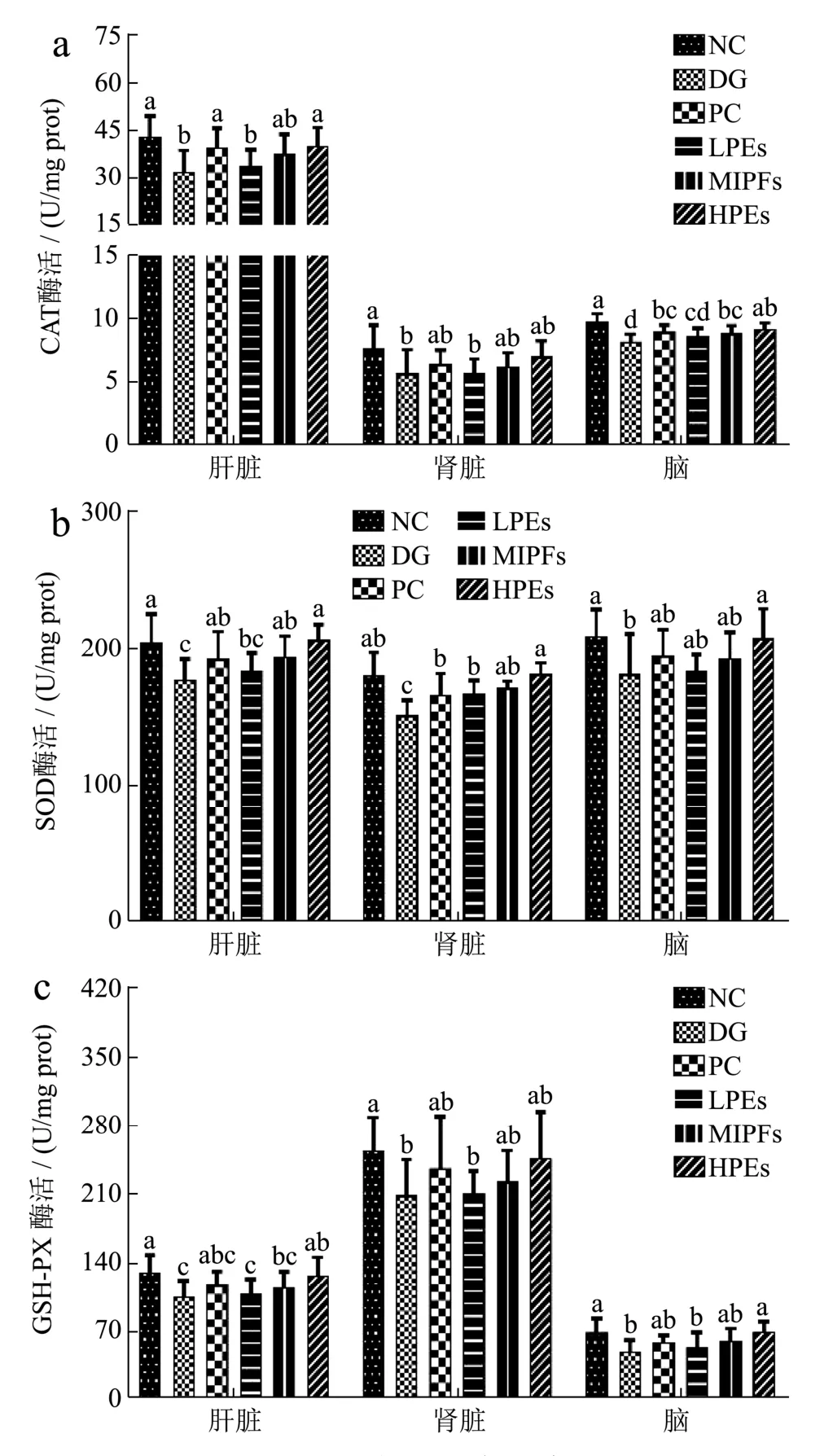
图2 小鼠脏器中抗氧化酶活Fig.2 Effects of PEs on antioxidant activity in organ tissues of mice
如图2所示,DG组小鼠各脏器组织中CAT、SOD和GSH-PX活力均显著低于NC组,表明皮下注射D-半乳糖能使小鼠体内抗氧化水平降低。各剂量组小鼠CAT、SOD和GSH-PX活力均有所提升,其中HPEs组肝脏、肾脏和脑组织中的CAT活力均达到正常水平,MPEs组与HPEs组之间无显著差异。中、高剂量组肝脏、肾脏和脑组织中CAT酶活达到或超过PC组的CAT酶活水平。与DG组相比,三个剂量组各器官的SOD酶活均有不同程度上升,其中HPEs组肝脏、肾脏和脑部SOD酶活分别提高16.64%,19.94%和14.55%,低中剂量的太子参醇提物即可达到Vc效果,而HPEs组肾脏中SOD酶活显著高于PC组,因此高剂量太子参醇提物增强各脏器SOD酶活的能力显著强于Vc。PC组GSH-PX酶活与NC组相比无显著性差异(p>0.05),LPEs组小鼠肝脏、肾脏和脑部的GSH-PX酶活高于DG组,但差异不显著,MPEs组的效果好于LPEs组;HPEs组小鼠肝脏、肾脏和脑部的GSH-PX酶活与正常组无显著性差异。与张振明等[14]研究结果类似,由此可见太子参醇提物对D-半乳糖致损伤小鼠的抗氧化能力的改善明显量效关系,高剂量太子参醇提物的效果优于Vc。
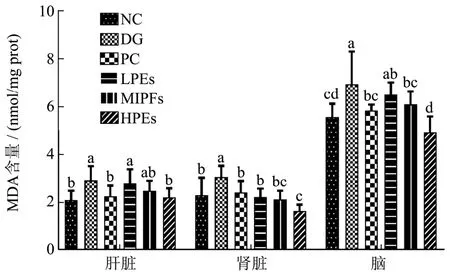
图3 小鼠脏器中MDA的含量Fig.3 Effects of PEs on MDA content in organ tissues of mice
丙二醛(MDA)含量越高,意味着生物膜受氧化破坏越严重[15]。图3表明,与NC组相比,皮下注射D-半乳糖使得小鼠肝脏、肾脏和脑部的MDA含量显著增加,进行太子参醇提物和Vc进行干预后,与DG组相比各脏器内MDA含量均有不同程度下降,其中MPEs、HPEs组各器官MDA含量可恢复至正常水平,总体上HPEs组清除MDA的效果要好于Vc。这进一步表明高剂量太子参醇提物抗氧化能力优于Vc。
2.5 肝脏组织切片
肝脏是参与D-半乳糖代谢的主要器官,过量D-半乳糖可增加活性氧(ROS)的产生,可能导致器官损伤[16]。从图4a可以看出NC组小鼠的肝脏细胞结构具有正常的中心静脉和肝细胞,核大而圆;图4b显示DG组肝组织有大量脂肪泡蓄积,肝小叶结构不明显,说明肝脏出现异常[17]。PC组和太子参醇提物干预各组肝组织情况较DG组好,胞质丰富,脂肪蓄积减少,肝小叶结构清晰,肝血窦以中央静脉为中心呈均匀的散状分布,肝组织形态得到不同程度的恢复,其中HPEs组肝组织情况与NC组接近,说明高剂量太子参醇提物对氧化应激造成的肝脏组织损伤修复效果好。
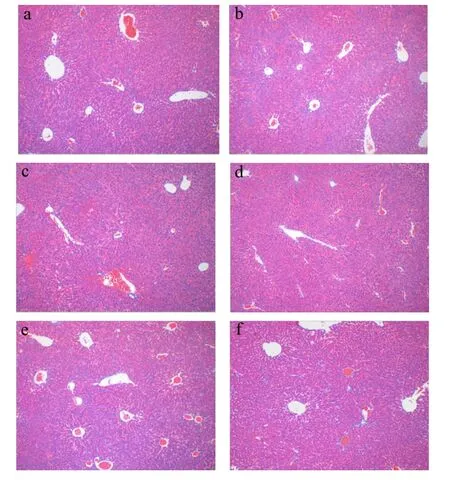
图4 小鼠肝脏组织切片Fig.4 Tissue slices of mice liver
2.6 UPGMA聚类分析
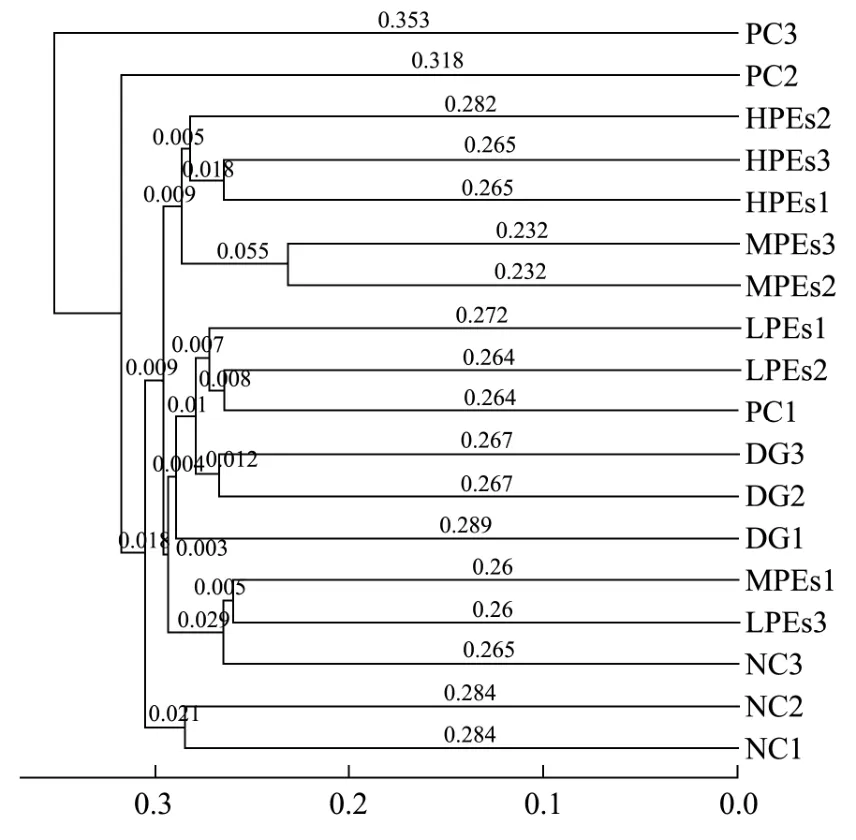
图5 基于Unweighted UniFrac距离矩阵的UPGMA聚类分析图Fig.5 UPGMA clustering analysis based on unweighted UniFracdistance matrix
通过比较不同样品间Unifrac距离的远近来判断其微生物构成的相似性并聚类,从图5所示的聚类分析结果可以发现,除个别样品有重叠外,MPEs组和HPEs组明显成一簇,相似程度高,而DG组与NC组存在分离,说明NC组、DG组与MPEs和HPEs组微生物构成差异较大。
2.7 属水平群落组成热
从图6的上方进化树可以看到,NC、PC和LPEs组聚成一类,MPEs和HPEs组聚成一类,DG组单独聚成一类,表明DG组与各组小鼠肠道菌群结构在属水平上相似程度较低,说明注射D-半乳糖致损对小鼠肠道微生物属水平组成影响较大。在DG组中,甲基杆菌属(Methylobacterium)、阿尔法变形杆菌(Unclassified-Alphaproteobacteria)、普雷沃氏菌属(Paraprevotella)、理研菌属(Rikenella)等为代表的潜在致病菌属含量增加。与DG组相比,HPEs组肠道微生物表现为上调的菌属有拟杆菌属(Parabacteroides)、梭菌属(Anaerotruncus)、另枝菌属(Alistipes)、粪芽孢菌属(Coprobacillus)、S24-7等菌属的丰度,其中Parabacteroides属SCFAs产生菌,可以产生戊酸[18],Anaerotruncus能编码表达合成丁酸盐所需要的酶[19],Alistipes可能具有预防和治疗如结肠直肠癌等肠道疾病的潜力[20],相对于其他肠道微生物具有更强的金属抗性[21],而S24-7属于丁酸盐产生菌[22]。MPEs组上调Bifidobacterium、Bacteroides和Prabacteroides,其中Bacteroides为肠道优势厌氧菌,能帮助宿主分解多糖[23],与摄入党参能提高Bacteroides的研究结果类似[24]。LPEs组盲肠微生物表现为上调Odoribacter、梭菌属(Clostridium)和普氏菌属(Prevotella)。Clostridium可以合成强抗氧化剂3-吲哚丙酸(色氨酸脱氨的产物),消除D-半乳糖产生的自由基从而保护大脑免受氧化伤害;而Prevotella可提高SCFAs的合成速率,增强对组蛋白去乙酰化酶和G蛋白偶联受体的抑制作用并减少脑损伤[25]。作为主要益生菌,双歧杆菌(Bifidobacterium)和乳杆菌(Lactobacillus)能改善健康人的总抗氧化状态并降低氧化应激指标[26]。有报道人参中的多糖能够改善某些人参皂苷的肠道生物转化,同时改善肠道菌群的紊乱情况,特别是促进Lactobacillus和Bacteroides生长[27]。本文也有类似试验结果,特别是与NC组相比,小鼠注射D-半乳糖后肠道Bifidobacterium和Lactobacillus相对丰度明显降低,喂食Vc以及高剂量太子参醇提物显著增加了Bifidobacterium和Lactobacillus的丰度。益生菌的代谢活动可通过清除氧化剂化合物或阻止其在肠道中的生成发挥抗氧化作用[28]。
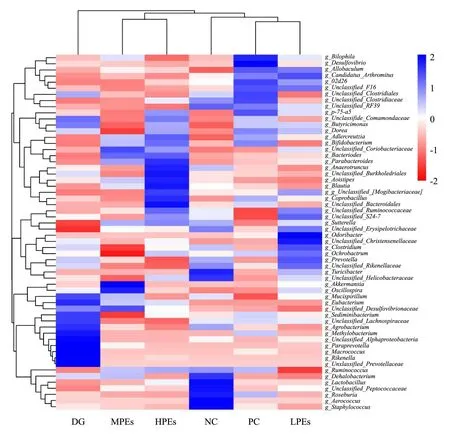
图6 结合聚类分析的属水平群落组成热图(丰度前60菌属)Fig.6 Heat map of genera-level community based on the cluster analysis (relative abundant Top 60)
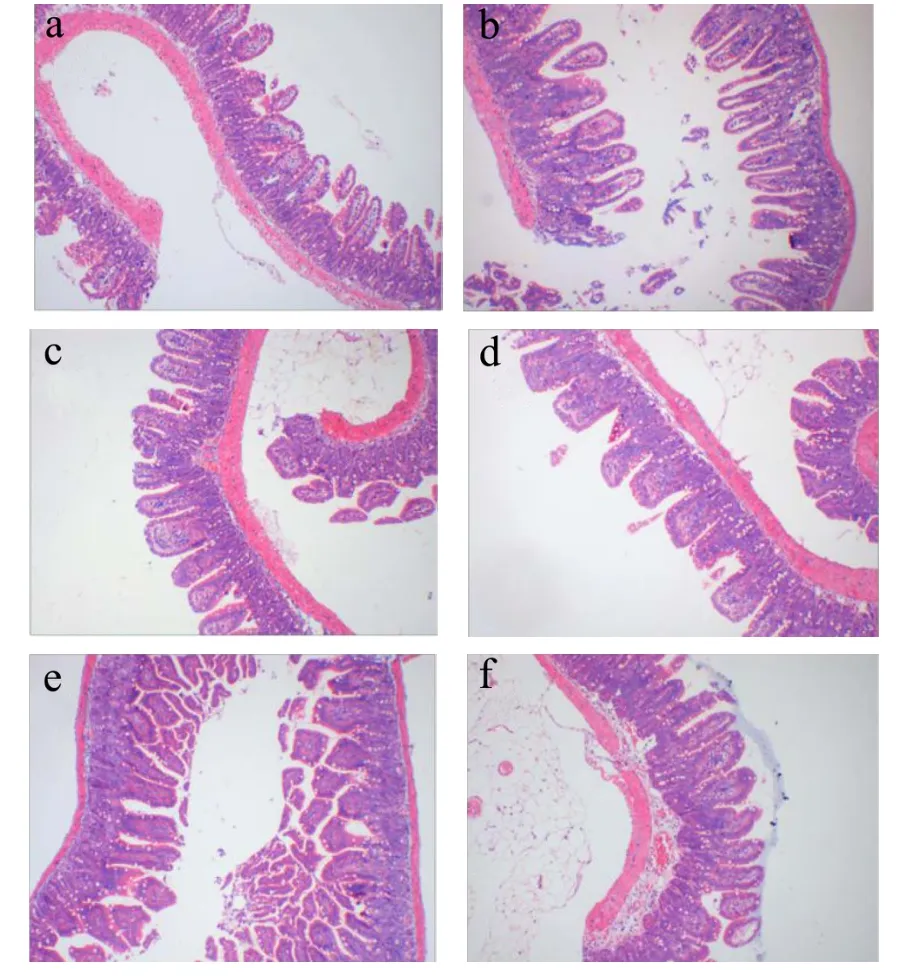
图7 小鼠小肠组织切片图Fig.7 Intestinal tissue sections of mice
2.8 小肠组织切片
肠粘膜的完整性受损易使肠内微生物易位进入淋巴系统[29],更多有害的致病菌会粘附在肠道上皮,与Bifidobacterium和Lactobacillus等有益菌竞争。过量的ROS会减少肠道粘液层厚度,粘液松散会大大降低粘液屏障的保护作用[30]。Bifidobacterium和Lactobacillus均已被证明具有降低动物肠道内毒素水平和改善粘膜屏障功能[31]。从图7小肠切片图可见,NC组小肠组织学形态呈正常状态,绒毛排列致密,肠绒毛结构完整;DG组绒毛排列较稀疏,绒毛顶部有萎缩现象,说明肠绒毛结构出现异常;PC组较DG组的粘膜损伤情况有所恢复,但绒毛呈短锥状,分支仍较少。随着太子参醇提物剂量的增加,粘膜损伤逐渐修复,图7f所示HPEs组小鼠小肠绒毛损伤情况明显恢复,致密程度恢复接近正常水平。
3 结论
本研究表明,太子参醇提物在一定程度上能增强D-半乳糖模型鼠的抗氧化能力。通过脏器指数、抗氧化酶活、肝脏组织形态、小肠微生物等指标进行评价,结果表明太子参醇提物能改善D-半乳糖模型鼠生长迟缓的情况,显著提高小鼠肝脏、肾脏和脑部的CAT、SOD和GSH-PX酶活,降低MDA含量,保护肝脏组织免受氧化损伤,小鼠体内总抗氧化能力提高。同时,该太子参醇提物能有效提高小肠内容物中Bifidobacterium、Lactobacillus、Bacteroides和Blautia相对丰度,降低Unclassified-Alphaproteobacteria、Rikenella属等相对丰度,盲肠绒毛致密程度恢复接近正常水平,肠道总体患病风险降低,使得机体总体抗氧化水平得到提高。
