山楂核各萃取组分对H2O2诱导氧化损伤细胞保护作用的比较及活性组分筛选
2021-06-04彭颖胡洁品刘峰张敏彭崇胜李晓波
彭颖,胡洁品,刘峰,张敏,彭崇胜,李晓波
(上海交通大学药学院,上海 200240)
山楂(Crataegus pinnatifidaBunge)为蔷薇科山楂属植物,俗称山马林果、野婆婆头、山里红。山楂的果实具有较高的营养及药用价值,在食品、医药和工业上具有广泛的应用。山楂核为山楂加工过程中的副产品,约占山楂果实总重的1/3。山楂核药用历史悠久,在《滇南本草》中记载其具有消食,散结的功效,归胃、肝经[1]。以往山楂核大多在山楂果实加工过程中被丢弃,造成资源的浪费,而近年来山楂核的开发利用越来越受到食品医疗行业的青睐。山楂核干馏油含有大量的醛类、酚类物质[2],已被开发成红核洗液和舒痛精等抑菌镇痛相关产品。与干馏油相比,山楂核醇提物成分有较大的差异[3],具有抗炎[4]、抗肿瘤[5]和降血脂[6]等生物活性。体外抗氧化实验发现,山楂核醇提物具有清除DPPH·、ABTS+·、羟自由基、还原Fe3+、抑制酪氨酸酶的生物活性[7],在抗氧化相关产品开发上具有较强的应用前景。我们前期研究亦证实,除山楂核醇提物外,山楂核醇提物的乙酸乙酯萃取和水萃取组分均具有一定体外清除自由基的活性,并通过UPLC-Q-TOF/MS从山楂核醇提物的乙酸乙酯萃取组分中鉴定出10个成分,主要为木脂素和醛类成分[8],其中木脂素类化合物Hawthornnin G和7S,8R-Ficusal具有清除ABTS和DPPH自由基活性的报道[4]。
生物机体的代谢会产生大量自由基,在遭遇刺激或在病理状态下,自由基产生和消除的动态平衡被打破后,自由基会对蛋白质、核酸、糖类、脂质等生物大分子的结构和功能造成损伤。一些疾病的产生,例如癌症、神经退行性疾病、糖尿病、白内障、炎症等都与自由基有关[9]。表皮是皮肤的第一道屏障,主要由棘层、颗粒层和位于表皮最外层的角质层组成,表皮受到外界的一些刺激,例如紫外线、氧化因子等会形成氧化应激,参与皮肤老化、炎症性皮肤病、表皮肿瘤等一系列皮肤疾病[10,11]。外源性H2O2可引起氧化应激,增加细胞内活性氧的种类。HaCaT细胞是永生化的人角质形成细胞,常用于构建表皮模型,其氧化损伤后会产生大量ROS,引发细胞的衰老、凋亡,而SOD和GSH-Px是机体内清除自由基的酶,是维持机体氧化平衡的重要成分。此外,氧自由基被认为在胃炎或胃癌的形成和发展中起着重要的作用[12,13]。GES-1细胞是人胃黏膜上皮细胞,是胃黏膜遭受外界刺激的第一道屏障,常用于构建胃黏膜保护作用筛选模型。为进一步开发利用山楂核资源,发掘山楂核抗氧化方面的新应用,本研究通过建立H2O2诱导的HaCaT和GES-1细胞氧化损伤模型,比较山楂核醇提物及其不同萃取组分对H2O2诱导氧化损伤的HaCaT和GES-1细胞的保护活性,以期为山楂核抗过氧化皮肤衰老和胃黏膜保护等方面的开发提供科学依据,为山楂核种子资源的开发和综合利用提供数据支持。
1 材料与方法
1.1 原料与试剂
人永生化HaCaT细胞:北京北纳创联生物科技有限公司;GES-1细胞:上海中乔新舟生物科技有限公司;山楂核:由山西振东制药有限公司提供。噻唑蓝(Thiazoyl blue tetrazolium bromide,MTT)、二甲基亚砜(Dimethyl sulfoxide,DMSO)、双氧水:美国sigma公司;胰酶、北美胎牛血清:美国Gibco公司;DMEM培养基、磷酸缓冲盐溶液(Phosphate buffer saline,PBS)、双抗:美国Hyclone公司;SOD试剂盒、GSH-Px试剂盒、BCA试剂盒:南京建成科技有限公司。
1.2 主要仪器设备
BS-500A电子分析天平:赛多利斯科学仪器有限公司;LD2X-30KBS立式压力蒸汽灭菌器:上海申安医疗器械厂;3020-910酶标仪:美国赛默飞世尔公司;SB-5200超声波细胞粉碎机:宁波新芝生物科技股份有限公司;5418高速离心机:德国EPPENDORF股份公司。
1.3 实验方法
1.3.1 山楂核醇提物及其不同萃取组分制备
7 kg山楂核粉碎过1号筛。按料液比1:10加入95%的乙醇回流提取,80 ℃恒温回流提取3次,每次3 h,过滤,合并滤液,减压干燥得山楂核醇提取物浸膏(EE)。上述提取物浸膏与水混悬,依次用石油醚、乙酸乙酯、正丁醇萃取,得到山楂核醇提物石油醚萃取组分(PEF)、乙酸乙酯萃取组分(EAF)、正丁醇萃取组分(BF)和水萃取组分(WF),经减压干燥后保存于4 ℃。
1.3.2 氧化损伤细胞模型造模条件考察
取对数生长的HaCaT细胞,配置成1×105个/mL的细胞溶液,每孔100 μL接种到96孔板中。当细胞铺满96孔板的80%时,换液,继续培养12 h。实验组加入100 μL的H2O2溶液作用于HaCaT细胞,H2O2终浓度为0.20、0.18、0.14、012、0.10、0.08 mg/mL,空白组加入100 μL的培养基。培养4 h后,采用MTT法检测细胞活力并计算细胞存活率[14],将存活率在50%左右的H2O2浓度作为HaCaT细胞造模浓度。取对数生长的GES-1细胞,配置成8×104个/mL的细胞溶液,每孔100 μL接种到96孔板中。当细胞铺满96孔板的80%时,换液,继续培养24 h。实验组加入100 μL的H2O2溶液作用于GES-1细胞,H2O2终浓度为0.20、0.18、0.16、0.14、0.10 mg/mL,空白组加入100 μL的培养基。培养4 h后,采用MTT法检测细胞活力并计算细胞存活率,将存活率在50%左右的H2O2浓度作为GES-1细胞造模浓度。
1.3.3 不同样品对细胞毒性考察
将1×105个/mL的HaCaT细胞溶液接种到96孔板中,每孔100 μL,当细胞铺满96孔板的80%时,给药组加入配置好的250、125、62.5 μg/mL的山楂核醇提物及其不同萃取组分,每孔100 μL,空白组加入100 μL的培养基。培养16 h后,采用MTT法检测细胞活力并计算细胞存活率,存活率大于90%的浓度为安全浓度。将8×104个/mL的GES-1细胞溶液接种到96孔板中,每孔100 μL,当细胞铺满96孔板的80%时,给药组加入250、125、62.5 μg/mL浓度的山楂核醇提物及其不同萃取组分,每孔100 μL,空白组加入100 μL的培养基。培养28 h后,采用MTT法检测细胞活力并计算细胞存活率,存活率大于90%的浓度为安全浓度。
1.3.4 不同样品对氧化损伤细胞存活率的考察
将1×105个/mL的HaCaT细胞溶液接种到96孔板中,每孔100 μL。当细胞铺满96孔板的80%时,给药组加入50、25、12.5 μg/mL的山楂核醇提物及其不同萃取组分作用于HaCaT细胞,每孔100 μL,模型组和空白组加入等体积的培养基,阳性药组加入50 μg/mL维生素C。继续培养12 h后,除空白组外其余各组加入终浓度为0.12 mg/mL的H2O2,4 h后采用MTT法检测细胞活力并计算细胞存活率。将8×104个/mL的GES-1细胞溶液接种到96孔板中,每孔100 μL。当细胞铺满96孔板的80%时,给药组加入50、25、12.5 μg/mL的山楂核醇提物及其不同萃取组分作用于GES-1细胞,每孔100 μL,模型组和空白组加入等体积的培养基,阳性药组加入50 μg/mL维生素C。继续培养24 h后,除空白组外其余各组加入终浓度为0.2 mg/mL的H2O2,4 h后采用MTT法检测细胞活力并计算细胞存活率。
1.3.5 细胞中SOD和GSH-Px水平的检测
将1×105个/mL的HaCaT细胞溶液接种到6孔板中,每孔2.5 mL。当细胞铺满6孔板的80%时,给药组加入不同浓度的山楂核醇提物中的活性组分样品作用于HaCaT细胞,每孔2.5 mL,模型组和空白组加入等体积的培养基,阳性药组加入等体积的50 μg/mL维生素C。12 h后,除空白组外其余各组加入终浓度为0.12 mg/mL的H2O2,4 h后超声破裂后取细胞内液,按照GSH-Px和SOD试剂盒说明进行操作。将8×104个/mL的GES-1细胞溶液接种到6孔板中,每孔2.5 mL。当细胞铺满6孔板的80%时,给药组加入不同浓度的山楂核醇提物中的活性组分样品作用于GES-1细胞,每孔2.5 mL,模型组和空白组加入等体积的培养基,阳性药组加入等体积的50 μg/mL维生素C。24 h后,除空白组外其余各组加入终浓度为0.2 mg/mL的H2O2,4 h后超声破裂后取细胞内液,按照GSH-Px和SOD检测试剂盒说明进行操作。
1.3.6 山楂核醇提物中活性组分大类成分含量测定
将EAF溶于DMSO中,配制成5 mg/mL作为供试品溶液。将WF溶于超纯水中,配制成10 mg/mL作为供试品溶液。参考文献方法[15]以没食子酸为对照品,采用福林酚比色法测定供试品溶液中多酚含量。参考文献方法[16]以芦丁为对照品,采用亚硝酸钠-硝酸铝-氢氧化钠比色法测定供试品溶液中黄酮含量;以葡萄糖为对照品,采用苯酚-硫酸比色法测定供试品溶液中多糖含量;以半乳糖醛酸为对照品,采用间羟基联苯法测定供试品溶液中糖醛酸含量。参考文献方法[17]以蛇菰宁为对照品,采用紫外分光光度法测定供试品溶液中总木脂素含量。供试品溶液中蛋白质含量测定采用考马斯亮蓝法,按照试剂盒说明书方法进行测定。
1.3.7 数据处理与分析
数据以Mean±SD表示,采用SPSS 22软件进行统计分析,组间比较用ANOVA检验。p<0.05认为具有显著性差异。实验数据绘图由Graph Prism 7.00软件完成。
2 结果与讨论
2.1 H2O2诱导HaCaT细胞和GES-1细胞氧化损伤模型的建立
如图1a所示,随着造模剂H2O2浓度的增大(0.08 mg/mL增至0.20 mg/mL),HaCaT细胞存活率逐渐降低(90.63%减至36.60%),当H2O2浓度为0.12 mg/mL时,HaCaT细胞相对存活率为50%左右,因此选用0.12 mg/mL的H2O2做为氧化损伤HaCaT细胞的造模剂浓度。
GES-1细胞的存活率和H2O2浓度的关系如图1b所示,随着H2O2浓度的增大(0.10 mg/mL增至0.20 mg/mL),GES-1细胞存活率逐渐降低(108.19%减至51.99%),当H2O2浓度为0.2 mg/mL时,GES-1细胞相对存活率为50%左右,因此选用0.2 mg/mL的H2O2浓度为氧化损伤GES-1细胞的造模剂浓度。

图1 不同浓度的造模剂H2O2对HaCaT细胞(a)和GES-1细胞(b)存活率的影响Fig.1 Effects of different concentrations of H2O2 on the cell viability of HaCaT cells (a) and GES-1 cells (b)
2.2 山楂核醇提物及其不同萃取组分对HaCaT细胞和GES-1细胞的细胞毒性
HaCaT细胞的存活率和样品浓度(250 μg/mL、125 μg/mL和62.5 μg/mL)的关系如图2a所示,山楂核醇提物及其不同萃取组分浓度为62.5 μg/mL时,HaCaT细胞存活率约为91.34%到112.08%间,均大于90%。但随着样品浓度的增大,HaCaT细胞存活率逐渐降低,其中当EE、EFA和WF浓度为250 μg/mL时,HaCaT细胞存活率为72.08%到87.60%间,小于90%,表现出一定毒性。因此取低于62.5 μg/mL的浓度作为山楂核醇提物及其各萃取组分对HaCaT细胞的给药浓度,实验设置50、25和12.5 μg/mL三个浓度。
GES-1细胞的存活率和样品浓度(250 μg/mL、125 μg/mL和62.5 μg/mL)的关系如图2b所示。除WF外,山楂核醇提物及其各萃取组分在高浓度250 μg/mL时,GES-1细胞存活率约为16.28%到83.83%间,均小于90%,表现出一定毒性,其中EAF对GES-1细胞毒性较明显,其细胞存活率仅为16.27%±0.93%。山楂核醇提物及其各萃取组分在62.5 μg/mL浓度下GES-1细胞存活率约为99.17%到100.81%,均大于90%,因此取低于62.5 μg/mL的浓度作为山楂核醇提物及各部位对GES-1细胞的给药浓度,设置50、25和12.5 μg/mL三个浓度。

图2 山楂核醇提物及其不同萃取组分对HaCaT细胞(a)和GES-1细胞(b)存活率的影响Fig.2 Effects of alcohol extraction from hawthorn kernel and its different polar fractions on the cell viability of HaCaT cells (a)and GES-1 cells (b)
2.3 山楂核醇提物及其不同萃取组分对氧化损伤HaCaT细胞和GES-1细胞的保护作用
人皮肤角质形成细胞HaCaT细胞是人体最外层皮肤的主要构成细胞,是人体隔离外界环境的天然屏障,也最易受到氧自由基的侵害[18]。山楂核醇提物及其不同萃取组分(50 μg/mL、25 μg/mL和12.5 μg/mL)对氧化损伤的HaCaT细胞存活率的影响如图3a所示。与空白组相比,H2O2显著降低HaCaT细胞存活率(细胞存活率43.03%,p<0.01),表明氧化损伤HaCaT细胞模型诱导成功。与模型组比较,维生素C组HaCaT细胞存活率显著升高(细胞存活率57.46%,p<0.01);50 μg/mL和25 μg/mL的EAF显著提高氧化损伤HaCaT细胞的存活率18.18%和21.23%,细胞存活率分别为50.85%和52.17%(p<0.01);此外25 μg/mL和12.5 μg/mL的WF组氧化损伤HaCaT细胞的存活率亦显著升高16.20%和14.95%,细胞存活率分别为50.00%和49.46%(p<0.01)。其余各组分对氧化损伤HaCaT细胞的存活率没有明显影响。这些结果表明,EAF和WF对H2O2诱导氧化损伤HaCaT细胞具有一定的保护作用。

图3 不同浓度山楂核醇提物及其不同萃取组分对H2O2诱导的HaCaT细胞(a)和GES-1细胞(b)存活率的影响Fig.3 Effects of alcohol extraction from hawthorn kernel and its different polar fractions on the cell viability of oxidation-damaged HaCaT cells (a) and GES-1 cells (b)
氧自由基作为第二信使激活不同的氧化还原反应敏感的信号传导通路,导致组织炎症和损伤,这是急性胃粘膜损伤形成和发展的重要因素[13]。山楂核醇提物及其不萃取组分(50 μg/mL、25 μg/mL和12.5 μg/mL)对氧化损伤的GES-1细胞的存活率影响如图3b所示。与空白组相比,H2O2处理显著降低GES-1细胞存活率(细胞存活率55.34%,p<0.01),表明氧化损伤GES-1细胞模型诱导成功。与模型组比较,维生素C组GES-1T细胞存活率显著升高(细胞存活率68.27%,p<0.05);EE及WF在50 μg/mL和25 μg/mL浓度下均能显著提高氧化损伤GES-1细胞的存活率(p<0.05),其余部位无明显作用。其中50 μg/mL WF组氧化损伤GES-1细胞的存活率为63.28%(p<0.05),与模型组相比提高了23.15%,25 μg/mL山楂核水部位组氧化损伤GES-1细胞的存活率为64.78%(p<0.05),与模型组相比提高了23.61%。这些结果表明,WF对H2O2诱导氧化损伤GES-1细胞具有一定的保护作用。
本研究中,WF对H2O2诱导氧化损伤两种细胞均具有一定保护作用,而EAF仅对H2O2氧化损伤HaCaT细胞具有一定保护作用,表明WF在抗H2O2诱导氧化损伤方面可能优于EAF,这与我们前期研究结果相一致。前期研究[8]发现,EAF在清除DPPH和ABTS自由基、Fe3+还原能力方面优于其他组分;WF在清除羟自由基能力方面表现最好,EAF次之。因此WF在对H2O2诱导细胞应激氧化损伤方面具有较好的保护作用。
2.4 山楂核醇提物中的活性组分对氧化损伤的HaCaT细胞和GES-1细胞中SOD和GSH-Px的影响
SOD和GSH-Px是生物体内重要的抗氧化酶,作为清除生物体内自由基的首要物质,其可以及时修复因氧自由基对细胞造成的损伤,其表达高低可以看做是细胞衰老与死亡的指标之一。因此,我们进一步考察了山楂核醇提物中抗氧化活性组分对H2O2诱导氧化损伤HaCaT和GES-1细胞中SOD和GSH-Px水平的影响,初步探索山楂核醇提物中活性组分对氧化损伤细胞保护作用机制。
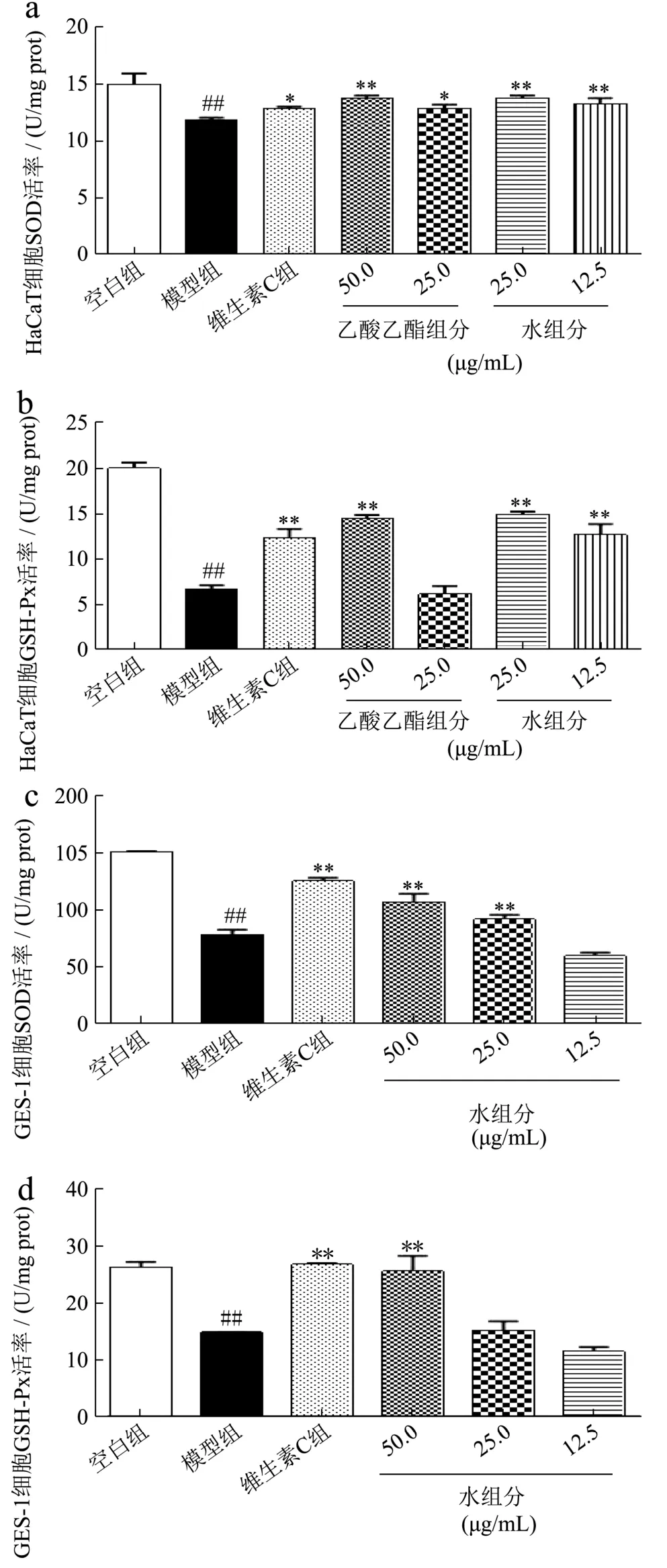
图4 山楂核活性组分对H2O2诱导氧化损伤HaCaT细胞内SOD(a)和GSH-Px(b)、氧化损伤GES-1细胞内SOD(c)和GSH-Px(d)水平的影响Fig.4 Effects of alcohol extraction from hawthorn kernel and its different polar fractions on SOD (a) and GSH-Px (b) activity in oxidation-damaged HaCaT cells, SOD (c) and GSH-Px (d)activity in oxidation-damaged GES-1 cells
EAF对氧化损伤的HaCaT细胞中SOD和GSH-Px水平的影响见图4a和图4b。其中,EAF在50 μg/mL和25 μg/mL浓度下分别提高H2O2诱导氧化损伤HaCaT细胞中SOD水平16.45%和9.09%,细胞内SOD水平分别为13.81 U/mg prot(p<0.01)和12.94 U/mg prot(p<0.05)。50 μg/mL的EAF能显著提高氧化损伤HaCaT细胞中GSH-Px水平1.16倍,细胞中GSH-Px水平为14.54 U/mg prot(p<0.01);但25 μg/mL的EAF对氧化损伤HaCaT细胞中GSH-Px的水平无明显影响。由图4a和4b可知,WF在25 μg/mL和12.5 μg/mL浓度下分别提高H2O2诱导氧化损伤HaCaT细胞中SOD水平16.62%和12.32%,细胞内SOD水平分别为13.83 U/mg prot(p<0.01)和13.32 U/mg prot(p<0.01);提高GSH-Px的水平1.22倍和88.78%,细胞内GSH-Px水平分别为15.00 U/mg prot(p<0.01)和12.72 U/mg prot(p<0.01)。
此外,WF在50 μg/mL和25 μg/mL浓度下分别提高H2O2诱导氧化损伤GES-1细胞中SOD水平37.38%和17.38%,细胞内SOD水平分别为108.44 U/mg prot(p<0.01)和92.66 U/mg prot(p<0.01,图4c);在50 μg/mL浓度下提高H2O2诱导氧化损伤GES-1细胞中GSH-Px的水平72.58%,细胞中GSH-Px水平为25.74 U/mg prot(p<0.01,图4d)。
这些结果表明,EAF可通过调节细胞内抗氧化物酶水平保护H2O2诱导氧化损伤的HaCaT细胞,WF可通过调节细胞内抗氧化物酶水平保护H2O2诱导氧化损伤的HaCaT细胞和GES-1细胞。
2.5 山楂核醇提物中活性组分大类成分分析

表1 对照品没食子酸、芦丁、葡萄糖、半乳糖醛酸和蛇菰宁线性关系Table 1 Linear regression equations of five reference materials
根据多酚(没食子酸)、黄酮(芦丁)、糖(葡萄糖)、糖醛酸(半乳糖醛酸)和木脂素(蛇菰宁)对照品的标准曲线(表1),计算EAF和WF中的各大类成份含量。由结果可知(表2),EAF中糖含量占该组分的32.73%,其次为黄酮、木脂素和多酚。糖类成分为EAF主要成分,由于EAF水溶性较差,其糖类成分可能为一些醇溶性糖和糖苷类成分。研究表明,EAF中所含木脂素类化合物Hawthornnin G和7S,8R-Ficusal具有清除ABTS和DPPH自由基活性[4]。除木脂素外,黄酮类[19]、多糖[20]类成分亦具有体外抗氧化活性。此外,多酚[21]、木脂素[22]、多糖[18]类成分均被证明对氧化损伤的HaCaT细胞具有一定保护作用,提高氧化损伤细胞的存活率。因此我们推测,EAF中含有的多糖、黄酮、木脂素、多酚类成分,可能为其抗氧化的活性成分,其在抗过氧化皮肤衰老方面具有一定开发和应用前景。
如表3所示,WF中糖含量占该组分的59.59%,主要为水溶性多糖,为其主要成份。除了被证明对氧化损伤的HaCaT细胞具有保护作用外,WF对氧化损伤的GES-1细胞也具有一定的保护活性,能够提高细胞内SOD和GSH-Px的活力。研究表明,天然产物的糖类成分可以通过提高机体免疫功能、提高胃黏膜组织的抗氧化能力、控制炎症反应等途径来保护胃黏膜[23,24]。猴头菇多糖能够降低氧化损伤的GES-1细胞内ROS的含量,同时能够减少细胞的凋亡[13]。WF中糖含量较高,多糖类成分可能对过氧化引起的皮肤衰老和胃黏膜具有一定保护活性,其在抗过氧化皮肤衰老和胃黏膜保护方面具有较好的开发应用前景,后续可对其中的多糖类成分进行进一步纯化研究。

表2 山楂核醇提物中乙酸乙酯萃取组分(EAF)化学成分含量分析Table 2 Composition analysis of ethyl acetate fraction of hawthorn kernel alcohol extraction

表3 山楂核醇提物中水萃取组分(WF)化学成分含量分析Table 3 Composition analysis of water fraction of hawthorn kernel alcohol extraction
3 结论
EAF和WF为山楂核醇提物中改善细胞氧化损伤的活性组分,其可通过提高细胞内SOD和GSH-Px的活力对氧化损伤细胞发挥保护作用,提高细胞存活率。其中,EAF对氧化损伤的HaCaT细胞具有一定保护作用;而WF对氧化损伤的HaCaT细胞和GES-1细胞均具有保护作用,且主要成分为糖,具备进一步开发的潜力。山楂核作为山楂加工过程中的副产品,大多在山楂果实加工过程中被丢弃,造成资源的浪费,因此亟待深入开发和合理利用。后续我们将对WF中多糖类成分进一步深入研究,以期为山楂核在抗过氧化皮肤衰老和胃黏膜保护等方面的开发提供科学依据,为山楂核种子资源的开发和综合利用提供数据支持。
