牙周抗菌肽缓释水凝胶的构建与性能研究
2021-06-04彭湃然牟雁东
彭湃然,任 静,黄 杰,牟雁东,2
(1.西南医科大学附属口腔医院,四川 泸州 646000;2.四川省医学科学院·四川省人民医院口腔科,四川 成都 610031)
牙周炎是由牙龈下微生物引起的慢性感染性炎症,其不仅会持续性破坏牙齿支撑组织,导致附着丧失和牙齿脱落,还与全身性疾病如心血管疾病、类风湿性关节炎和肥胖症存在关联[1]。临床上应对牙周炎的核心手段是以机械方法去除牙菌斑的牙周基础治疗,通过牙周洁治、龈下刮治和根面平整术(SRP)能去除牙周袋内大部分菌斑[2]。但对于已经产生深牙周袋的病例,单纯的机械性洁治无法取得良好的疗效,需要局部使用药物作为辅助治疗[3]。本实验构建了一种装载抗菌肽DP7的牙周袋内注射用缓释水凝胶,并检测其温敏性、缓释性和稳定性。同时通过大鼠牙周炎动物模型,检测牙周抗菌肽缓释水凝胶注射后的毒性及治疗效果。
1 资料与方法
1.1 一般资料本研究于2019年6~12月在四川大学生物治疗国家重点实验室及四川省人民医院动物实验中心完成。抗菌肽DP7由四川大学生物治疗国家重点实验室提供,大鼠由成都达硕实验动物公司提供。选用8周龄SPF级雄性SD大鼠40只用于体内实验,体重180~220 g,大鼠双侧上颌磨牙及牙周组织均正常。于四川省人民医院动物实验中心在恒温25 ℃,湿度55%环境下以标准实验大鼠饲料和自来水喂养。将40只大鼠用随机数字表法均分为牙周抗菌肽缓释水凝胶组(A组)、空白凝胶组(B组)、派丽奥组(C组)、自然愈合组(D组)各10只,将每组10只大鼠再用随机表法分为2组,分别用于毒性评价和疗效评价。
1.2 方法
1.2.1牙周抗菌肽缓释水凝胶的构建 冷溶法构建水凝胶定量称取泊洛沙姆188和泊洛沙姆407,溶于适量超纯水,4 ℃恒温水浴搅拌均匀后于4 ℃冰箱冷藏24 h得到胶体待用。于胶体中加入抗菌肽DP7(1%,wt%),4 ℃恒温水浴搅拌均匀,4 ℃冷藏24 h,即获得浓度1%的牙周抗菌肽缓释水凝胶。
1.2.2牙周抗菌肽缓释水凝胶的性能评价 ①胶凝温度(Tsol-gel)的测定:取1 ml抗菌肽DP7缓释水凝胶,置于直径为1 cm的薄壁试管中,在20 ℃水浴锅内以1 ℃每分钟的速度升高水温,温度每升高0.5 ℃,将试管倒置,30秒后不发生流动即为胶凝,记录此时温度。②胶凝时间(tsol-gel)的测定:取1 ml抗菌肽DP7缓释水凝胶,放入西林瓶中,4 ℃平衡10 min后倾斜西林瓶并于37 ℃恒温水浴,待弯月面凝胶不流动时,记录此时时间。以上实验重复3次。③体外释放实验将抗菌肽DP710 mg与超纯水40 ml配制成2 mg/ml溶液,空白对照组为超纯水,采用紫外-可见分光光度法在 200~800 nm 波长范围内进行扫描,观察抗菌肽的最大吸收波长。梯度稀释法配置1000、500、200、100、50、20 μg/ml的抗菌肽溶液。用高效液相色谱法(HPLC)测定吸收峰面积积分值,绘制抗菌肽标准曲线。在37 ℃恒温环境下取1 ml牙周抗菌肽缓释水凝胶,加入PBS(pH=7.4)5 ml,于2、4、8、12、24、48、96、168 h时间点各取样500 μl,同时加入PBS 500 μl。样本离心后(10000 r/min,3 min),用HPLC检测,计算药物释放量,绘制药物体外释放曲线。④稳定性实验将牙周抗菌肽缓释水凝胶放置于4 ℃冰箱中保存,分别于0、6、12、24、48、72 h后取样1 ml,加入PBS(pH=7.4)5 ml,药物完全释放后用HPLC检测。
1.2.3牙周抗菌肽缓释水凝胶的毒性评价 实验中,大鼠腹腔注射7%水合氯醛(0.5 ml/100 g)麻醉后,分别给予A、B、C组牙周袋内注射1%牙周抗菌肽水凝胶、空白水凝胶、派丽奥软膏,至药物溢出牙周袋,给药方式为每周给药1次。D组不做处理,给药4周后处死,取心、肝、脾、肺、肾器官,于4%甲醛固定,梯度脱水,浸蜡包埋,切片,苏木精-伊红(HE)染色后观察各脏器是否发生毒理学改变。
1.2.3牙周抗菌肽缓释水凝胶的疗效评价 实验大鼠麻醉后以右侧第一磨牙为建模牙,用双线法辅以高糖饮食建立牙周炎模型,具体操作为:将0#医用缝线埋入龈沟内,再用0.20 mm正畸结扎丝结扎牙颈部。期间所有大鼠喂养高糖饲料,定期检查,及时重新结扎松动、脱落的结扎丝。8周后,大鼠牙周炎形成,停止喂养高糖饮食。麻醉大鼠,去除结扎丝及缝线,对A、B、C组牙周洁治后分别使用1%牙周抗菌肽水凝胶、空白水凝胶、派丽奥软膏,给药方式为牙周袋内注射至药物溢出牙周袋,频率为每周1次。D组仅行牙周洁治。给药第0、2、4周后分别麻醉大鼠,观察牙龈状态,探诊牙周袋深度。
1.3 统计学方法采用SPSS 26.0统计软件进行数据处理分析。定量数据采用均数±标准差表示,两两比较采用t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 胶凝条件测定结果溶液在高于一定温度条件下形成凝胶,测得最小胶凝温度为(25.80±0.45)℃。在模拟体温的37 ℃条件下,胶凝时间为(15.40±0.89)秒。
2.2 体外释放实验结果紫外分光光度计检测最大吸收波长为220 nm。以抗菌肽浓度为X轴,峰面积为Y轴,绘制标准曲线方程:Y=14366X+564635,r=0.9987。抗菌肽标准曲线见图1。牙周抗菌肽缓释水凝胶的体外药物释放曲线,在最初的48 h内药物释放较快,随后持续减慢,可持续释放长达7天,见图2。

图1 抗菌肽标准曲线
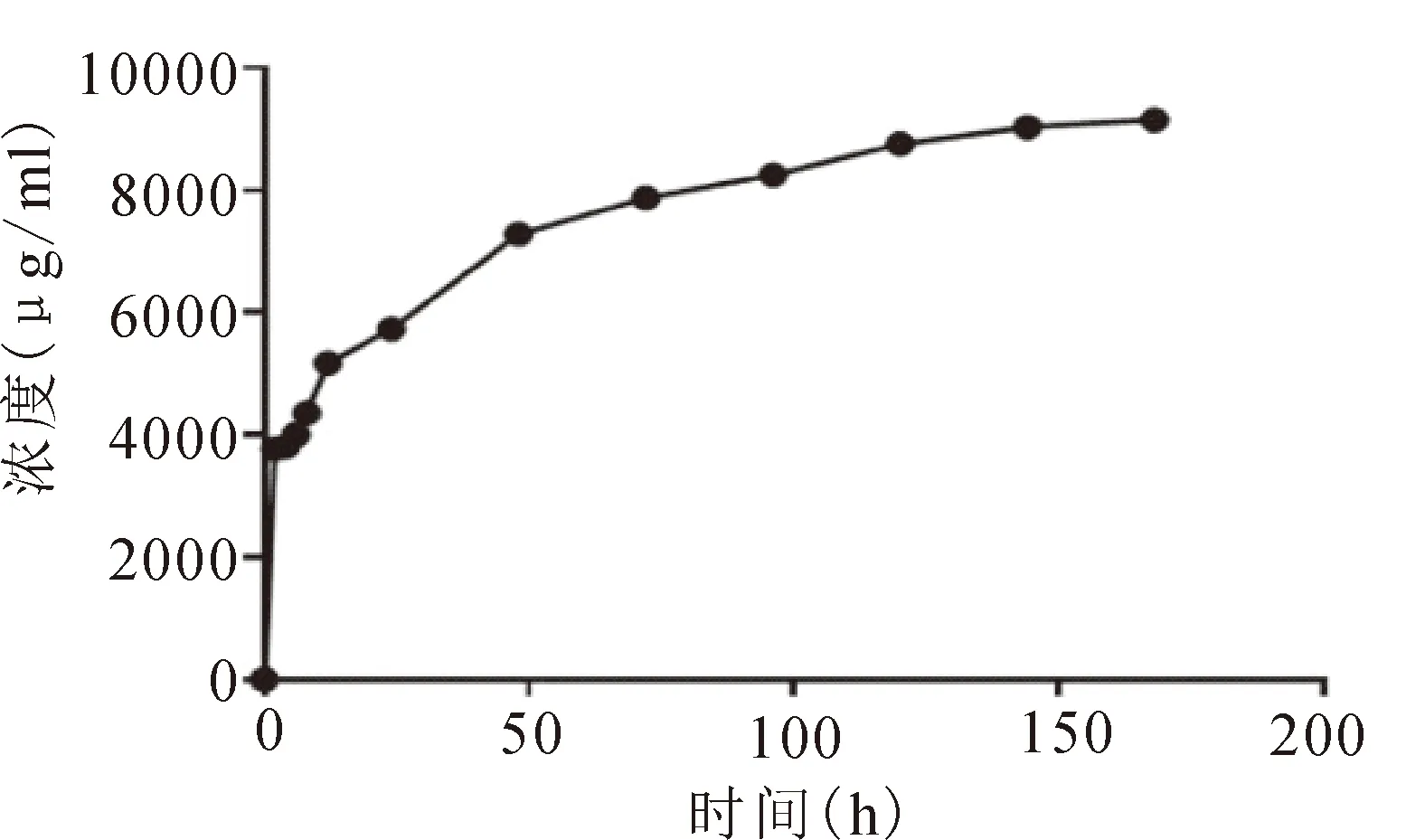
图2 体外释放曲线
2.3 稳定性实验6个时间点样品吸收峰面积为(1063754.83±20093.97),RSD值为1.89%(n=6),显示牙周抗菌肽缓释水凝胶在低温(4 ℃)环境下,72 h内维持稳定。
2.4 毒性及疗效评价
2.4.1毒理学检测结果 镜下观察各组大鼠脏器病理切片,未见心肌纤维横纹紊乱及细胞不良分化;肝小叶、肝素、肝窦结构清晰,肝细胞形态正常;肾小球、肾小管形态正常,肾皮质髓质分界清晰,间质无出血或炎症;未见脾水肿,淋巴小结清晰;肺泡均匀扩张,无水肿,未见炎性浸润区。见图3。
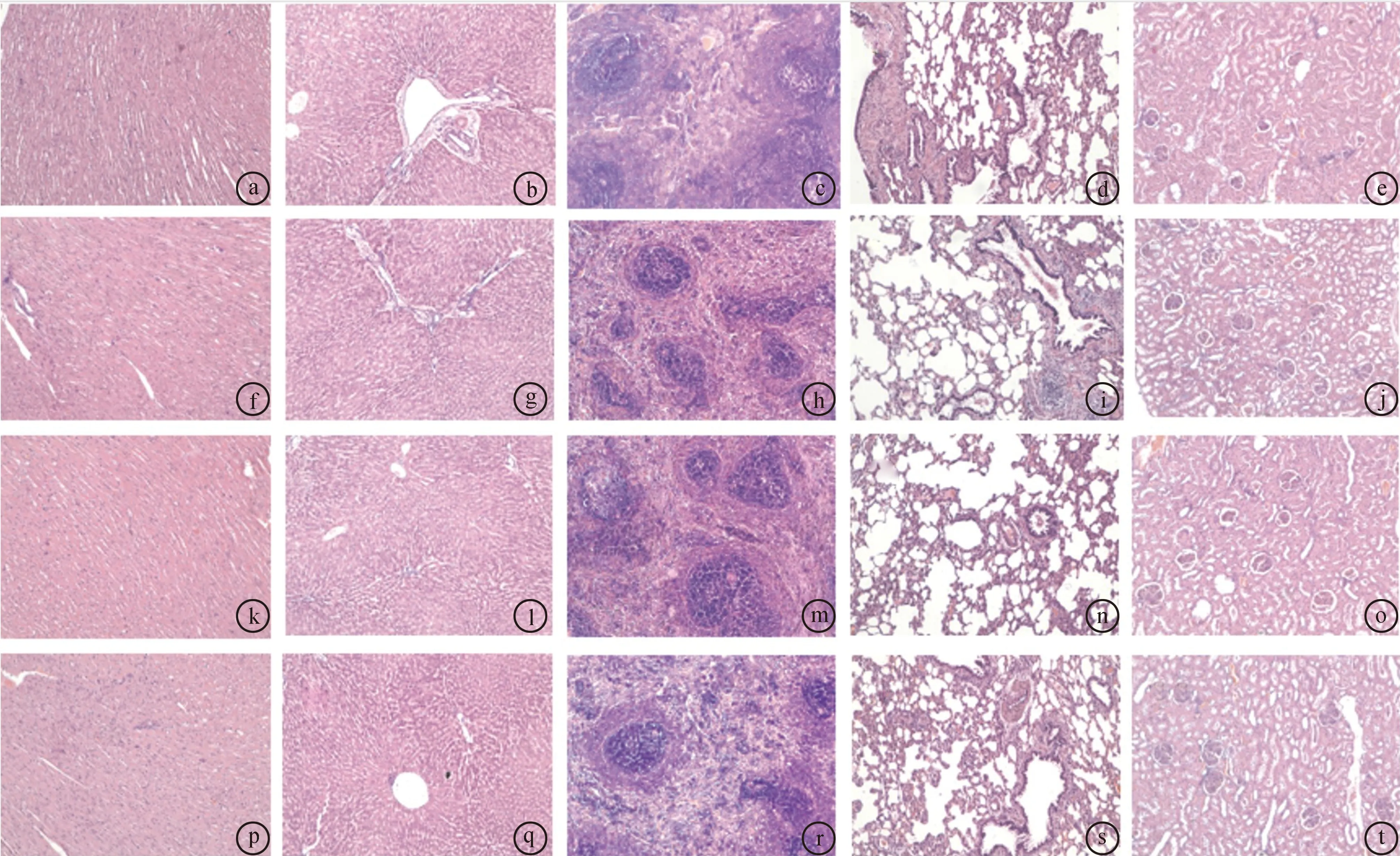
图3 各组脏器组织切片 a-e、f-j、k-o、p-t依次为A、B、C、D组大鼠心、肝、脾、肺、肾组织(HE,×100)
2.4.2治疗效果评价 0周时各组牙龈状态无差异(P>0.05)。用药2周后,A、C组牙龈红肿程度略轻,探诊深度下降(P<0.01);4周后,与B、D两组相比,A组牙龈炎症明显消退,探诊深度降低显著(P<0.01)。C组也可见牙龈红肿减轻,探诊深度低于0.2周(P<0.01)。牙周袋探诊结果见表1。

表1 四组牙周袋探诊深度比较 (mm)
3 讨论
口腔是人体中菌群种类、数量最多的部位之一,有超过770种细菌存在于口腔中[4],牙龈下微生物形成的生物膜与易感宿主之间的体内平衡丧失导致了牙周炎的发生。牙周炎造成的牙周组织损害主要来源于过度的宿主-病原炎性反应。在牙周局部组织中,牙龈卟啉单胞菌等牙周致病菌激活宿主自身免疫应答,大量产生白细胞介素-6、肿瘤坏死因子-α等炎性因子,引发强烈的炎症反应[5,6]。而目前对于耐药菌产生的牙周炎,缺乏有效的局部用药。因此开发一种具备良好消炎抑菌效果的缓释药物用于辅助牙周基础治疗,具有重大的临床意义。
目前局部给药体系主要包括膜剂、微球、水凝胶等[7]。水凝胶作为一种新型缓释给药载体,它与人体组织结构具有相似性,能以液态给药,随后在用药部位发生相转变,由液态转变为凝胶态,同时具有组织兼容性佳、缓释效果良好、制备工艺简单等优势而备受关注[8]。为了更好地控制凝胶的相转变,受到外界特定刺激后发生胶凝的智能水凝胶逐渐成为研究热点,目前报道了包括温度敏感型、光敏感型、pH敏感型、生化分子敏感型等多种智能水凝胶[9~11]。其中,温敏型水凝胶受到体温刺激快速响应发生胶凝的特性让它成为一种良好的口腔药物载体,具有给药方便、提高局部药物浓度、降低药物毒副作用,延长药物在体内的作用时间等优点,具有很好的临床应用前景[12,13]。本实验运用泊洛沙姆188、407作为凝胶基质制备的牙周抗菌肽缓释水凝胶具有温敏特性,在体温下胶凝时间仅为15.4秒,能以溶液形态被注射入牙周袋内,并迅速转变成凝胶态粘附于牙龈上,操作简单便捷,易于临床推广运用。而长达7天的缓释能力使得抗菌肽注射入牙周袋后能够长时间维持,从而起到减少药物用量及给药频次,提高药物生物利用度的效果。
抗菌肽是一类由生物体产生的具有抗菌活性的物质,它们可以抵抗病毒、细菌、真菌、寄生虫、肿瘤细胞等多种因素引起的感染,是生物先天免疫系统的关键部分之一,目前发现并报道的天然抗菌肽超过2900种[14,15]。因滥用抗生素导致耐药菌的增加,严重威胁了公众的健康[16],而抗菌肽的广谱抗菌活性和对多重耐药细菌的有效杀菌作用已得到广泛认可[17]。新型阳离子抗菌肽DP7来源于牛中性粒细胞中的抗菌肽HH2,具有良好的体内外抗菌活性和免疫调节能,在体外和体内实验中都表现出高抗菌活性和低溶血性的特点[18,19]。体外实验还发现大鼠骨髓间充质干细胞受到特定浓度的DP7刺激后,成骨性分化能力增强,ALP活性及钙沉积能力增加[20]。本实验以抗菌肽DP7作为主药治疗大鼠牙周炎4周后,发现大鼠牙龈红肿、牙周袋等临床症状明显缓解,这可能与DP7对厌氧菌的抑制作用有关。本实验构建的牙周抗菌肽缓释水凝胶有望作为辅助药物用于牙周炎临床治疗。
