干扰素调节因子1通过调控细胞焦亡参与小鼠肝脏缺血再灌注损伤
2021-06-04刘钰王朝阳李世朋胡莎莎杨爽蔡金贞张国梁
刘钰,王朝阳,李世朋,胡莎莎,杨爽,蔡金贞,张国梁△
肝缺血再灌注损伤(liver ischemia-reperfusion injury,LIRI)是肝脏切除、移植等手术过程中出现肝损伤和肝移植术后移植物功能障碍的主要原因[1]。了解LIRI的具体机制将有助于减少肝移植术后各种并发症的发生,进一步改善患者的预后[2]。干扰素调节因子-1(interferon regulatory factor-1,IRF-1)参与调节对病原体和同种抗原的炎症反应,已被证实参与了缺血再灌注(IR)损伤的发生[3]。肾小管急性IR损伤时IRF-1表达上调,进而激活促炎细胞因子和趋化因子的表达,引发一系列炎症反应[3]。细胞焦亡作为一种程序性死亡形式越来越受到人们重视,其机制、形态学变化及生化特征均有别于其他死亡形式,主要表现为病原体刺激下激活半胱天冬氨酸蛋白酶(Caspase)-1和Caspase-4/5/11,以及裂解gasdermin D(GSDMD)和促炎细胞因子的释放[4],同时伴有细胞肿胀,细胞膜孔形成[5]。目前IRF-1在LIRI中的研究尚少见报道。本文主要探讨LIRI中IRF-1及细胞焦亡指标的变化,同时观察敲低或过表达IRF-1对细胞焦亡的影响及其可能机制。
1 材料与方法
1.1 材料 无特定病原体(SPF)级健康雄性C57BL/6小鼠24只,体质量(24±3)g,8~10周龄,购于北京华阜康生物科技股份有限公司。小鼠正常肝AML12细胞系购于中科院上海细胞库。IRF-1小干扰RNA(siRNA)及阴性对照siRNA购于广州锐博公司,IRF-1 siRNA靶序列:5'-CCAAGACATG⁃GAAGGCAAA-3'。过表达IRF-1腺病毒(IRF-1引物上游5'-ATGCCAATCACTCGAATGCG-3',下 游5'-CTATGGTG⁃CACAAGGAATGGC-3')及空载腺病毒购于汉恒生物。DMEM/F12培养基、胎牛血清和胰蛋白酶购于美国Gibco公司。Caspase-1和Cleaved-Caspase-1抗体购于英国Abcam公司。兔抗鼠IRF-1、GSDMD一抗购于武汉ABclonal公司,GAPDH抗体购于武汉Elabscience公司,辣根过氧化物酶(HRP)标记的羊抗兔二抗购于美国CST公司。原位缺口末端标记(TUNEL)检测试剂盒购自德国Roche公司。白细胞介素(IL)-1β酶联免疫吸附测定(ELISA)试剂盒购于联科生物公司。乳酸脱氢酶(LDH)细胞毒性检测试剂盒购于上海碧云天公司。细胞缺氧模型培养箱购于美国billups-rothenber公司,FACSCalibur流式细胞仪购于美国BD Biosciences公司。透射电子显微镜购于上海日立高新技术公司。
1.2 动物实验
1.2.1 小鼠肝缺血再灌注模型建立及分组 依照参考文献[6]建模。采用随机数字表法将24只C57BL/6小鼠分为4组,分别为假手术(Sham)组,IR 2、6、12 h组,每组6只。术前8 h禁食,自由饮水。腹腔注射1%戊巴比妥钠(50 mg/kg),麻醉后经腹部正中切开约3 cm,暴露腹腔肝脏,IR 2、6、12 h组血管夹夹闭肝中叶、左叶脉管(门静脉、动脉与胆道),实现70%肝脏缺血。缺血时观察肝缺血叶(左、中叶)颜色是否变白,与肝右叶红润是否形成鲜明的对比。夹闭60 min后恢复血供,观察肝缺血叶颜色是否恢复,再灌注时间依次为2、6、12 h。Sham组仅做开腹、游离第一肝门后关腹处理。
1.2.2 小鼠血清转氨酶及IL-1β水平检测 再灌注结束后经下腔静脉取血1 mL,静置1 h,4 000 r/min离心15 min,留取血清。采用动物专用全自动生化仪mindray BS-240VET(南京贝登医疗有限公司)检测丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)水平,ELISA法检测血清IL-1β水平。
1.2.3 苏木精-伊红(HE)染色观察肝组织病理变化 采血结束后处死小鼠,分离缺血侧肝组织后放入4%多聚甲醛固定24 h,再经梯度乙醇脱水、二甲苯透明、石蜡包埋后以4µm厚度制成石蜡切片。常规HE染色后观察肝脏病理学变化,并根据Suzuki’s评分[2]对结果进行评估。肝缺血再灌注损伤包括窦状充血、肝细胞质空泡化、实质坏死。其中,充血或空泡化:无(0分)、轻微(1分)、轻度(2分)、中度(3分)、重度(4分);坏死分级:无细胞坏死(0分)、单细胞坏死(1分)、<30%坏死(2分)、30%~60%坏死(3分)、>60%坏死(4分)。
1.2.4 免疫组织化学染色观察肝脏IRF-1表达 肝组织石蜡切片脱蜡、水化,柠檬酸钠进行抗原修复后在3%H2O2中孵育以封闭过氧化物酶。用IRF-1一抗(1∶200)于4℃孵育过夜,次日与HRP结合的二抗孵育后二氨基联苯胺(DAB)显色,镜下观察。
1.2.5 TUNEL染色检测小鼠肝脏凋亡和焦亡变化 石蜡切片进行常规脱蜡、水化,蛋白酶K消化处理,滴加TUNEL反应混合液,置于湿盒内,37℃避光孵育60 min。滴加DAPI溶液染核2 min。在荧光显微镜下观察并记录组织切片肝细胞总数和TUNEL阳性细胞数。
1.2.6 透射电镜察细胞形态变化 肝组织切片经2.5%戊二醛中固定后再经2%四氧化锇二次固定,制成超薄切片并染色后用透射电镜观察细胞膜、核膜成孔和线粒体肿大现象。
1.2.7 Western blot检测IRF-1、Caspase-1、Cleaved-Caspase-1及GSDMD蛋白表达 取20 mg肝组织置于200µL RIPA裂解液中匀浆处理,待充分其裂解后于4℃、4 000 r/min离心15 min,留取上清,BCA法测蛋白浓度。20µg/孔上样行SDSPAGE,转至PVDF膜,用5%脱脂牛奶室温封闭1 h,加一抗(IRF-1、Caspase-1、Cleaved-Caspase-1、GSDMD、GAPDH,均为1∶1 000稀释)于4℃孵育过夜,TBST洗膜后用HRP标记的羊抗兔二抗(1∶2 500稀释)室温孵育90 min,混合等体积化学发光液与PVDF膜反应,曝光显影后记录目的蛋白和内参蛋白的光密度(OD)值并计算相对表达量。
1.3 细胞实验
1.3.1 AML12细胞缺氧复氧(模拟IR)模型的建立 将AML12细胞接种于6孔板,每孔细胞接种数量约为3×105个,待细胞密度达到50%时分为4组,分别为空载体+IR组(转染空载腺病毒)、过表达IRF-1+IR组(转染过表达IRF-1的腺病毒)、NC+IR组(转染阴性对照siRNA)和IRF-1 siRNA+IR组(转染沉默IRF-1表达的siRNA)。之后将细胞放入37℃,5%CO2培养箱中培养36 h,移去培养基,换Hank’s液后放入缺氧箱模拟缺血缺氧处理,缺氧箱内O2体积分数<1%。1 h后各孔换DMEM/F12培养基后继续在培养箱中培养6 h以模拟再灌注处理。
1.3.2 透射电镜观察AML12细胞形态学变化及Western blot检测IRF-1、Caspase-1、Cleaved-Caspase-1及GSDMD蛋白的表达 4组细胞分组处理结束后分别按照1.2.6和1.2.7的方法观察细胞形态变化和检测相关蛋白表达。
1.3.3 流式细胞术检测细胞焦亡 取NC+IR组与IRF-1 siRNA+IR组细胞(每组约1×106个细胞),预冷PBS洗涤后悬浮于1 mL结合缓冲液中。每组取100µL细胞,再分别加入5µL膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和碘化丙啶(PI)。室温下避光孵育10 min后采用FACSCalibur流式细胞仪分析细胞焦亡变化。因细胞焦亡时,细胞膜上的气孔打开,Annexin V-FITC进入细胞,与膜内磷脂酰丝氨酸结合染色,而PI也可通过气孔进入焦亡细胞与DNA结合使其染色,故Annexin V-FITC/PI双阳的晚期凋亡细胞也可认为是焦亡细胞。
1.3.4 酶标法检测相对LDH释放 在96孔板上设置NC+IR孔、IRF-1 siRNA+IR孔、样品对照孔、背景空白对照孔及样品最大酶活性对照孔。检测前1 h,在样品最大酶活性对照孔中加入LDH释放试剂,反复吹打混匀并继续在培养箱中孵育。1 h后将96孔板以1 000 r/min离心2 min。各孔分别取等量上清液加入至新96孔板中,酶标仪检测各组490 nm处的OD值,计算LDH相对释放量,相对释放量=(OD实验组-对照组)/(OD最大酶活性组-对照组)。
1.4 统计学方法 采用GraphPad Prism 8.0.2进行统计学分析,Shapiro-Wilk test对数据进行正态性检验。符合正态分布的计量资料以均数±标准差(±s)表示,2组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间多重比较采用Tukey法。P<0.05为差异有统计学意义。
2 结果
2.1 4组小鼠血清ALT、AST及IL-1β变化 与Sham组相比,IR各组血清ALT、AST水平均有明显升高,IR2~12 h内随时间延长升高,在12 h达到峰值(P<0.05)。与Sham组相比,IR2 h组血清IL-1β水平差异无统计学意义,IR6 h和IR12 h组血清IL-1β水平高于Sham组,见表1。
Tab.1 Comparison of serum levels of ALT,AST and IL-1βbetween four groups of mice表1 各组小鼠血清ALT、AST和IL-1β水平比较(n=6,±s)
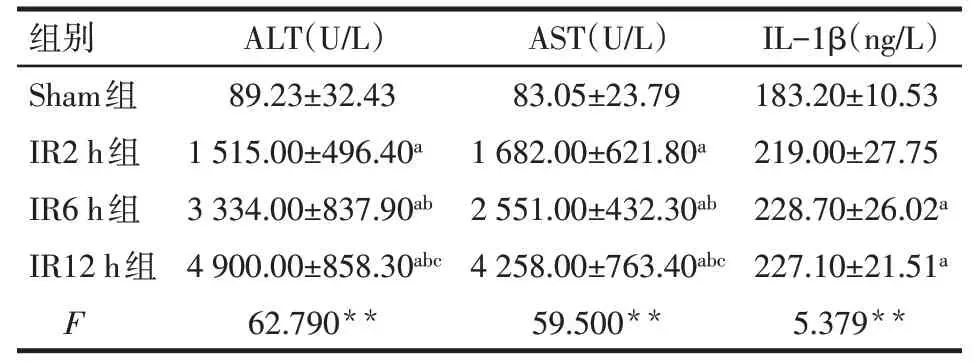
Tab.1 Comparison of serum levels of ALT,AST and IL-1βbetween four groups of mice表1 各组小鼠血清ALT、AST和IL-1β水平比较(n=6,±s)
**P<0.01;a与Sham组比较,b与IR2 h组比较,c与IR6 h组比较,P<0.05
?
2.2 4组小鼠肝脏病理改变 小鼠肝脏经IR处理后肝组织损伤明显加重,与Sham组相比,IR各组肝板排列紊乱,肝细胞肿胀、片状坏死,肝窦变窄,红细胞淤积增多,随再灌注时间延长(2~12 h)而损伤加重,见图1。IR各组Suzuki’s评分均较Sham组升高,IR6 h、12 h组较2 h组也有明显升高(P<0.05),见图2。
2.3 4组小鼠肝细胞IRF-1表达情况 免疫组化染色示IRF-1主要定位于细胞质,阳性细胞呈深棕色。Sham组未见IRF-1阳性细胞,IR2 h后可见少量阳性细胞,6 h后IRF-1阳性细胞数增多,呈现片状深棕色染色,IR12 h后IRF-1阳性细胞有所减少,见图3。
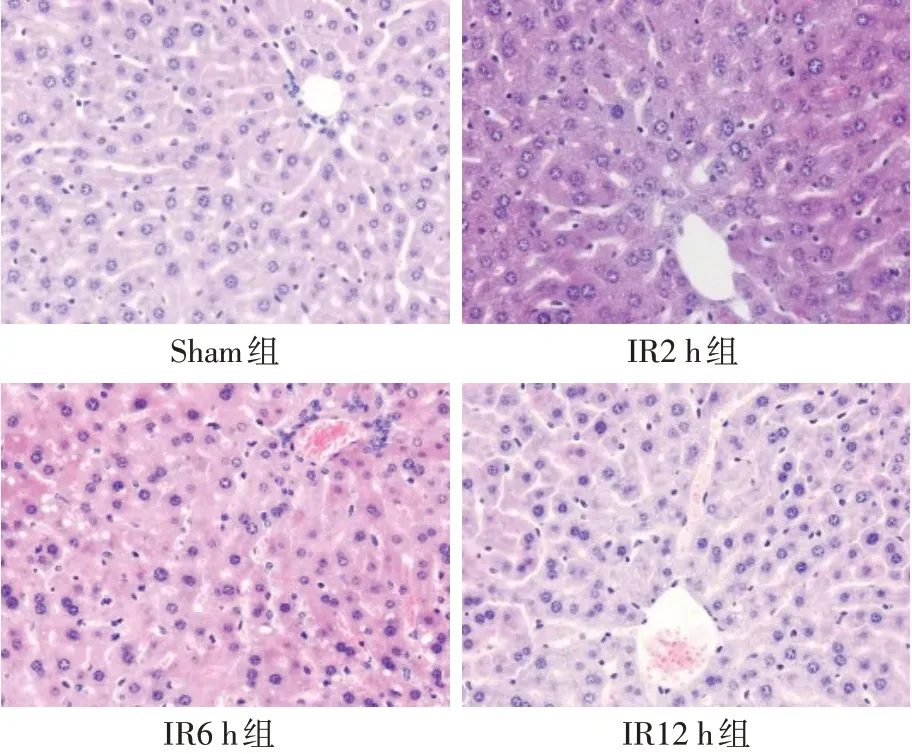
Fig.1 Changes of liver pathology in each group(HE staining,×200)图1 各组小鼠肝脏病理学改变(HE染色,×200)
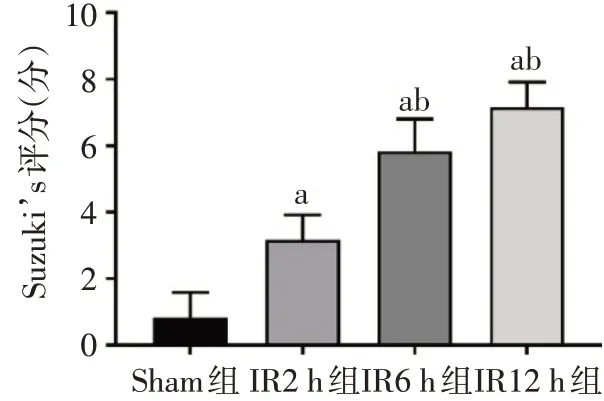
Fig.2 Comparison of liver Suzuki’s scores between the four groups图2 4组小鼠肝脏Suzuki’s评分比较

Fig.3 Changes of IRF-1 expression in liver of mice in each group(immumohistochemical staining,×200)图3 各组小鼠肝脏IRF-1表达变化(免疫组化染色,×200)
2.4 4组肝脏TUNEL阳性细胞数比较 与Sham组相比,小鼠肝脏细胞在IR过程中TUNEL阳性细胞数增加,在6 h内达到峰值(P<0.05),见图4、5。
2.5 肝组织和AML12细胞形态学变化 透射电镜下可见,Sham组肝脏细胞形态大体正常,IR2~12 h后肝细胞均出现不同程度的核膜损伤和线粒体肿胀,见图6。在AML12细胞中,与NC+IR组比较,IRF-1 siRNA+IR组细胞膜和核膜成孔或破裂减少,线粒体肿胀数量下降,细胞损伤减轻,见图7。

Fig.4 Results of TUNEL staining of liver cells in each group(×200)图4 各组小鼠肝脏细胞TUNEL染色结果(×200)
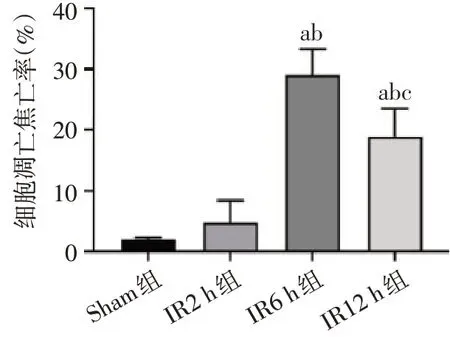
Fig.5 Comparison of liver apoptosis and pyroptosis cells of mice in each group(×200)图5 各组小鼠肝脏细胞凋亡和焦亡率比较(×200)
2.6 小鼠肝组织与AML12细胞中IRF-1、Caspase-1和GSDMD蛋白表达情况 肝组织:与Sham组相比,IR6 h和12 h组IRF-1、Caspase-1和GSDMD表达均明显升高(P<0.05),见图8、9。AML12细胞:过表达IRF-1+IR组与空载体+IR组相比,伴随IRF-1的表达增高,GSDMD和Cleaved-Caspase-1也随之明显增高(均P<0.05),见图10、11。而敲低IRF-1表达后与对照组相比,Caspase-1和GSDMD蛋白表达均减少(均P<0.05),见图12、13。IRF-1可通过影响Caspase-1与GSDMD的表达和Cleaved-Caspase-1片段的生成调控焦亡。
2.7 沉默IRF-1表达后AML12细胞焦亡率和LDH释放量变化 与NC+IR组相比,IRF-1 siRNA+IR组细胞焦亡率下降,LDH释放量减少约20%,见图14、表2。

Fig.6 Morphological changes of liver tissue in four groups under transmission electron microscope图6 透射电镜下4组小鼠肝组织形态变化

Fig.7 Morphological changes of AML12 cells in four groups observed under transmission electron microscopy图7 透射电镜下2组AML12细胞形态变化
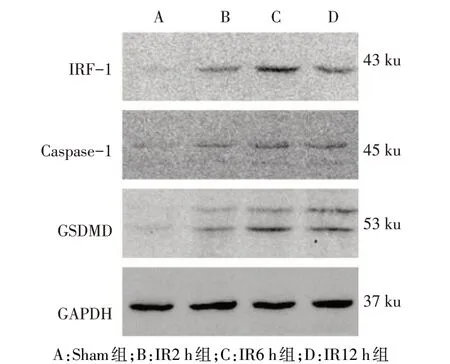
Fig.8 The expressions of IRF-1,Caspase-1 and GSDMD in liver of mice detected by Western blot assay图8 Western blot检测各组小鼠肝脏IRF-1,Caspase-1和GSDMD表达
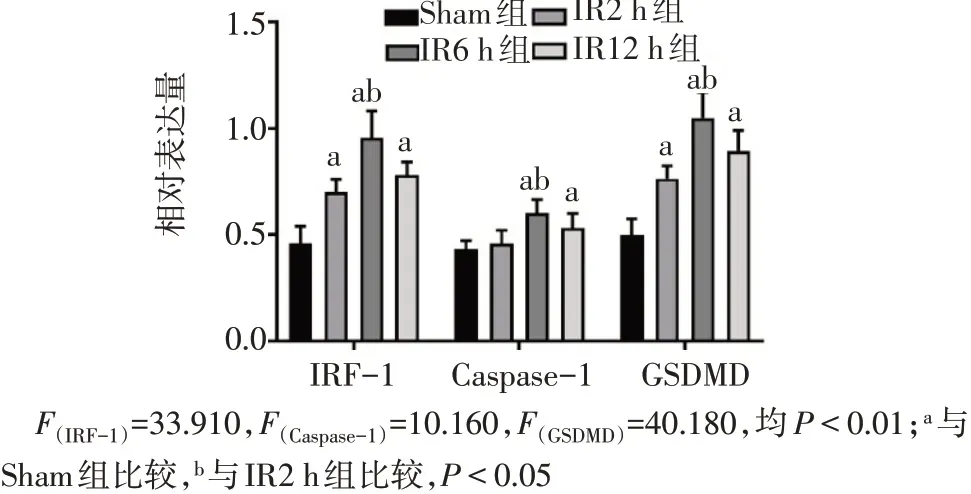
Fig.9 Comparison of IRF-1,Caspase-1 and GSDMD in liver of mice between the four groups图9 各组小鼠肝脏IRF-1,Caspase-1和GSDMD表达比较

Fig.10 The expressions of IRF-1,Cleaved-Caspase-1 and GSDMD proteins in the overexpressed IRF-1+IR group and the vector+IR group图10 Western blot检测过表达IRF-1+IR组与空载体+IR组细胞IRF-1、Cleaved-Caspase-1和GSDMD表达
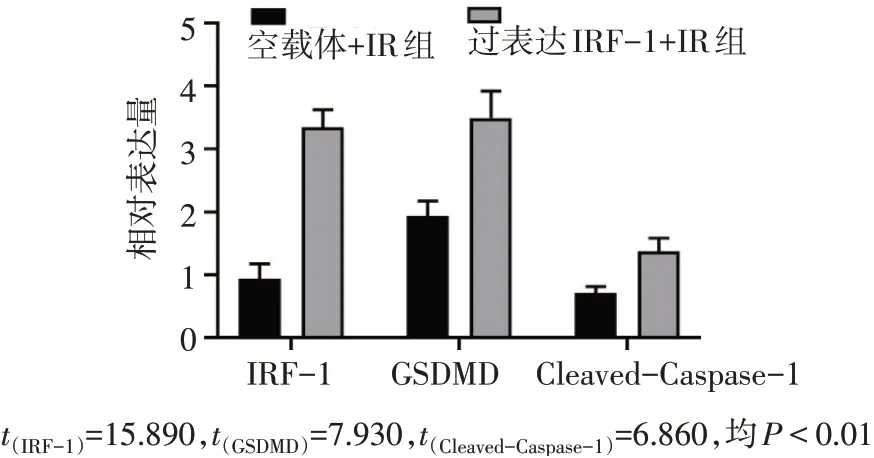
Fig.11 Comparison of IRF-1,Cleaved-Caspase-1 and GSDMD expression levels between the overexpressed IRF-1+IR group and vector+IR group图11 过表达IRF-1+IR组与空载体+IR组细胞IRF-1、Cleaved-Caspase-1和GSDMD蛋白表达水平比较
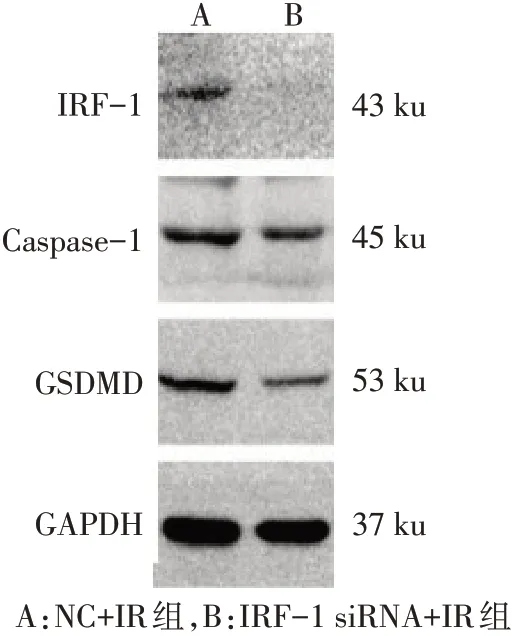
Fig.12 The expressions of IRF-1,Caspase-1 and GSDMD proteins in the IRF-1 siRNA+IR group and NC+IR group图12 Western blot检测过表达IRF-1 siRNA+IR组与NC+IR组细胞IRF-1、Caspase-1和GSDMD表达
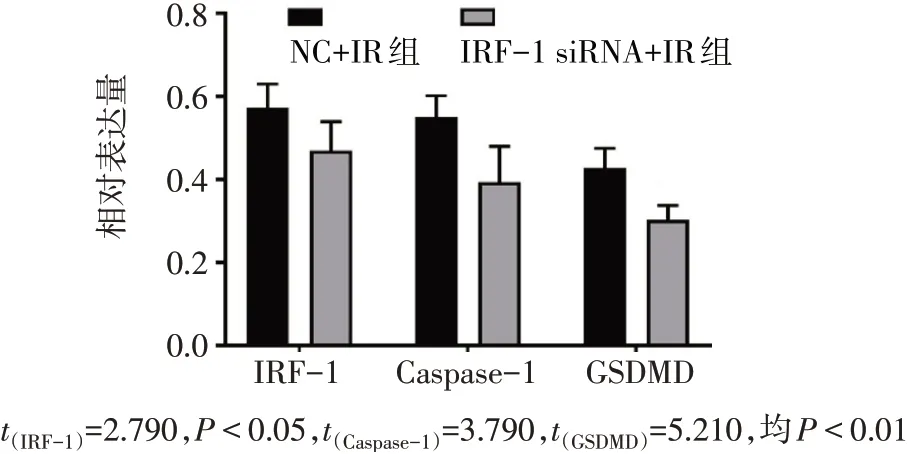
Fig.13 Comparison of IRF-1,Caspase-1 and GSDMD expressionlevels between the IRF-1 siRNA+IR group and NC+IR group图13 IRF-1 siRNA+IR组与NC+IR组细胞IRF-1、Caspase-1和GSDMD蛋白表达水平比较
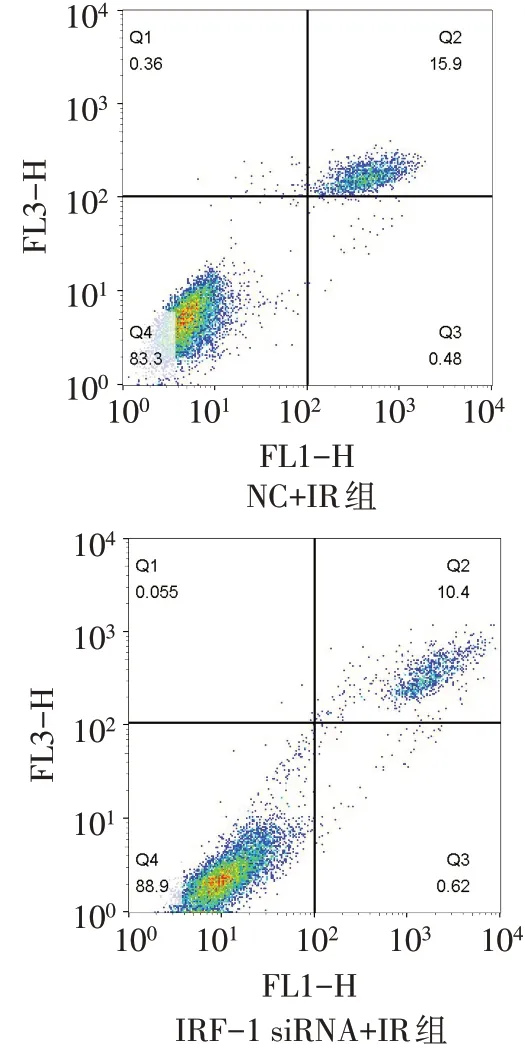
Fig.14 Flow cytometry of AML12 cells in IRF-1 siRNA+IR group and NC+IR group图14 IRF-1 siRNA+IR组与NC+IR组的AML12细胞流式图
Tab.2 Comparison of cell apoptosis rate and LDH relative release level between IRF-1 siRNA+IR group and NC+IR group表2 IRF-1 siRNA+IR组与NC+IR组细胞焦亡率和LDH相对释放水平比较 (n=6,±s)
*P<0.05,**P<0.01
?
3 讨论
LIRI是肝切除、移植后供体肝功能障碍的主要原因[1]。LIRI过程中涉及的因素及机制包括细胞内钙超载、氧化应激、线粒体、中性粒细胞和肝枯否细胞(KCs)、细胞因子和趋化因子等[7]。IRF-1作为一种转录调节因子在IR损伤过程中起到重要作用[7]。正常细胞中IRF-1处于低表达或无活性状态,受到干扰素(IFN)刺激后表达增加,调控下游炎性细胞因子表达,还可抑制肿瘤形成和细胞生长[8-9]。本实验证实小鼠肝脏IR模型中IRF-1表达增高,参与了下游炎性因子的产生。
焦亡是一种Caspase-1依赖性的细胞程序性死亡形式,其主要特点是快速的DNA片段化、细胞膜破裂和促炎因子的产生。经典通路中炎性小体的激活是重要的一步,其可激活Caspase-1,活化的Caspase-1可对GSDMD进行切割,形成的GSDMD-N端与细胞膜磷脂蛋白结合形成孔洞,还可将IL-1β和IL-18前体切割成有活性的IL-1β和IL-18,与其他促炎因子一起经孔洞释放到胞外,造成炎症反应[10-14]。本实验结果显示,与Sham组相比,小鼠IR6 h和12 h后肝脏IRF-1、Caspase-1和GSDMD蛋白表达明显增高,血清ALT、AST和IL-1β水平也有显著升高,同时TUNEL染色发现小鼠肝脏IR后损伤加重,细胞凋亡增多,同时伴有核膜成孔和线粒体肿胀,说明焦亡参与小鼠LIRI,促进炎症反应,加重了肝脏损伤。
本研究发现小鼠肝脏IR 2~12 h后IRF-1、Caspase-1、GSDMD均有不同程度升高,表明这几个指标可能存在关联。有文献报道IRF-1可通过激活Caspase-1促进脑脊髓炎(EAE)和多发性硬化症(MS)中少突胶质细胞的焦亡[15]。另有研究证实Caspase-1基因含有IRF-1结合元件(IRE),IFN刺激少突胶质祖细胞后,如果缺少IRF-1的存在,无法激活Caspase-1[16]。而小鼠IRF-1基因敲除后能减弱Caspase-1激活和凋亡相关微粒蛋白(ASC)在内的焦亡小体的形成并减少下游高迁移率族蛋白1(HMGB1)、IL-1β释放[17-19]。结合本研究结果,笔者推测肝组织缺血再灌注过程中IRF-1可能通过激活Caspase-1调控焦亡加重肝细胞损伤。
为验证IRF-1是否对焦亡产生影响,在体外实验中对AML12细胞感染空载腺病毒和过表达IRF-1的腺病毒后进行模拟小鼠肝脏缺血再灌注(缺氧复氧)处理,结果显示过表达IRF-1后伴随IRF-1的表达升高,GSDMD和Cleaved-Caspase-1也随之增高,说明IRF-1表达增多后促使Caspase-1被切割,形成大量的Cleaved-Caspase-1片段,即IRF-1通过调控AML12细胞缺氧复氧过程中Caspase-1的激活影响细胞焦亡。
与此同时,本研究通过siRNA实验发现,与NC+IR组相比,IRF-1 siRNA+IR组AML12细胞Caspase-1和GSDMD随IRF-1表达下调也相应减少,细胞上清LDH的释放量下降;同时流式结果显示,伴随IRF-1的下调,细胞焦亡率下降,形态学显示细胞膜和核膜成孔减少,核膜完整性损伤减轻,线粒体肿胀数量减少,上述结果提示下调IRF-1表达能影响Caspase-1和GSDMD的表达,从而减少细胞膜的破裂或膜上气孔的形成,减少细胞焦亡。
综上所述,IRF-1可通过调节Caspase-1的转录或激活和GSDMD的表达以及IL-1β的释放调控焦亡,进而参与小鼠LIRI,可能为减轻肝切除和移植过程中的损伤提供新的见解。
