柚皮素通过抑制NF-κB信号通路减轻哮喘大鼠气道炎症反应
2021-06-04周旋谭志团任翼陈秋丽吴虹虞道锐
周旋,谭志团,任翼,陈秋丽,吴虹,虞道锐
哮喘是一种以气道阻塞和高反应性为特征的肺部慢性炎症性疾病,据统计全球约有3.4亿不同年龄段的哮喘患者,其中约有1.54亿为儿童患者[1],且发病率呈逐年上升趋势。目前在我国约有2 000万哮喘患者,发病率高达3.0%[2]。儿童哮喘患者具有迁延难愈、反复发作等特点,严重者可影响患儿的生长发育和生活质量,甚至死亡[3]。目前药物性防治是提高儿童哮喘患者生存质量和生存率的重要途径。柚皮素(Naringenin)是一种二氢黄酮类的单体化合物,主要存在于芸香科植物中,如葡萄柚、西红柿、葡萄以及柑橘类等,具有抗菌、抗炎、抗氧化、抗肿瘤、调节脂肪、抗衰老等多种生物学作用[4]。虽然既往有文献表明柚皮素有一定的抗哮喘作用[5],但是其抑制哮喘炎症反应的药效作用及机制仍需进一步研究。
核因子κB(NF-κB)是一种多效性转录因子,已发现其在哮喘模型和哮喘患者发病过程中具有诱导作用[6]。有研究表明NF-κB调控辅助性T2(Th2)细胞因子白细胞介素(IL)-1β、IL-4、IL-5等与哮喘的发病机制密切相关,并且由NF-κB调控的细胞因子也能促进NF-κB在哮喘患者肺部中的表达,加重哮喘的气道炎症反应[7]。另外,NF-κB的激活也与气道组织重塑,即气道周围组织纤维化、平滑肌细胞增生及肥大、黏液生成等有着密切联系[8]。本研究拟用卵清蛋白(Ovalbumin,OVA)诱导建立哮喘大鼠模型,探讨柚皮素对哮喘大鼠气道炎症反应的影响,并验证其作用机制是否与抑制NF-κB信号通路有关,为儿童哮喘的药物治疗提供新思路。
1 材料与方法
1.1 主要试剂与仪器 柚皮素购自上海麦克林生化科技有限公司,纯度≥98%;Sprague-Dawley(SD)大鼠购自上海斯莱克有限公司;OVA、吉姆萨(Giemsa)染色液、苏木精、伊红购于美国Sigma公司,氢氧化铝凝胶溶液购于Thermo公司;抗NF-κB p65、抗NF-κB p50、抗NF-κB抑制蛋白α(IκBα)及β-Actin单克隆兔抗人抗体(细胞实验)和单克隆兔抗鼠抗体(动物实验)购于英国Abcam公司;山羊抗兔或者山羊抗鼠二抗购于北京中杉金桥生物技术有限公司;酶联免疫吸附测定试验(ELISA)试剂盒购自美国Minneapolis公司;RNA提取试剂盒购自Generay公司;PCR试剂盒购自Vazyme公司;A549细胞购自中国科学院上海生命科学研究院细胞资源中心;细胞培养基、血清、双抗购自美国Gibco公司;BCA蛋白浓度测定试剂盒、RIPA裂解液、ECL发光试剂盒购自上海碧云天生物技术公司。RT-PCR仪为CFX connect Real-Time PCR System;显微镜BX43型(OLYMPUS公司);电泳系统为Mini-Proten Tetra System(Bio-Rad公司);凝胶成像仪为ChemiDocXRS+System(Bio-Rad公司)。
1.2 方法
1.2.1 OVA哮喘大鼠模型及实验分组 取SD大鼠22只,体质量160~180 g,采用随机数字表法取5只为正常对照组,将余下17只哮喘大鼠造模,第1天和第8天大鼠腹腔注射10 mg OVA和100 mg氢氧化铝凝胶,第14天开始用2%的OVA溶液雾化激发,每日1次,每次30 min,连续10 d。分别在雾化第7天和第10天各取1只进行模型验证,剩下15只采用随机数字表法分为哮喘模型组、柚皮素100 mg/kg组和柚皮素200 mg/kg组,每组5只。柚皮素组连续灌胃柚皮素7 d,哮喘模型组给予同体积的生理盐水。所有大鼠饲喂标准的啮齿动物饲料和灭菌二级超纯水,摄食环境为明暗12 h循环,温度22~25℃,湿度40%~70%,实验环境适应7 d。
1.2.2 Giemsa染色对支气管肺泡灌洗液(BALF)炎性细胞分类及计数 给药结束后第2天,戊巴比妥钠(50 mg/kg)麻醉脱颈处死哮喘大鼠。留置导管至哮喘大鼠右肺,并固定,用预冷的PBS灌洗右肺3次,1 mL/次,取新鲜肺灌洗液样本共2.4 mL,于4℃1 500 r/min离心10 min,弃上清液,100µL pH=7.4的PBS重悬细胞沉淀,取0.1µL重悬液滴于载玻片上,常温晾干,制成涂片,甲醇固定10 min,将涂片浸入Giemsa染液中常温染色20 s,纯净水洗1 min,将切片浸入1%醋酸溶液分化数秒,纯净水清洗,显微镜下镜检并计数。
1.2.3 肺组织病理学观察和免疫组化染色 取左肺下叶于4%甲醛溶液中固定5 d,修整组织为适当的形状及厚度,梯度乙醇进行脱水处理,二甲苯透明、浸蜡、包埋,切片厚度为4µm,切片放入65℃恒温箱中6~12 h,常温保存。(1)HE染色:二甲苯和乙醇脱蜡复水;将切片浸入苏木精染液中常温染色5 min,自来水洗1 min;将切片浸入1%盐酸乙醇溶液10 s,纯净水清洗至组织返蓝;将切片浸入伊红染液中染色5 min,纯净水洗去玻片上的浮色;无水乙醇梯度脱水、二甲苯透明、中性树胶封固,显微镜下观察。(2)免疫组化:二甲苯和乙醇脱蜡复水;3%H2O237℃孵育15 min阻断、灭活内源性过氧化物酶;PBS冲洗3次;置于0.01 mol/L枸橼酸缓冲液(pH=6.0)中水煮10 min修复抗原,自然冷却至室温,PBS冲洗3次;滴加NF-κB p65和NF-κB p50一抗置4℃冰箱孵育过夜,转至室温平衡30 min,PBS冲洗;滴加二抗,37℃孵育30 min,PBS冲洗3次,每次5 min;DAB反应染色,显微镜下观察反应进度,纯净水清洗,苏木素复染,干燥,封片,拍照。
1.2.4 ELISA检测Th2和NF-κB细胞因子的含量 取大鼠新鲜BALF,按ELISA试剂盒说明书检测BALF中IL-4、IL-5和IL-15的含量。取下腔静脉血,室温静置2 h后,在4℃下以3 000 r/min离心10 min以收集血清,按照ELISA试剂盒说明 书 检测 血 清 中NF-κB p65、NF-κB p50、IκBα的含量。
1.2.5 qPCR检测NF-κB相关基因mRNA表达 Trizol-离心柱法提取左肺上叶总RNA并进行纯度测定和定量;按5×HiScript®ⅡqRTSuperMix 4µL、总RNA(≤1 000 ng)6µL、RNase Free dH2O补齐至20µL配制逆转录反应体系;50℃干浴15 min;85℃2 min终止反应;-20℃保存cDNA。引物序列:内参U6上游5'-CCCATCTATGAGGGTTACGC-3',下游5'-TTTAATGTCACGCACGATTTC-3';NF-κB p65上游5'-AGGATTTCGATTCCGCTACG-3',下游5'-CTCACAGTGCTT⁃GCCCACC-3';NF-κB p50上 游5'-GGCAGCACTCCTTAT⁃CAACC-3',下游5'-GAGGTATCGTCCCATCGTAG-3';IκBα上游5'-TGACCATGGAAGTGATTGGTCAG-3',下游5'-GAT⁃CACAGCCAAGTGGAGTGGA-3'。qPCR扩增:PCR扩增反应体系2×ChamQ SYBR qPCR Master Mix 10µL,上、下游引物各0.6µL,cDNA(稀释至一致水平)8.8µL。qPCR反应条件:95℃30 s;95℃10 s,60℃30 s,40个循环,熔解曲线70~95℃。PCR反应结束后读取Ct值,利用软件Opticon Monitor进行分析,采用2–ΔΔCt法计算mRNA相对表达量。
1.2.6 细胞培养及细胞炎症模型建立 A549细胞培养在含10%胎牛血清和1%双抗的RPMI-1640培养液中,于37℃、5%CO2培养箱中培养,待细胞汇合度达60%左右时,用0.25%Trypsin-EDTA消化传代。脂多糖(LPS)诱导细胞炎症模型:选对数生长期的A549细胞,接种在6孔板内,待细胞贴壁后,用LPS(100µg/L)刺激细胞6 h,更换新鲜培养基继续培养做后续实验。实验分为正常对照组、LPS组、LPS+柚皮素20µmol/L组、LPS+柚皮素40µmol/L组。
1.2.7 免疫荧光检测NF-κB相关蛋白的表达 按1.2.6条件处理细胞后用PBS清洗细胞,4%多聚甲醛室温固定20 min,PBS清洗,0.1%Triton100室温破裂细胞膜20 min,PBS清洗3次,1%FBS室温封闭30 min,PBS清洗,加入NF-κB p65、NF-κB p50、IκBα单克隆抗体(1∶1 000),4℃过夜,PBS清洗3次,按1∶1 000加入二抗,4℃避光孵育2 h,PBS清洗3次,加入浓度为10µg/L的4',6-二脒基-2-苯基吲哚(DAPI)染核,4℃避光孵育20 min,PBS清洗3次;荧光倒置显微镜拍照。
1.2.8 Western blot检测NF-κB相关蛋白表达 按1.2.6条件处理并收集细胞,用RAPI裂解液裂解细胞,在4℃下14 000 r/min低温离心30 min,收集上清液作为总蛋白。使用BCA蛋白测定试剂盒测定样本中蛋白浓度。10%SDS-PAGE,转膜,5%脱脂奶粉封闭2 h,TBST清洗3次。分别与NF-κB p65、NF-κB p50、IκBα(1∶1 000)、β-actin单克隆抗体4℃孵育过夜,TBST洗膜3次,与IgG(1∶2 000)二抗室温孵育1 h,TBST洗膜3次,ECL化学发光试剂盒显色,凝胶图像采集及分析,Image J软件分析条带相应的灰度值。
1.3 统计学方法 GraphPad Prism 8软件进行统计分析。计量资料以±s表示,2组间均数比较采用两独立样本t检验,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 柚皮素减少哮喘大鼠肺部炎性细胞浸润 结果显示,与正常对照组比,哮喘模型组、柚皮素100 mg/kg组和200 mg/kg组的炎性细胞总数、单核细胞、中性粒细胞、嗜酸性粒细胞以及哮喘模型组、柚皮素100 mg/kg组淋巴细胞数均升高(P<0.05);与哮喘模型组比,柚皮素100 mg/kg组炎性细胞总数、中性粒细胞降低,柚皮素200 mg/kg组炎性细胞总数、单核细胞、中性粒细胞、嗜酸性粒细胞以及淋巴细胞数均降低(均P<0.05)。见表1。
Tab.1 Comparison of the number of inflammatory cells in BALF between the four groups表1 各组BALF中炎性细胞数比较(n=5,×104个/mL,±s)

Tab.1 Comparison of the number of inflammatory cells in BALF between the four groups表1 各组BALF中炎性细胞数比较(n=5,×104个/mL,±s)
**P<0.01;a与正常对照组比较,b与哮喘模型组比较,P<0.05;表2~4同
?
2.2 柚皮素减轻哮喘大鼠肺组织和支气管炎症反应 HE染色显示正常对照组大鼠的肺组织和气管结构未见明显异常;哮喘模型组大鼠的肺组织可见大量炎性细胞浸润,肺泡壁明显增厚,肺泡腔缩小甚至塌陷,部分肺泡过度扩张;与哮喘模型组比,柚皮素100 mg/kg组和柚皮素200 mg/kg组大鼠肺部炎性细胞浸润明显减少,可见少量嗜酸性粒细胞,局部肺泡壁轻度增厚,多数肺泡结构正常,可见少数肺泡扩张,见图1。哮喘模型组大鼠的支气管可见黏膜水肿,黏膜上皮脱落,假复层结构消失,黏膜下层组织水肿、血管充血,并伴有大量炎性细胞浸润;与哮喘模型组比,柚皮素100 mg/kg组和柚皮素200 mg/kg组大鼠的支气管炎性细胞浸润明显减少,黏膜上皮及纤毛结构相对正常,气道黏膜及黏膜下层可见少许脱落,见图1。

Fig.1 HE staining of the pathological changes of lung tissue and bronchus(×400)图1 HE染色观察肺组织和支气管病理学变化(×400)
肺组织病理评分结果显示,与正常对照组比较,哮喘模型组肺组织病理评分升高(P<0.05);与哮喘模型组比较,柚皮素100 mg/kg组和柚皮素200 mg/kg组的肺组织病理评分明显降低(P<0.05),见图2A。气管组织病理评分结果显示,与正常对照组比较,哮喘模型组支气管组织病理评分升高(P<0.05);与哮喘模型组相比,柚皮素100 mg/kg组支气管组织病理评分差异无统计学意义,而柚皮素200 mg/kg组出现降低(P<0.05),见图2B。

Fig.2 Comparison of pathological scores of lung tissue and bronchus of rats in each group图2 各组大鼠肺组织和支气管组织病理评分比较
2.3 柚皮素抑制哮喘大鼠肺部Th2细胞因子的表达 与正常对照组比较,哮喘模型组大鼠BALF中IL-4、IL-5、IL-13的含量升高(均P<0.05);与哮喘模型组比,柚皮素100 mg/kg组和柚皮素200 mg/kg组大鼠肺部组织IL-4、IL-5、IL-13的含量明显降低(均P<0.05)。见表2。
2.4 柚皮素抑制哮喘大鼠NF-κB通路活性 ELISA结果显示,与正常对照组相比,哮喘模型组大鼠血清NF-κB p65、NF-κB p50的含量升高,IκBα含量下降(P<0.05);与哮喘模型组比,柚皮素100 mg/kg组NF-κB p65和NF-κB p50的含量均明显降低(P<0.05),柚皮素200 mg/kg组大鼠血清NF-κB p65、NF-κB p50降低,IκBα的含量升高(P<0.05),见表3。肺部免疫组化结果显示,大鼠哮喘模型组中NFκB p65、NF-κB p50的表达较正常对照组明显增多,而柚皮素100 mg/kg和200 mg/kg组哮喘大鼠肺部组织NF-κB p65、NF-κB p50的表达显著低于哮喘模型组,见图3、4。
Tab.2 Comparison of the contents of Th2 cytokines IL-4,IL-5,and IL-13 in BALF between the four groups表2 各组BALF中Th2细胞因子IL-4、IL-5、IL-13的含量比较 (n=5,ng/L,±s)

Tab.2 Comparison of the contents of Th2 cytokines IL-4,IL-5,and IL-13 in BALF between the four groups表2 各组BALF中Th2细胞因子IL-4、IL-5、IL-13的含量比较 (n=5,ng/L,±s)
?
Tab.3 Comparison of the content of NF-κB related proteins in intravenous serum of rats betweenthe four groups表3 各组大鼠静脉血清中NF-κB相关蛋白的含量比较(n=5,ng/L,±s)
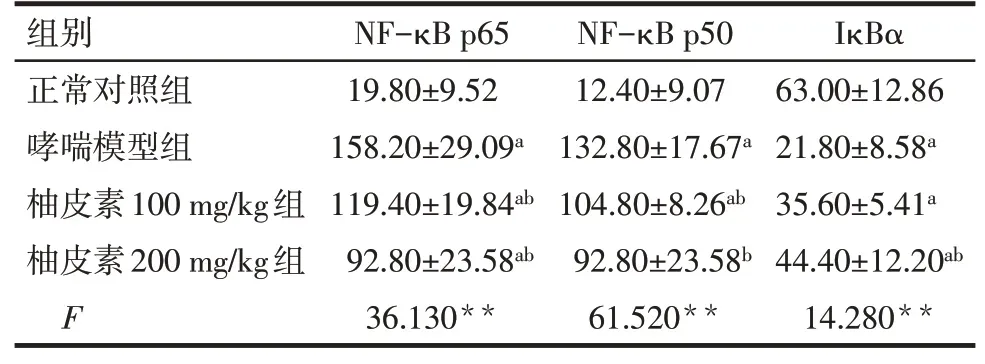
Tab.3 Comparison of the content of NF-κB related proteins in intravenous serum of rats betweenthe four groups表3 各组大鼠静脉血清中NF-κB相关蛋白的含量比较(n=5,ng/L,±s)
?
qPCR结果表明,与正常对照组比较,哮喘模型组大鼠肺部NF-κB p65、NF-κB p50的mRNA表达水平升高,IκBα的mRNA表达水平下降(P<0.05);与哮喘模型组比,柚皮素100 mg/kg组和200 mg/kg组哮喘大鼠肺部NF-κB p65和NF-κB p50的mRNA表达水平均下降(P<0.05),IκBαmRNA表达水平变化差异无统计学意义(P>0.05),见表4。
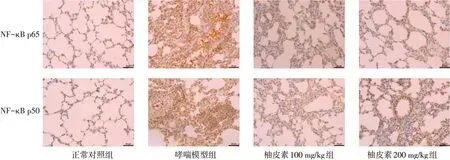
Fig.3 Immunohistochemical detection of lung NF-κB protein expression in asthmatic rats(×400)图3 免疫组化检测哮喘大鼠肺部NF-κB蛋白的表达(×400)
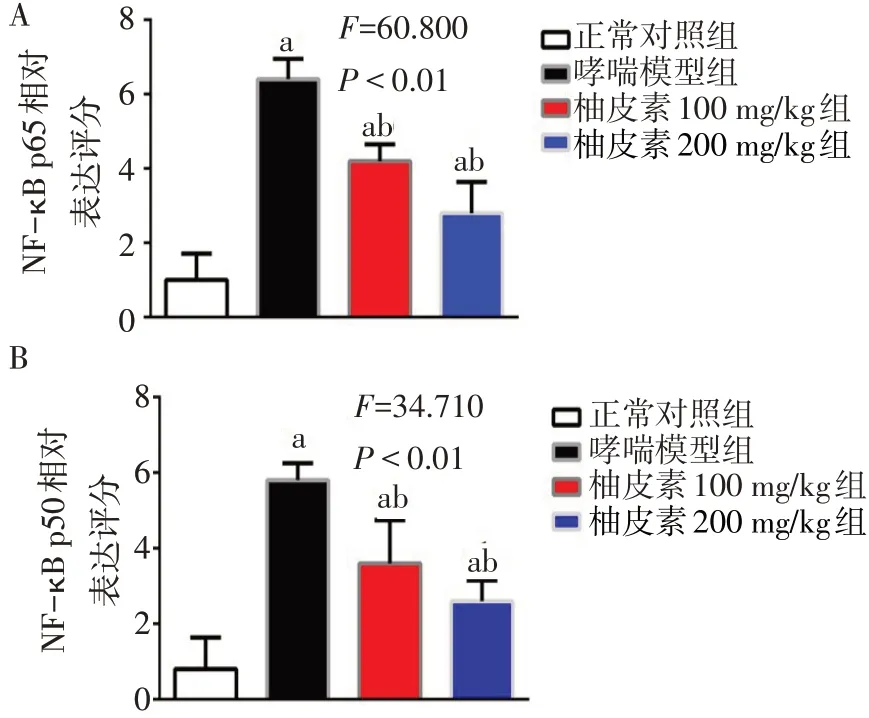
Fig.4 Histochemical score of relative expression of NF-κB protein in lungs of asthmatic rats图4 哮喘大鼠肺部NF-κB蛋白相对表达的组织化学评分
Tab.4 Comparison of the expression levels of NF-κB related gene mRNA in lung tissues of rats between the four groups表4各组大鼠肺组织中NF-κB相关基因mRNA的表达水平比较 (n=5,±s)

Tab.4 Comparison of the expression levels of NF-κB related gene mRNA in lung tissues of rats between the four groups表4各组大鼠肺组织中NF-κB相关基因mRNA的表达水平比较 (n=5,±s)
?
2.5 柚皮素抑制LPS诱导A549细胞NF-κB的表达 Western blot结果表明,与正常对照组比,LPS组NF-κB p65、NF-κB p50蛋白表达水平升高,IκBα蛋白表达水平降低(P<0.05);与LPS组比,LPS+柚皮素20µmol/L组和LPS+柚皮素40µmol/L组NF-κB p65、NF-κB p50蛋白表达水平降低,IκBα蛋白表达水平升高(P<0.05)。见图5、6。免疫荧光结果表明,与正常对照组相比,A549细胞经LPS诱导后NFκB p65、NF-κB p50蛋白的表达水平升高,IκBα的表达降低;与LPS组相比,当用20µmol/L和40µmol/L的柚皮素处理A549细胞后NF-κB p65和NF-κB p50的表达降低,而IκBα的表达升高,见图7。

Fig.5 Expressions of NF-κB related proteins in A549 cells detected by Western blot assay图5 Western blot检测A549细胞中NF-κB相关蛋白的表达
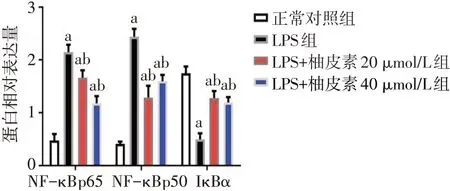
Fig.6 Comparison of relative expressions of NF-κB pathway related proteins between four groups图6 各组NF-κB通路相关蛋白的相对表达量比较
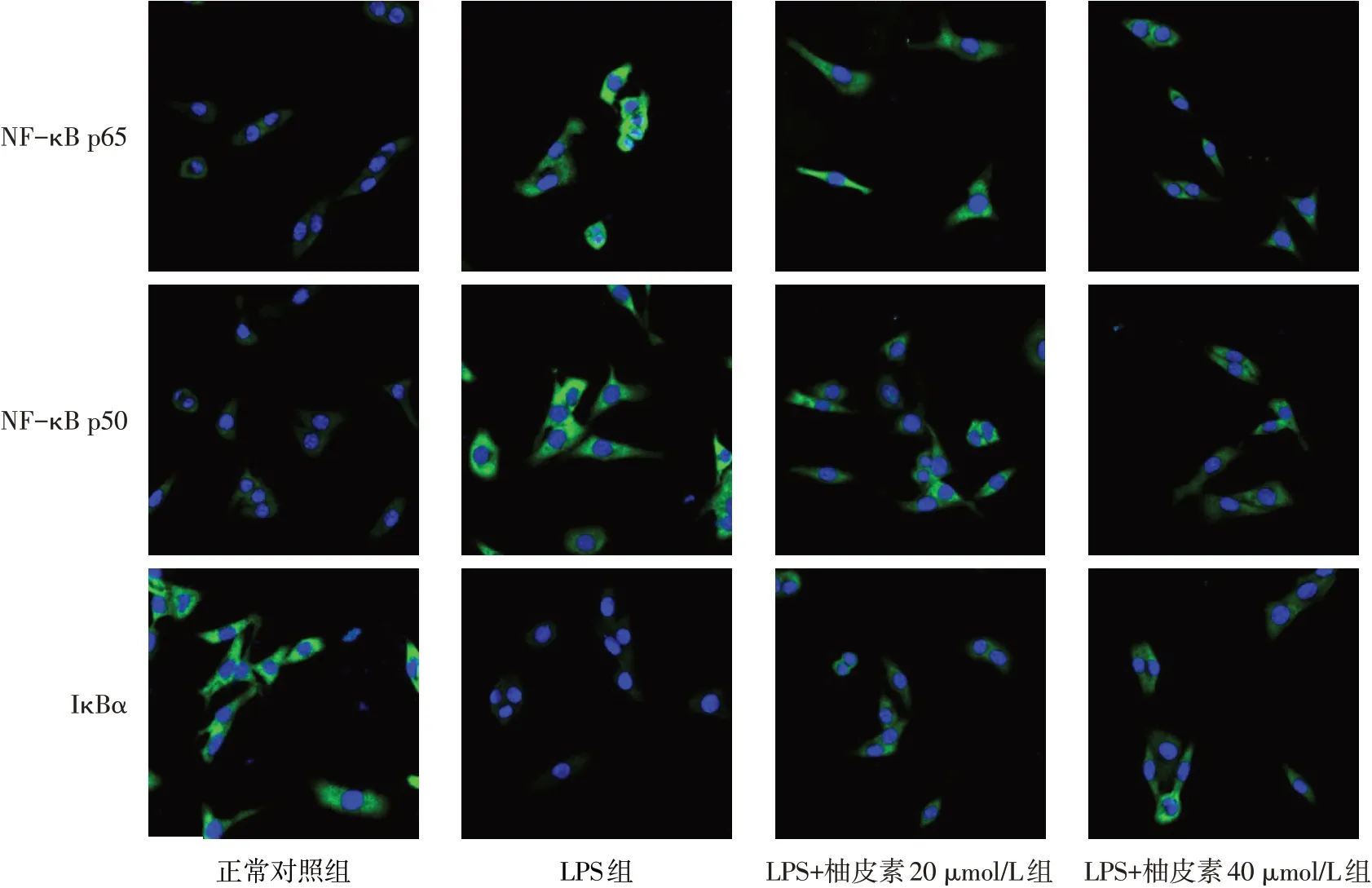
Fig.7 Immunofluorescence detection of NF-κB related protein expressions in A549 cells(×400)图7 免疫荧光检测A549细胞中NF-κB相关蛋白的表达水平(×400)
3 讨论
3.1 天然药物治疗哮喘的新思路 研究显示,在我国大陆地区仅有2.5%左右哮喘儿童的症状得到控制,而该数据并未达到全球哮喘防治创议指南要求[9]。减少哮喘患儿慢性持续期和临床缓解期的气道慢性炎症可降低哮喘的发作频率[10],慢性持续期的防治又是降低小儿哮喘发病率的重要举措。天然单体药具有来源广、低毒、安全、经济等特点,是开发小儿哮喘慢性持续期治疗药物的重要方向。据报道多种天然药物具有改善气道炎症的潜在作用,如黄芩苷可减轻哮喘炎症和气道高反应性[11],白花前胡甲素能改善哮喘气道重塑[12],表儿茶素没食子酸酯可抑制气道炎症和上皮-间质转化[13]等。本研究显示,柚皮素可减少哮喘大鼠肺部单核细胞、中性粒细胞、嗜酸性粒细胞、淋巴细胞等炎性细胞浸润,改善肺泡的生理结构,减少黏膜上皮脱落,促进支气管假复层及纤毛结构修复,与以往报道的柚皮素可减轻哮喘炎症、改善气道高反应性和气道重塑的结果一致[5],提示柚皮素具有成为小儿哮喘防治药物的潜力。
3.2 柚皮素抑制Th2细胞因子的作用 Th2细胞因子IL-4、IL-5、IL-13与哮喘的发病有着密切联系,IL-4可促进血管内皮细胞黏附分子的表达,使嗜酸性粒细胞在炎症部位聚集、浸润,形成气道炎症[14];IL-5对于嗜酸性粒细胞的分化、成熟以及在变应原诱导的嗜酸性粒细胞气道炎症中起重要作用[15];而IL-13可以促进B细胞分化,直接导致气道炎症和气道高反应[16]。本研究发现IL-4、IL-5、IL-13在哮喘模型组肺组织中高表达,而柚皮素能有效降低3种炎性因子的表达,表明其可能通过抑制Th2细胞因子的促炎作用改善哮喘炎症反应。
3.3 柚皮素经NF-κB信号通路发挥抗哮喘的作用 NF-κB通路活化是哮喘发病的重要作用机制之一,当肺或支气管受各类因素刺激后,细胞质的IκBα解除对NF-κB p65/NF-κB p50二聚体的抑制作用,IκBα磷酸化降解,NF-κB p65/NF-κB p50二聚体从细胞质解离进入细胞核,促进促炎性细胞因子的合成和释放[17]。因此NF-κB通路有望成为哮喘治疗的潜在靶点。研究发现多种单体天然药物可在哮喘大鼠靶向作用于NF-κB通路,如甘草次酸可以通过抑制NF-κB的表达,降低炎症介质IL-5、IL-6等的表达,改善大鼠氧化应激状态[18];雷公藤内酯醇可抑制IκB激酶α(IκB kinase-α,IKK-α)及p-IκB的表达,减少细胞因子和趋化因子的释放与产生,从而发挥抗哮喘的作用[19]。本研究显示,在哮喘大鼠模型中NF-κB p65、NF-κB p50高表达、IκBα低表达,而柚皮素能下调NF-κB p65、NF-κB p50,上调IκBα。另外,为进一步阐明柚皮素抑制NF-κB通路的作用,本研究利用LPS诱导建立A549细胞炎症模型,发现柚皮素可抑制LPS-A549细胞质中NF-κB相关蛋白的表达,逆转IκBα的表达;同样Yang等[20]也发现在中性粒细胞弹性蛋白酶诱导的呼吸道上皮细胞炎症模型中,柚皮素可抑制NF-κB信号通路的活性。这就提示NF-κB参与哮喘的进程,而柚皮素可降低NF-κB信号通路的活性是其发挥防治哮喘作用的潜在机制。
综上所述,本研究结果表明柚皮素具有显著抑制哮喘大鼠肺部和支气管炎症反应的作用,并在体内外模型中证实柚皮素发挥抗炎的潜在作用机制与抑制NF-κB信号通路有关,其有望成为治疗哮喘慢性持续期的药物。虽然柚皮素对哮喘大鼠具有良好药效作用,但其药效的安全性及其更深、更全面的作用机制并不十分清楚,在今后的研究工作中还需更深入的探讨,为哮喘的药物治疗提供理论依据。
