自噬相关蛋白在脓毒症并发急性呼吸窘迫综合征患者中的水平变化及临床意义
2021-06-02何子纯张佳怡
何子纯 张佳怡
重庆市红十字会医院(江北区人民医院)呼吸内科(重庆400020)
脓毒症是患者对严重感染反应失调引起的器官功能障碍综合征,发病率为38~100/10 万,病死率为22% ~55%[1]。由于脓毒症患者全身处于炎症激活状态,其中1/3 的患者可能发展为急性呼吸窘迫综合征(ARDS)[2]。尽管近年来在重症监护及脓毒症合并ARDS 的基础与临床相关研究方面,取得了一定进展,但患者病死率仍较高,其主要原因与脓毒症并发ARDS 患者早期诊断率及病情变化评估不足有关。近年来研究显示,细胞自噬参与了调控机体炎症反应,在生理条件下,机体自噬处于动态平衡状态,对于维持内环境稳态发挥了重要调控作用[3]。在器官功能损伤或障碍中,如慢性阻塞性肺疾病、糖尿病肾病患者,其自噬水平显著降低,与患者体内炎症水平呈显著负相关[4-5]。对于脓毒症并发ARDS 患者体内自噬水平如何,目前相关研究较少。因此,本研究旨在观察自噬相关蛋白在脓毒症并发ARDS 患者体内水平变化,探讨自噬在该类疾病炎症反应中的作用。
1 资料与方法
1.1 临床资料以重庆市红十字会医院呼吸内科及重症医学科(2017年1月至2020年8月)就诊的脓毒症患者235 例为研究对象。纳入标准:所有患者均满足脓毒症诊断标准[6];年龄≥18 岁。排除标准:严重肝肾功能不全;恶性肿瘤;自身免疫性疾病;入院24 h内死亡的患者。其中男性125例,女性110 例,年龄31 ~79 岁,平均年龄(55.3 ± 9.4)岁。根据是否合并ARDS,分为ARDS 组(104 例)和非ARDS 组(131 例)。同时选择我院行健康体检人群40 例为对照组。ARDS 诊断参照2011年柏林定义标准[7]。根据ARDS 组患者28 d 预后水平,分为存活组(66 例)和死亡组(38 例)。该研究获得本院伦理委员会批准,并征得了患者家属知情同意。
1.2 方法
1.2.1 数据采集记录患者一般临床资料,包括性别、年龄、原发疾病、急性生理与慢性健康状况评分(APACHE Ⅱ)、乳酸水平及28 d 病死率。
1.2.2 检测自噬相关基因mRNA 水平入院即刻收集患者外周血,提取单个核细胞(PBMC),采用实时定量PCR 检测自噬相关基因mRNA 水平。简要方法如下,采用TRIzol 试剂(Invitrogen 公司)提取PBMC 中总的RNA,然后进行逆转录,逆转录方法按试剂盒说明(Takara 公司)。使用ABI Prism 7000 序列检测系统(美国Bio⁃rad 公司)进行RT⁃qP⁃CR反应。本研究中使用的引物序列如下:Beclin⁃1,正向5′⁃GGCTGAGAGACTGGATCAGG⁃3′和反向5′⁃CTGCGTCTGGGCATAACG⁃3⁃3′;LC3⁃Ⅱ,正向5′⁃GAGAAGCAGCTTCCTGTTCTGG⁃3′和反向5′⁃GTG⁃TCCGTTCACCAACAGGAAG⁃3′;p62,正向5′⁃GCT⁃CTTCGGAAGTCAGCAAACC⁃3′和反向5′⁃GCAGTT⁃TCCCGACTCCATCTGT⁃3′;GAPDH,正向5′⁃GGAC⁃TGACCTGCCGTCTAG⁃3′和反向5′⁃TAGCCCAGGA⁃TGCCCTTGAG⁃3′。以GAPDH 为内参,使用2-ΔΔCq方法计算相对mRNA 水平。
1.2.3 检测自噬相关基因蛋白表达水平提取PBMCs 总蛋白,使用Bradford 方法测定蛋白浓度。每孔加入等量蛋白,通过10%聚丙烯酰胺凝胶进行电泳,转移置硝基纤维素膜。采用牛血清白蛋白封闭,然后与稀释的一抗进行孵育,抗Beclin⁃1抗体(1∶500)、抗LC3 抗体(1∶500)抗p62 抗体(1∶400)及抗GAPDH 抗体(1∶800)。次日孵育辣根过氧化物酶标记的二抗(1∶10 000)。以GAPDH 为内参,计算目的条带与GAPDH 灰度比值。
1.2.4 检测外周血细胞因子及乳酸水平采用ELISA 法测定不同组间外周血IL⁃1β、TNF⁃α、IL⁃6和IL⁃10 水平,具体操作依据试剂盒说明书(武汉博士德生物公司)进行。
1.3 统计学分析采用SPSS 19.0 进行数据分析。计量资料以表示,两组间比较采用t检验。采用Spearman 相关性分析。运用Graphpad 软件做ROC 曲线分析,计算ROC 曲线下面积(AUC)、最佳工作点(OOP)、敏感性及特异性,以P<0.05 为差异有统计学意义。
2 结果
2.1 一般临床资料比较ARDS 组患者血乳酸、APACHE Ⅱ评分及28 d 病死率显著高于非ARDS组(P<0.05)。ARDS 组和非ARDS 组患者在性别、年龄、采血时间、原发病等方面比较差异无统计学意义(P>0.05),见表1。
2.2 各组间自噬相关蛋白及细胞因子水平比较与对照组比较,肺内疾病并发的ARDS 组、肺外疾病并发的ARDS组和非ARDS组PBMCs 中Beclin⁃1、LC3⁃II mRNA 及蛋白表达和外周血IL⁃10 水平显著降低,而p62 mRNA 及蛋白表达和外周血IL⁃1β、TNF⁃α及IL⁃6水平显著升高(P<0.05)。与非ARDS组比较,肺内疾病并发的ARDS 组、肺外疾病并发的ARDS 组PBMCs 中Beclin⁃1、LC3⁃II mRNA 及蛋白表达和外周血IL⁃10 水平显著降低,而p62 mRNA 及蛋白表达和外周血IL⁃1β、TNF⁃α及IL⁃6水平显著升高(P<0.05)。肺内疾病并发的ARDS组和肺外疾病并发的ARDS 组上述指标比较,差异无统计学意义(P>0.05),见表2 及图1。
表1 各组患者一般临床资料比较Tab.1 Comparison of general clinical data in each group ±s,例(%)

表1 各组患者一般临床资料比较Tab.1 Comparison of general clinical data in each group ±s,例(%)
注:与非ARDS 组比较,*P <0.05
指标性别(男/女)平均年龄(岁)采血时间(min)原发病(例)重症肺炎重症胰腺炎腹腔感染胆道感染外科创伤其他乳酸(mmol/L)APACHEⅡ评分(分)28 d 病死率(%)对照组(40 例)21/19 55.10±7.28 1.20±0.34---------ARDS 组(104 例)55/49 55.65±8.19 2.60±0.48 25(24.1)21(20.2)20(19.2)15(14.4)13(12.5)10(9.6)8.92±1.81*18.94±3.13*38(36.5)*非ARDS 组(131 例)70/61 54.90±9.60 2.68±0.51 32(24.4)26(19.8)25(19.1)18(13.7)15(11.5)15(11.5)5.20±1.47 13.48±2.05 30(22.9)t,F/χ2值0.014 0.216 157.200 0.005 0.004 0.001 0.022 0.061 0.205 17.390 16.090 5.244 P 值0.993 0.806<0.001 0.945 0.948 0.977 0.811 0.805 0.650<0.001<0.001 0.022
表2 各组患者自噬相关基因mRNA 及细胞因子水平比较Tab.2 Comparison of autophagy⁃related gene mRNA and cytokine levels in each group ±s

表2 各组患者自噬相关基因mRNA 及细胞因子水平比较Tab.2 Comparison of autophagy⁃related gene mRNA and cytokine levels in each group ±s
注:与对照组比较,*P <0.05;与非ARDS 组比较,#P <0.05
组别对照组非ARDS 组肺内疾病并发ARDS 组肺外疾病并发ARDS 组F 值P 值例数40 131 25 79 Beclin⁃1 mRNA 1.03±0.13 0.83±0.10*0.64±0.19*#0.62±0.17*#94.95<0.001 LC3⁃II mRNA 1.05±0.10 0.86±0.13*0.70±0.18*#0.68±0.15*#74.70<0.001 p62 mRNA 1.02±0.11 1.79±0.15*2.14±0.22*#2.18±0.18*#491.00<0.001 IL⁃1β(pg/mL)10.20±3.28 28.82±5.65*39.10±6.83*#40.02±7.24*#238.80<0.001 TNF⁃α(pg/mL)8.40±2.60 22.12±4.80*30.26±6.04*#30.64±5.50*#202.10<0.001 IL⁃6(pg/mL)14.12±3.50 30.40±4.58*36.65±5.10*#37.04±6.03*#204.10<0.001 IL⁃10(pg/mL)29.50±4.20 18.90±3.10*13.60±3.28*#13.35±2.97*#236.60<0.001
2.3 不同ARDS 预后组间自噬相关蛋白及细胞因子水平比较与存活组比较,死亡组PBMCs 中Beclin⁃1、LC3⁃ⅡmRNA 及蛋白表达和外周血IL⁃10水平显著降低,而p62 mRNA 及蛋白表达和外周血IL⁃1β、TNF⁃α及IL⁃6水平显著升高(P<0.05),见表3。
2.4 相关性分析ARDS组患者Beclin⁃1mRNA与外周血IL⁃1β和TNF⁃α水平呈负相关(IL⁃1β:r=-0.846,P<0.001;TNF⁃α:r=-0.735,P<0.001);LC3⁃II mRNA 与外周血IL⁃1β和TNF⁃α水平也呈负相关(IL⁃1β:r=-0.416,P<0.001;TNF⁃α:r=-0.359,P<0.001),p62 mRNA 与外周血IL⁃1β和TNF⁃α水平也呈正相关(IL⁃1β:r=0.856,P<0.001;TNF⁃α:r=0.524,P<0.001),见图2。
2.5 ROC 曲线分析ROC 曲线分析表明,Beclin⁃1 mRNA 区分ARDS 组存活和非存活患者的AUC 为0.818(95%CI:0.743 ~0.913),敏感性和特异性分别为75.96%和80.49%,最佳的临界点是0.54。而LC3⁃ⅡmRNA 区分ARDS 组存活和非存活患者的AUC 为0.829(95%CI:0.738 ~0.921),敏感性和特异性分别为81.82%和75.61%,最佳的临界点是0.57。p62 mRNA 区分ARDS 组存活和非存活患者的AUC 为0.794(95%CI:0.705 ~0.883),敏感性和特异性分别为71.19%和71.23%,最佳的临界点是2.23,见图3。
3 讨论
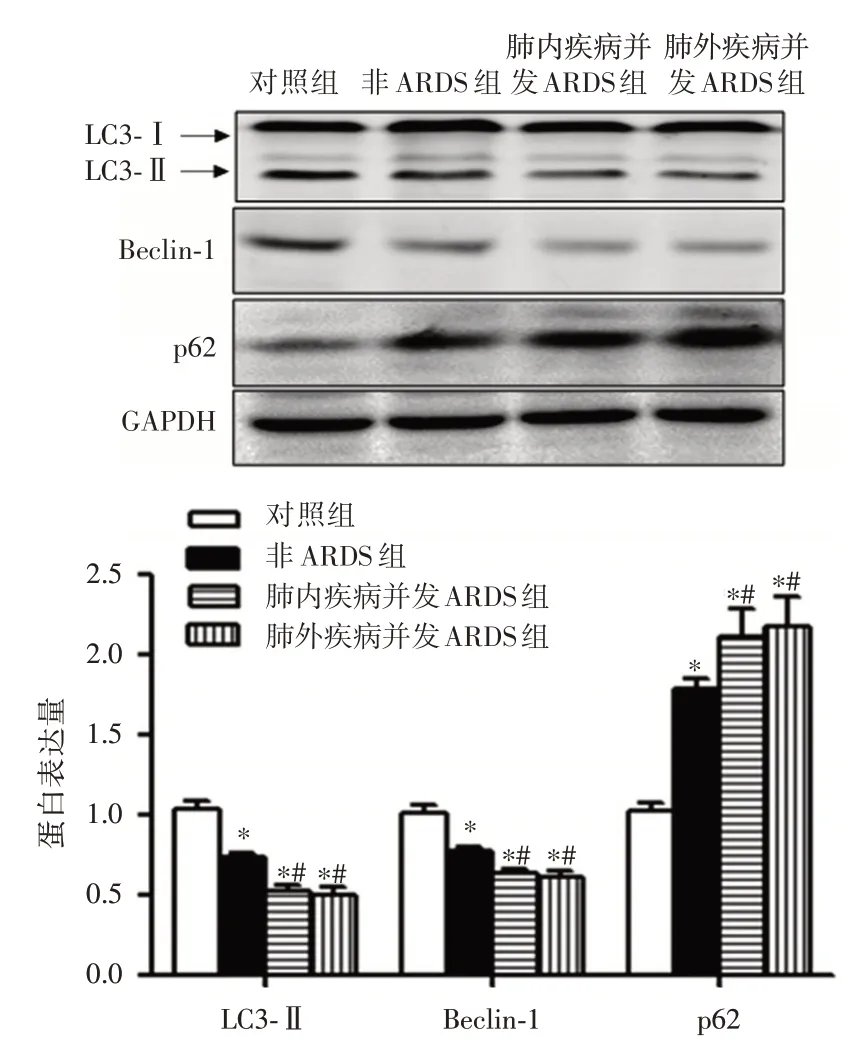
图1 各组患者自噬相关基因蛋白表达水平比较Fig.1 Comparison of protein expression levels of autophagy⁃related genes in each group
脓毒症为患者机体对感染的反应失调引起的器官功能障碍,其主要特征为机体合成与释放大量炎性细胞因子[8]。过度的炎症反应和活性氧,导致线粒体功能障碍,随后引起器官功能衰竭[9]。肺是脓毒症损伤的主要靶器官之一,一旦并发ARDS,患者病死率会显著升高[10]。目前,对于脓毒症并发ARDS的早期识别和预后评估的生物标志物较少。有部分研究显示,如与单独使用肺损伤预测评分相比,联合血浆血管生成素⁃2可有效的提高早期ARDS 的预测值[11];尿酸与ARDS 患者病死率呈正相关,通过检测尿酸水平,对于预后的评估有一定价值[12]。但目前这些生物标记物的相关临床研究证据仍偏少,并未在临床得到广泛开展与运用。
相关研究[13-14]显示,自噬参与了炎症性疾病的发生、发展过程,对于疾病的诊断及病情的评估有一定的运用前景。自噬是一种细胞内降解途径,细胞通过该途径回收细胞质并降解过量或缺陷的细胞器,维持体内稳态[15]。动物研究[16]结果表明,自噬在感染性损伤后会短暂性的升高,但随后表达及活性水平显著受到抑制。在脓毒症引起的肝损伤中,自噬水平与肝功能障碍、肝细胞损伤及细胞凋亡程度密切相关,自噬水平的降低可能是导致脓毒症肝衰竭的主要原因之一[17]。因此,自噬成为炎症性疾病治疗的重要靶标,通过维持或增加体内自噬水平,同时消除抑制自噬的因素是重要的治疗策略[18]。对于脓毒症并发ARDS 患者中,自噬表达水平如何,相关研究较少。本研究结果显示,与脓毒症组比较,脓毒症并发ARDS 患者体内自噬水平显著降低,而炎症指标显著升高,提示脓毒症并发ARDS患者体内自噬处于抑制状态。在临床实践中,生物标志物不仅用于疾病的早期诊断及病情严重性评估,还可预测临床结局。对于脓毒症并发ARDS 患者预后水平的预测,相关临床研究也提出了部分生物学标记物,如C⁃反应蛋白、降钙素原等,但特异性均偏低。本研究结果显示,死亡组患者体内自噬水平显著低于存活组患者,ROC 曲线发现,自噬相关蛋白对于脓毒症并发ARDS患者预后评估的敏感性和特异性均较高,表明其可能成为预测脓毒症并发ARDS患者预后不佳的有效指标。较低的自噬水平,促进了炎症反应的放大。研究显示,表观遗传学机制包括基因甲基化、组蛋白修饰、mi⁃croRNA等参与了调控自噬[19-20],对表观遗传学在自噬调控方面的深入研究,将有助于探索出针对炎症性疾病如脓毒症并发ARDS 患者新的治疗策略。本研究局限性在于:(1)可能存在脓毒症并发ARDS确诊偏低的情况,有患者ARDS症状不明显,存在漏诊发生可能;(2)样本量偏低,对研究结果产生偏倚;(3)所有患者均来自同一医院,多中心随机双盲研究将有助于更好的进行评估。
表3 两组患者自噬相关基因mRNA 及细胞因子水平比较Tab.3 Comparison of autophagy⁃related gene mRNA and cytokine levels between the two groups ±s

表3 两组患者自噬相关基因mRNA 及细胞因子水平比较Tab.3 Comparison of autophagy⁃related gene mRNA and cytokine levels between the two groups ±s
注:与存活组比较,*P <0.05
组别存活组死亡组t 值P 值例数66 38 Beclin⁃1 mRNA 0.63±0.11 0.54±0.10*4.151<0.001 LC3⁃ⅡmRNA 0.69±0.12 0.58±0.09*4.908<0.001 p62 mRNA 2.10±0.18 2.26±0.20*4.190<0.001 IL⁃1β(pg/mL)38.82±4.62 42.10±5.10*3.356 0.001 TNF⁃α(pg/mL)26.20±4.02 32.58±4.95*7.153<0.001 IL⁃6(pg/mL)35.80±4.30 39.26±4.60*3.382<0.001 IL⁃10(pg/mL)13.82±2.10 11.70±2.36*4.737<0.001
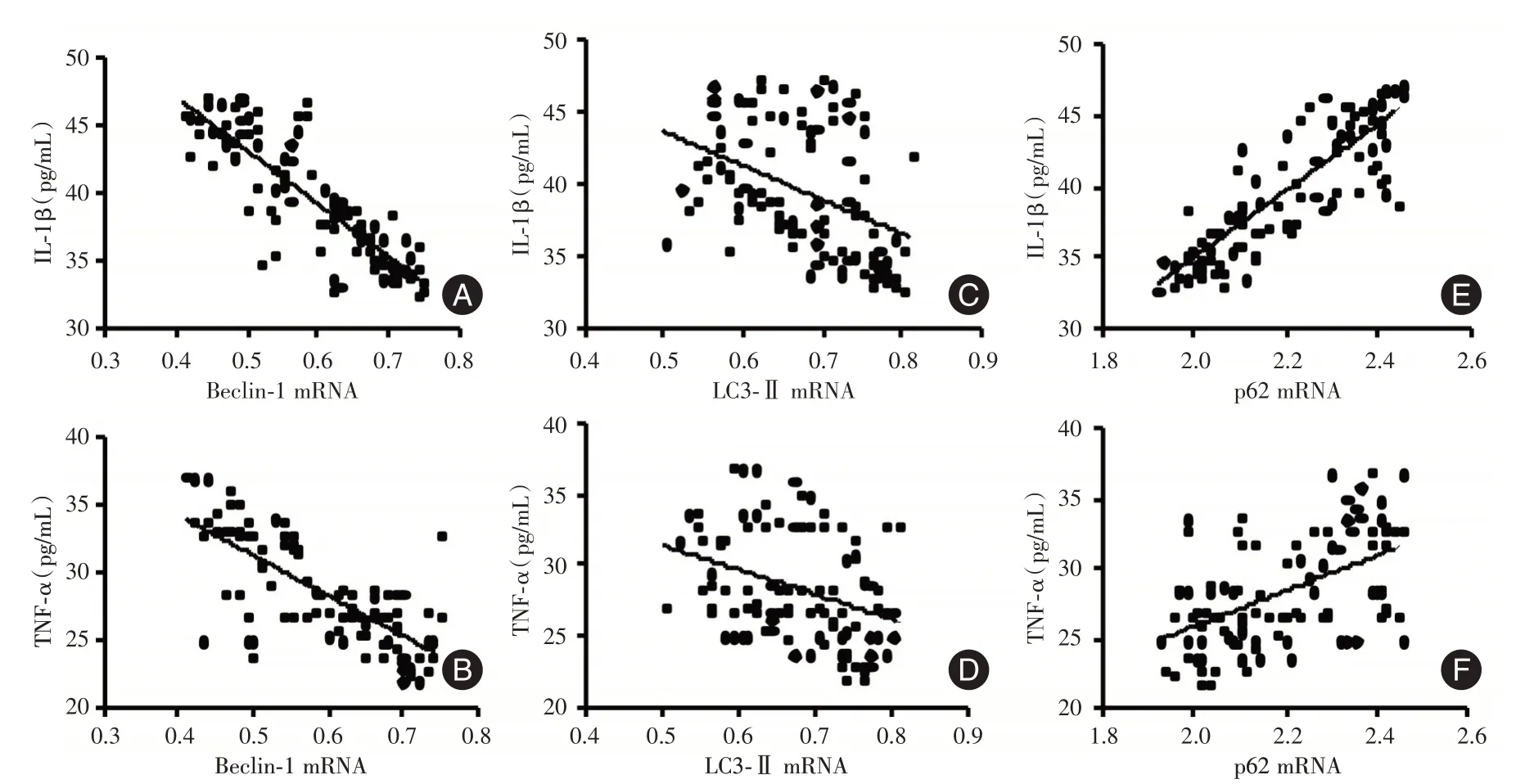
图2 相关性分析Fig.2 Correlation analysis
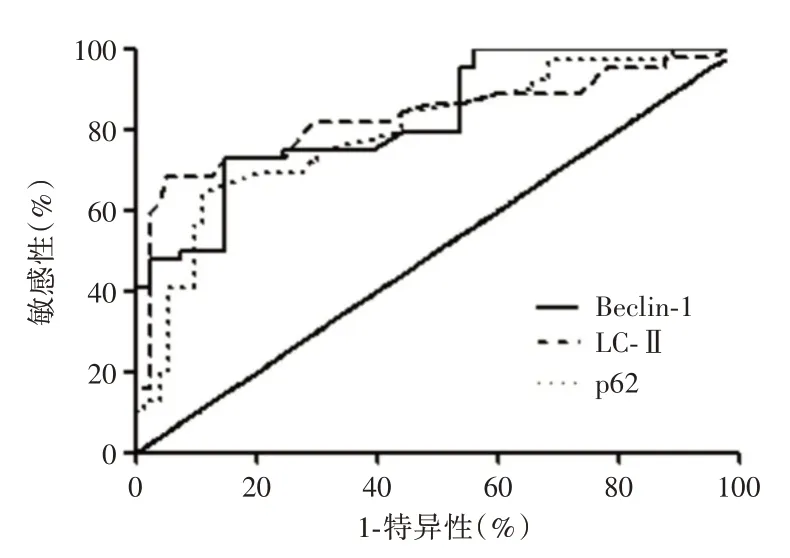
图3 各指标ROC 曲线分析Fig.3 ROC curve analysis of each indicator
综上所述,本研究结果显示,自噬水平的降低参与了脓毒症并发ARDS的发生及发展,通过检测自噬水平,对患者预后不佳的评估具有一定临床价值。
