不同的培养条件对脑胶质瘤U251细胞增殖及凋亡的影响
2021-06-02方金梅孔令玲赵于飞吴爱林
方金梅,王 凡,孔令玲,赵于飞,方 晶,吴爱林,刘 云
脑胶质瘤是成人中最常见的中枢神经系统肿瘤之一,其恶性程度高、预后差。胶质母细胞瘤是WHO Ⅳ级恶性脑胶质瘤。其临床特点表现为侵袭性生长,通常手术无法完全切除,而残存的肿瘤对放化疗不敏感、复发率高、预后差,且中位生存期仅为15个月。脑胶质瘤的发生及发展是由多因素参与并受多步骤调控的复杂过程。研究表明,受体络氨酸激酶在大多数脑胶质瘤中过表达,其介导的信号转导通路的异常激活是脑胶质瘤的重要分子生物学特征之一。其中,丝裂原活化蛋白激酶MAPK信号通路在调节脑胶质瘤细胞的增殖、分化及抗凋亡中起到关键的作用。此外,ERK1/2作为MAPK信号通路重要的下游分子,在脑胶质瘤患者的肿瘤组织中高表达;体外研究显示ERK1/2在脑胶质瘤细胞株以及胶质瘤原代肿瘤细胞中持续表达,而抑制ERK1/2信号影响脑胶质瘤细胞的增殖、迁移和分化。Wang et al发现,细胞的培养条件影响人胶质母细胞瘤细胞株U251细胞中MAPK/ERK1/2信号通路的激活。母代细胞的生长状态(如处在细胞生长曲线的指数期或平台期)以及其传代细胞的种植密度均对蛋白激酶ERK1/2的磷酸化产生影响;然而,对U251细胞功能的影响及相关分子机制尚未阐明。基于此,该研究将设定4种培养方式来探究不同的细胞培养条件对U251生长状况的影响及相关机制。
1 材料与方法
1.1 细胞培养
人胶质瘤U251细胞用含10%胎牛血清及100 U/ml青-链霉素的RPMI 1640培养液培养,并在37 ℃、5% CO饱和湿度的培养箱中培养。细胞采用胰酶消化,每3~4 d进行传代培养。实验所用的U251细胞传代次数均在12次之内。1.2 细胞增殖实验
培养U251细胞至指数期及平台期,取相应的细胞重新种植于高密度(8×10/cm)及低密度(2.4×10/cm)[相对于正常细胞培养密度(4×10/cm)]。现设定以下4种培养方式:① EH,母代处于指数期的U251细胞以高密度种植;② EL,母代处于指数期的U251细胞以低密度种植;③ PH,母代处于平台期的U251细胞以高密度种植;④ PL,母代处于平台期的U251细胞以低密度种植。在各组细胞中采用胰酶消化、台盼蓝染色后,进行细胞计数;每次实验重复3次后,绘制生长曲线。1.3 Western blot检测
用蛋白裂解液RIPA提取不同培养状态及时间点(6、24、48 h)的U251细胞蛋白,并利用Bradford法测定总蛋白浓度。采用Western blot检测各组蛋白表达量变化,包括p-ERK1/2,cleaved-caspase3、cleaved-caspase8、P27、cyclinD1、p-PLK、p-FPAK。每组用15~20 μg蛋白加入同体积的2×蛋白上样缓冲液,于95 ℃ 煮沸5 min,用12% SDS-PAGE将蛋白分离,后将蛋白转移至硝酸纤维膜,5% BSA室温封闭1 h,随后在一抗中孵育、4 ℃过夜。第2天室温孵育二抗1 h。最终使用ECL 显色液于暗室曝光显影。1.4 半胱天冬酶-3活性实验
采用比色活性测定试剂盒检测半胱天冬酶(caspase)-3的活性,操作如下:细胞在冰上用冰裂解液(50 mmol/L HEPES、100 mmol/L NaCl、0.1% CHAPS、100 μmol/L EDTA、1 mmol/L DTT)裂解,20 μl的细胞提取物加入70 μl的缓冲液中,并另外加入10 μl荧光底物Ac-DEVD-AFC(用缓冲液稀释至50 μg/ml)。每个样本重复3次。在室温黑暗中孵育1 h后,使用激发光为405 nm 且发射光为 505 nm 的荧光读取器可检测荧光。同时,采用Bradford方法检测每个样品的蛋白浓度,最终吸收强度除以蛋白浓度得到caspase3活性定量值,用相对荧光单位RFU来表达。1.5 流式细胞
流式细胞用来检测不同条件下U251细胞的细胞周期分布及Ki67的表达。胰酶消化后,收集1×10U251细胞并移至15 ml离心管中,用PBS洗3遍后再重悬到500 μl冰PBS中,重悬液缓慢滴到500 μl冰2% PFA中,在冰上孵育5 min。随后细胞重悬至500 μl破膜液0.25% Triton X-100并孵育5 min,最后重悬至100 μl PBS并移至1.5 ml Eppendorf管中。随后,5 μl Ki67抗体(Alexa Fluor® 647)加入重悬液中,混匀并于室温黑暗中孵育1 h。之后清洗并将细胞重悬至500 μl PBS中,加入2 μg/ml PI及50 μg/ml RNA酶,在室温黑暗中孵育30 min。样品准备完毕后在上机实验,数据使用Flowjo version 10分析。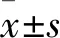
2 结果
2.1 细胞培养方式影响U215的生长曲线
在EH、EL、PH和PL组中,利用细胞计数法绘制生长曲线。结果显示无论EL或PL状态下,U251细胞均快速增殖;在PH状态下,细胞仍继续快速生长;而在EH情况下,细胞增长缓慢(图1A)。在EH中这种细胞缓慢增殖的情况,不随细胞培养基的更新而改变(图1B);并且,在EH组中伴有明显的细胞脱壁;统计显示,脱壁的细胞数占到总细胞数的2%~7%,而其余3组未有明显的脱壁细胞(图1C)。
图1 不同培养条件下U251细胞的增殖
2.2 EH培养方式导致U251细胞凋亡
利用Western blot的方法检测EH组细胞中凋亡蛋白的表达情况。结果显示EH组的细胞在48 h时cleaved-caspase3和cleaved-caspase8的表达明显升高(图2A)。caspase3活性实验进一步验证了上述实验结果(图2B),即在48 h时,与PH组相比,EH组的caspase3活性明显增高(t
=6.724,P
=0.002 5)。因此这些结果提示母代处于指数期的U251细胞在重新种植于高密度后发生了凋亡。
图2 不同培养条件下在U251细胞中的caspase-3活性检测
2.3 EH组中凋亡的细胞发生G2阻滞及细胞周期蛋白下调
为进一步探究不同的培养条件对U251细胞生长影响的相关机制,对不同组的细胞进行流式细胞检测,同时对Ki67进行染色,以检测不同周期中细胞的增殖情况。结果显示在处理后的第1天,4组细胞的细胞周期分布无明显差异:50%~60%的细胞在G1期,15%~20%的细胞在S期,20%~30%的细胞在G2期,并且所有细胞中均表达Ki67。然而,在处理后的第3天时,PH组中,70%的细胞处于G1期,15%处于S期,伴有部分Ki67表达。在EH组G1期的细胞降至约40%,而G2期约35%并伴有Ki67表达,提示G2期阻滞。尽管各组都有sub-G1期的细胞并呈现部分Ki67表达,但这部分细胞在EH组的占比高于其他组。另外,当细胞重新种植于低密度时,PL组和EL组细胞在第3天只有轻度G1期增高,并且所有细胞都为Ki67高表达(图3A)。Western blot结果(图3B)显示EH组细胞在24 h后出现明显的p-ERK1/2表达下调(t
=38.04,P
<0.000 1);EH组细胞的cyclinD1表达较PH组低,并且在24 h及48 h可见明显的下降(t
=6.219,P
=0.000 8;t
=4.344,P
=0.004 9),这与生长曲线中第2天生长缓慢的结果一致。磷酸化PLK1是细胞进入有丝分裂期重要的蛋白,EH组细胞在48 h可见明显p-PLK1明显降低(t
=5.368,P
=0.001 7),这也验证了细胞聚集在G2期。另外,与PH组相比,24 h EH组中p27的表达明显上调(t
=4.483,P
=0.001 5),而以上蛋白的表达在PL与EL组之间无明显差异(图3C)。2.4 FAK信号通路对EH组细胞凋亡的影响
利用Western blot检测不同的培养条件下FAK的表达情况。结果显示(图4A及4B)在EH组中,在6 h时,FAK-Y397磷酸化较PH组明显下调(t
=3.981,P
=0.007 3),而Y925的磷酸化只在24 h明显减少(t
=3.523,P
=0.012 5),而FAK-Y397和Y925的磷酸化表达情况在PL与EL组无明显区别。因此,本课题组猜测FAK的表达降低可能与细胞脱壁有关,并进一步验证增加FAK的表达是否可以阻止细胞凋亡。把U251细胞分别种植在包被0.83 mg/ml的胶原蛋白I或者10 ng/ml的纤维连接蛋白fibronectin的培养皿中,并在培养基中加入100 ng/ml IGF-1和10 ng/ml TGF-β。Western blot结果显示上述处理方式并没有增加p-ERK1/2的表达,且EH组仍发生细胞凋亡(图4C)。这个结果说明FAK信号通路的下调并不是p-ERK1/2减少的原因,而且这种条件下引起的失巢凋亡并不依赖于FAK。2.5 细胞周期蛋白依赖性激酶抑制剂p27对EH组细胞凋亡的影响
在PH与EH组细胞中,除了ERK以外,细胞周期蛋白依赖性激酶抑制剂p27的表达也有差异,提示细胞周期调控可能参与凋亡过程。将指数期的母代细胞饥饿24 h后,利用Western blot检测显示p27的表达增高(图5A)。为验证p27对细胞凋亡的影响,将指数期的母代细胞在0.5%小牛血清的培养基中培养12 h,以升高基线p27的表达,然后再重新种植于高密度,并定义为0 h,继续在该培养基中继续培养12 h。之后,将培养基更换为含10%小牛血清的完全培养基,并收集相应时间点的细胞蛋白。Western blot显示ERK1/2持续激活并且无明显cleaved-caspase3及cleaved-caspase8的表达,提示无凋亡发生(图5B)。另外,生长曲线显示细胞快速生长,并无明显细胞脱壁(图5C)。这些结果证实上调p27的表达可以阻滞EH细胞发生凋亡,提示功能性表达p27在维持U251细胞增殖及抗凋亡的重要作用。
图3 不同培养条件U251细胞的细胞周期的影响

图4 增加FAK的表达对细胞凋亡的影响

图5 上调p27的表达对细胞凋亡的影响
3 讨论
母代细胞的生长状态及细胞密度对U251细胞中MAPK/ER1/2信号通路的激活有显著影响。本研究显示,当平台期或指数期细胞种植于低密度时(PL和EL),U251细胞快速增殖,与母代细胞状态无明显关系,2组细胞生长无差异;将平台期U251细胞种植于高密度时(PH),增殖明显,这与升高的p-ERK1/2结果一致;将指数生长的U251细胞种植于高密度时(EH),增殖缓慢,这与ERK1/2磷酸化受抑制相关。EH组细胞同时伴随明显的细胞脱落,通过检测凋亡相关蛋白caspase的激活提示细胞发生凋亡。
脑胶质瘤细胞与细胞外基质的相互作用以及黏附分子表达的改变,使侵袭性脑胶质瘤细胞不易发生凋亡。本研究显示在EH培养条件下,U251细胞脱壁并发生凋亡,而Western blot显示磷酸化FAK的表达下降。细胞脱壁的凋亡也称失巢,通常可被激活的粘合素信号通路所抑制。已有研究证实FAK和TGF-β能够通过激活粘合素与细胞外基质的相关作用来介导这种细胞外基质依赖的凋亡。此外,Wang et al推测细胞密度对MAPK信号通路的影响可能依赖于FAK信号通路。在本研究中,尽管磷酸化的FAK在EH组细胞中表达下降,通过添加生长因子或细胞外基质等增加FAK的表达未能抑制EH细胞凋亡,也没有升高EH细胞p-ERK的表达。这些结果提示FAK的表达下降并不是引起EH细胞凋亡的原因,而是伴随细胞脱壁产生的结果。
PH与EH组细胞中p27的表达也有差异,提示细胞周期调控蛋白可能参与凋亡过程。p27是细胞周期蛋白依赖性激酶抑制剂,调控细胞进入G1期,维持细胞周期正常的运转。p27缺失见于多种肿瘤包括脑胶质瘤,导致肿瘤细胞不受调控的增殖。在人成纤维细胞中,p27缺失导致细胞发生凋亡,而功能性表达p27可阻止细胞凋亡。因此,在本研究中引起EH细胞凋亡的原因可能与指数生长的U251细胞低表达p27导致细胞周期进程失控有关。在饥饿处理增加p27表达后,细胞凋亡现象消失,进一步说明了功能性表达p27对维持细胞存活的重要性。Masuda et al也发现p27的保护功能,增加p27表达可阻止小细胞肺癌细胞凋亡,并维持细胞在不利的培养环境中存活。在 T98G 脑胶质瘤细胞中,当生长因子缺乏的情况下,S期激酶相关蛋白2的激活受到抑制,而协同下调p27表达可以诱发细胞凋亡。所以功能性表达p27在维持脑胶质瘤细胞的增殖及抗凋亡中有重要影响。
本研究的结果对脑胶质瘤的基础及临床研究具有潜在的意义。首先,体外培养过程中如何避免不必要的外界刺激并合理培养细胞是值得关注的问题。其次,脑胶质瘤细胞的生长是在一定的调控下进行,如在U251细胞中,细胞周期蛋白依赖性激酶抑制剂仍具有一定监控功能,从而保证细胞周期进程,并且联合激活的ERK信号维持脑胶质瘤的增殖及生存。最后,在一定程度上解释脑胶质瘤治疗后早期复发的原因。来自于平台期的细胞重新种植在高密度或低密度时都呈现快速增长的趋势,从转化医学的角度,脑胶质瘤减瘤后残留的肿瘤细胞可看作来自于平台期的细胞解除了接触抑制,促进MAPK/ERK信号通路的激活,进而引起细胞快速增殖、存活,导致对放化疗抵抗及肿瘤复发。然而,本研究结果仍需其他脑胶质瘤细胞株特别是病人来源的原代脑胶质瘤细胞中加以验证,从而为继续研究脑胶质瘤的生长调控以及治疗抵抗提供一定的理论基础。
