PET/CT用于肾细胞癌进展
2021-05-31赵妍妍
赵妍妍,刘 萌
(北京大学第一医院核医学科,北京 100034)
肾癌发病率约占所有恶性肿瘤的4%~5%,且呈上升趋势;其中肾细胞癌(renal cell carcinoma, RCC)约占90%[1]。肾透明细胞癌(clear cell renal cell carcinoma, ccRCC)是RCC的最主要病理类型,约占75%;肾乳头状细胞癌(papillary renal cell carcinoma, pRCC)居第二位,约占15%[2]。PET/CT已广泛用于临床鉴别良恶性肿瘤、肿瘤分级分期、监测疗效及判断预后等[3]。PET显像有助于评估病灶的分子生物学特性,CT则能清晰显示病灶及周围结构。本文对PET/CT在RCC中的应用进展进行综述。
1 18F-FDG PET/CT应用于RCC
18F-FDG是临床中最常用的PET显像剂。作为葡萄糖类似物,18F-FDG通过细胞膜上的葡萄糖转运蛋白进入细胞,因无法参与进一步生化反应而滞留在细胞中,显像设备可显示其在体内或病灶中的分布情况。18F-FDG PET/CT最常用的半定量指标是最大标准摄取值(maximum standard uptake value, SUVmax),其他包括代谢肿瘤体积(metabolic tumor volume, MTV)和病灶糖酵解总量(total lesion glycolysis, TLG)等。
1.1 诊断原发性RCC 部分RCC肿瘤细胞自身葡萄糖代谢程度较低,且18F-FDG经肾脏代谢,在一定程度上影响了肾脏病变组织与正常组织的对比度,导致18F-FDG PET/CT对原发性RCC的诊断价值不高。18F-FDG PET/CT对低代谢、等密度病灶敏感度有限,必要时需通过增强CT明确病灶位置。WANG等[4]的荟萃分析显示,18F-FDG PET/CT检测和定性诊断原发肾脏病变的敏感度仅62%。现有国际及国内指南均不推荐采用18F-FDG PET/CT诊断原发性RCC[5]。另一方面,原发性RCC患者肾静脉或下腔静脉栓子发生率较高,易致静脉血栓栓塞或形成瘤栓,SUVmax有助于鉴别良恶性栓子[6],为选择手术及术后管理方式提供依据。
1.2 RCC病理分级 RCC病理分级(Fuhrman分级)与预后密切相关。NODA等[7]观察18F-FDG PET/CT显像参数包括肿瘤标准摄取值(standard uptake value, SUV)、SUVmax与肿瘤肝脏标准摄取值比(tumour-to-liver standard uptake value ratio, TLR)等与Fuhrman分级的相关性,发现TLR是预测RCC病理分级(Fuhrman分级)的有效指标。
2012年国际泌尿病理学会(International Society of Urological Pathology, ISUP)共识会议指出,相比Fuhrman分级,ISUP分级与预后的相关性更强。2016年WHO将这一新的病理分级纳入泌尿和男性生殖系统肿瘤分级标准[8],简称WHO/ISUP分级。相关研究[9]证实,增强CT及MRI参数与WHO/ISUP分级存在相关性。本课题组最新研究[10]表明,根据18F-FDG PET/CT显像发现TLR升高(>1.63)和存在瘤栓可有效预测高WHO/ISUP分级ccRCC。
1.3 判断RCC转移及复发 原发性RCC最常见转移部位包括肺(45%)、骨(30%)、局部淋巴结(22%)、肝脏(20%)、肾上腺(9%)及大脑(8%)[11]。18F-FDG PET/CT是判断RCC转移及复发的有效影像学方法之一,尤其适用于增强CT诊断不明确的病例。
ALONGI等[12]报道,18F-FDG PET/CT诊断复发性和/或转移性病变的敏感度和特异度分别为74%和80%。MA等[13]对1 168例RCC进行荟萃分析,发现18F-FDG PET/CT诊断RCC的敏感度为86%,特异度为88%。ELAHMADAWY等[14]发现18F-FDG PET/CT和增强CT诊断RCC局部复发的特异度分别为100%和98.6%,诊断全身远处转移分别为99.1%和93.96%;PET/CT诊断局部复发的敏感度为96%,略低于增强CT(100%);PET/CT诊断淋巴及骨转移的敏感度均达到100%,诊断肺转移灶的敏感度仅为80.6%,低于增强CT(100%)。
1.4 预测或监测靶向及免疫治疗 通过有效的无创影像学方法预测或监测RCC靶向治疗可指导临床选择或调整药物。RCC常用靶向药物为酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKIS),通过靶向结合促血管生成受体以抑制肿瘤血管生成,但仅能轻微缩小病灶[15],提示仅根据病灶大小变化评估疗效并不完全准确;可通过18F-FDG PET/CT显像定性评价TKIS疗效,或利用代谢参数SUVmax、TLG及MTV等定量评价TKIS疗效[16]。
抗程序性死亡受体1(programmed death-1, PD-1)单克隆抗体(monoclonal antibody, mAb)及抗程序性死亡配体1(programmed death ligand-1, PD-L1)mAb是目前常用的免疫检查点抑制剂。相关指南[17]已将抗PD-1 mAb(Nivolumab)列为进展期RCC的二线疗法。TABEI等[18]观察9例接受Nivolumab治疗的转移性RCC(metastatic RCC, mRCC)患者(共30个病灶),分别于基线水平和治疗1个月行18F-FDG PET/CT检查、治疗4个月时行CT检查,回归分析显示仅治疗1个月后SUVmax升高为预测RCC对Nivolumab治疗反应的独立因素,提示18F-FDG PET/CT可通过测定病灶SUVmax变化而早期、有效评估免疫治疗疗效。
1.5 预后评估及定期随访 KASSEM等[19]对30例RCC根治术后患者进行随访,结果显示18F-FDG PET/CT和增强CT的诊断敏感度、特异度及准确率分别为94.4%和61.1%,100%和91.7%及96.7%和73.3%。PANKOWSKA等[20]观察进展期RCC18F-FDG PET/CT 的SUVmax与其总生存期(overall survival, OS)的关系,多因素回归分析显示SUVmax是预测RCC患者OS的独立预后因素,SUVmax<7.0时平均OS为32个月;7.0≤SUVmax<12.0时平均OS为12.5个月;SUVmax≥12.0时平均OS为10个月。总体而言,18F-FDG高摄取提示病灶侵袭性强,预后较轻度摄取者更差。
NAKAJIMA等[21]回顾性分析139例RCC患者,结果表明MTV、TLG是影响预后的重要因素。另有研究[16]报道,MTV、TLG是预测mRCC患者无进展生存期和OS的独立预后因素,并可为临床高危mRCC患者应用抗血管内皮生长因子靶向治疗提供额外的预后信息。
2 新型显像剂用于RCC
目前针对肾脏恶性病变的新型显像剂正在不断研发中,如碳酸酐酶Ⅸ(carbonic anhydrase Ⅸ, CAⅨ)及前列腺特异性膜抗原(prostate-specific membrane antigen, PSMA)等,见表1。
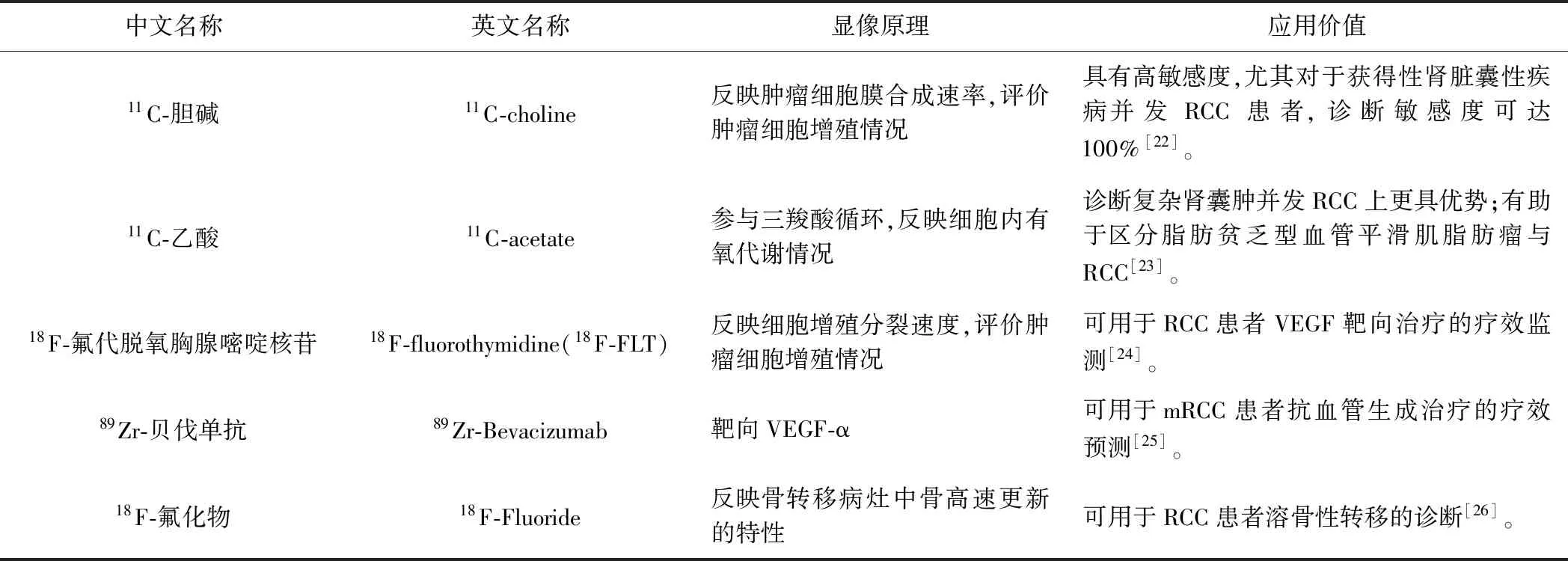
表1 诊断RCC的新型PET显像剂中文名称
2.1 CAⅨ CAⅨ是ccRCC细胞表面广泛表达的糖蛋白,在正常肾组织、良性肿瘤和非ccRCC肾脏恶性肿瘤中不表达。靶向CAⅨ分子显像有望用于特异性诊断RCC。
吉妥昔单抗(Girentuximab)是一种靶向结合CAIX的嵌合式单克隆抗体,可利用放射性核素(如89Zr、124I等)标记进行显像。124I-cG250(124I标记Girentuximab的PET显像剂)可显著提高诊断ccRCC的敏感度和特异度[27];但其半衰期较长(4.2天),注射后需要较长时间才能获得较好的显像结果。一项多中心、前瞻性队列研究[28]采用89Zr-DFO-girentuximab PET/CT、18F-FDG PET/CT和增强CT检查诊断42例ccRCC伴远处转移患者,病灶检出率分别为91%、84%和56%。
18F-VM4-037是应用18F标记靶向CAⅨ的小分子。18F半衰期适宜(6.02 h),临床应用性更强。TURKBEY等[29]应用18F-VM4-037对11例ccRCC患者进行Ⅱ期临床试验,相比原发病灶,显像剂在CAⅨ高表达的转移灶中浓聚程度更高;由于在正常肾实质中亦有较高分布,18F-VM4-037更适用于评估其他部位ccRCC转移灶。
2.2 PSMA PSMA是高表达于肿瘤新生血管上皮的跨膜蛋白,目前主要用于诊断前列腺癌,其对RCC同样是一个具有潜在价值的分子靶点。以PSMA为靶向的显像剂有18F-DCFPyl及68Ga-PSMA等。ROWE等[30]采用18F-DCFPyl PET/CT观察5例转移性ccRCC,PET/CT共显示28个转移灶,敏感度为94.7%,而增强CT及MRI仅显示18个病灶,敏感度为78.9%。但YIN等[31]认为非ccRCC病灶摄取18F-DCFPyl程度低且不一致,故18F-DCFPyl并不适用于该群体。
一项回顾性研究[32]观察68Ga-PSMA PET/CT显像用于原发性与可疑复发RCC患者临床分期与再分期的价值,68Ga-PSMA PET/CT对原发性RCC检出率为75%,且其中大多数为ccRCC,CT与PET/CT的结果一致性为37.5%;22例可疑复发RCC患者中,68Ga-PSMA PET/CT显像改变了9例(40.9%)患者的治疗方案,8例(36.4%)CT与68Ga-PSMA PET/CT结果一致。
3 小结及展望
18F-FDG PET/CT诊断原发RCC并不具有优势,其优越性主要体现在诊断RCC复发与远处转移、鉴别良恶性静脉栓子、监测靶向治疗疗效以及预后评估等方面。目前研发出的多种新型PET显像剂,尤其是多模态显像剂,可有效弥补18F-FDG的不足,有助于特异性诊断RCC。
未来PET/CT用于RCC研究可能体现在以下方面:①引进人工智能技术(如深度学习等),有效挖掘影像数据,建立新型影像组学分析方法,并通过推动影像组学与其他组学(如基因组学、蛋白质组学及代谢组学等)交叉融合实现更精准影像学指导下的RCC患者个体化临床处置;②开展高质量、前瞻性临床研究,促进新型RCC显像剂或影像组学分析新方法的临床转化,进一步提升PET/CT对于RCC诊疗与预后管理的价值。
