体素内不相干运动弥散加权成像与弥散加权成像鉴别诊断甲状腺良恶性结节:Meta分析
2021-05-31邝咏瑶叶坤林江梓杰梁建业史长征罗良平
邝咏瑶,叶坤林,江梓杰,梁建业,史长征,罗良平
(暨南大学附属第一医院影像中心,广东 广州 510632)
甲状腺结节临床常见,发病率逐年攀升。弥散加权成像(diffusion-weighted imaging, DWI)为常用的监测水分子运动的MR检查方法,对鉴别良恶性肿瘤具有较高价值,但DWI采用单指数模型,并未考虑微血管灌注的影响。体素内不相干运动(intravoxel incoherent motion, IVIM)-DWI应用多组b值进行拟合计算,可将单纯水分子扩散与微灌注信息分离[1]。本研究采用Meta分析方法系统评价IVIM-DWI与DWI诊断甲状腺良恶性结节的效能。
1 资料与方法
1.1 文献检索 检索Cochrane Library、PubMed、Embase、中国知网、万方医学网及中国生物医学文献数据库,英文检索词为“IVIM”“intravoxel incoherent motion”“diffusion-weighted imaging”“DWI”“thyroid nodule”“thyroid cancer”“thyroid carcinoma”,中文检索词为“体素内不相干运动”“弥散加权成像”“甲状腺结节”“甲状腺肿瘤”“甲状腺癌”,并手动检索相关参考文献;检索时间为建库至2020年5月,限定语种为中文及英文。
1.2 纳入及排除标准 纳入标准:①术前接受DWI或IVIM-DWI;②病理结果明确;③四格表数据完整;④样本量不少于20例,其中恶性比例不小于20%。排除标准:①无法提取有效数据或数据重复使用;②评论、综述等非论著文献;③4项以上诊断性质量评价工具2(quality assessment of diagnostic accuracy studies 2, QUADAS-2)评分为“不确定”或“否”;④DWI所用b值<500 s/mm2。
1.3 数据提取 由2名研究员独立筛选文献、提取资料并交叉核对,有分歧时经讨论达成一致;提取信息包括第一作者、发表年份、发表国家、研究类型、MR设备等基本特征以及真实扩散系数(D)、表观扩散系数(apparent diffusion coefficient, ADC)对应的四格表数据。以QUADAS-2评分评估文献质量,“是”“否”或“不清楚”评价偏倚风险及临床适用性各条目。
1.4 统计学分析 采用Stata 12.0及Meta-disc 1.4软件,以Spearman相关分析评价ADC值及D值定性诊断甲状腺良恶性结节的阈值效应,P<0.05提示其阈值存在统计学意义;以Q检验及I2值分析文献异质性,I2>50%且Q检验P<0.05表示存在异质性。对ADC值及D值的四格表数据进行汇总,计算合并敏感度、特异度、阳性似然比(positive likelihood ratio, PLR)及阴性似然比(negative likelihood ratio, NLR),并绘制ADC值及D值鉴别甲状腺良恶性结节的综合受试者工作特征(summary receiver operating characteristic, SROC)曲线,采用Z检验比较D值与ADC值的AUC差异。建立Fagan诺谟图,评估ADC值及D值的验后概率。以Deek检验评估发表偏倚。
2 结果
2.1 文献检索及质量评价 初步检出363篇文献。经纳入及排除条件筛选(图1),最终获得17篇文献[2-18],包括12篇英文文献[7-18]和5篇中文文献[2-6];其中前瞻性研究8篇[5,7,9-11,14-15,17],回顾性研究9篇[2-4,6,8,12-13,16,18],见表1;共1 110例患者、1 421个甲状腺结节,其中787个良性、634个恶性。
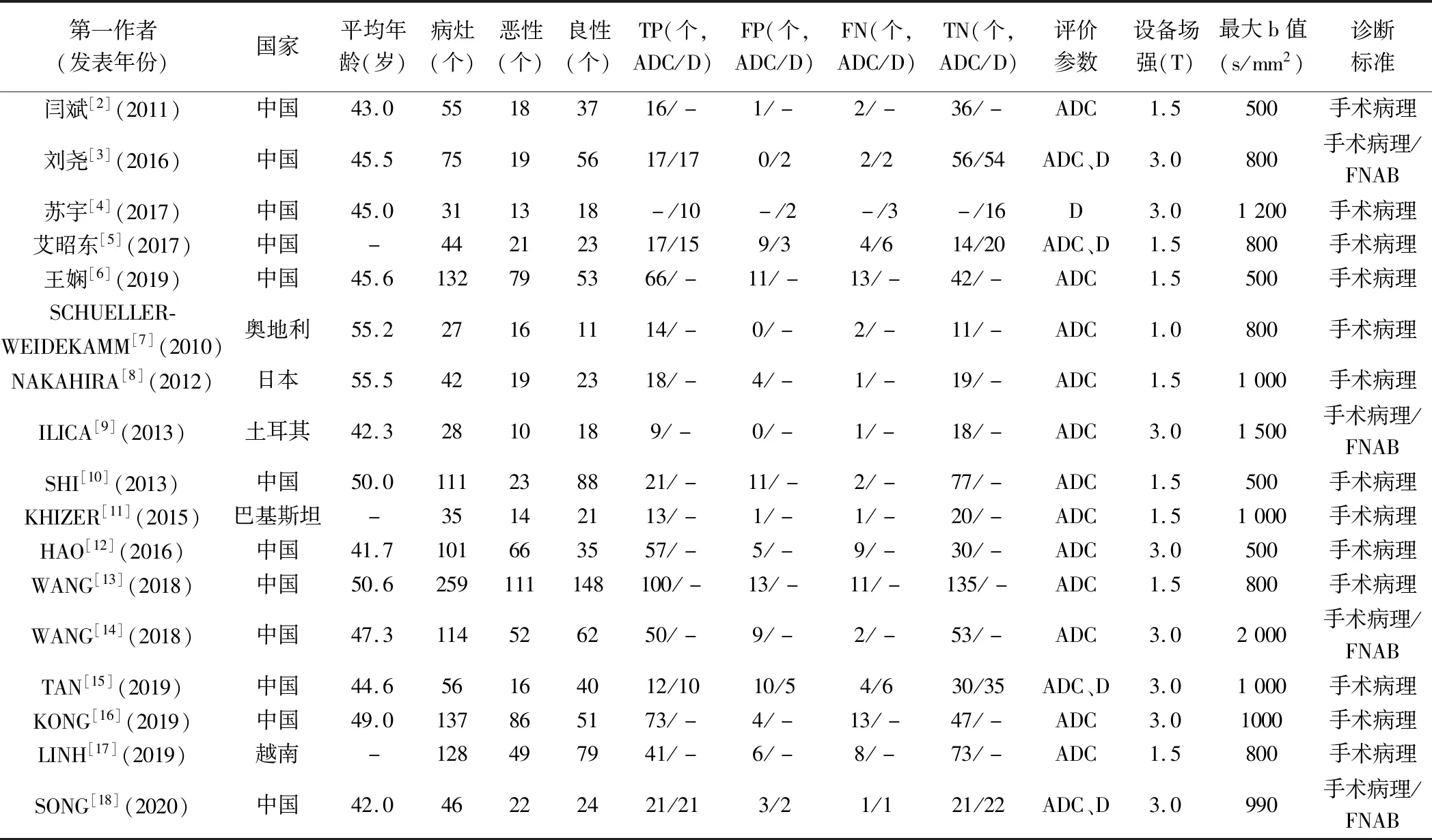
表1 纳入17篇文献的基本特征
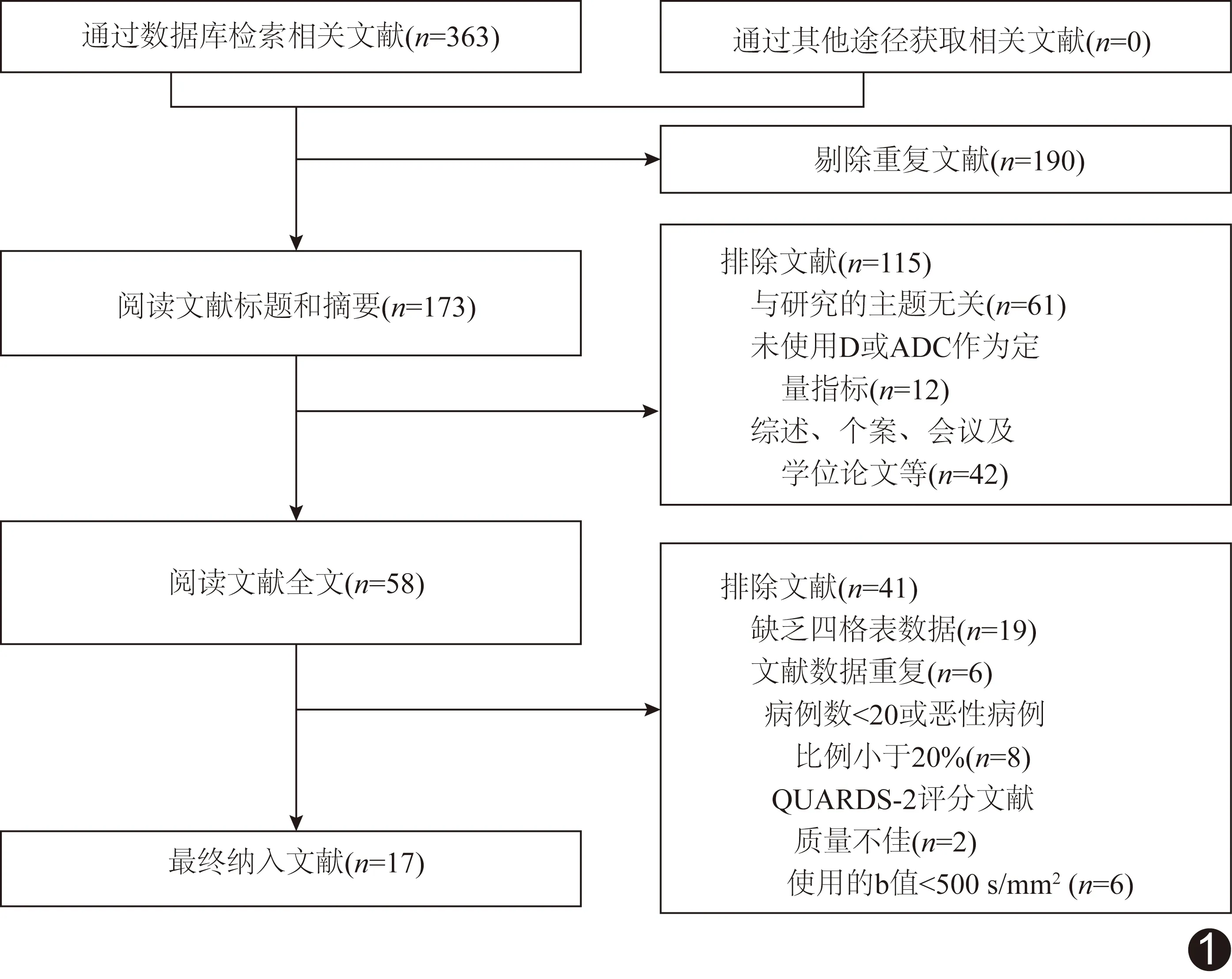
图1 文献筛选流程图
17篇文献中,12篇[2,6-14,16-17]单独采用ADC进行分析,4篇[3,5,15,18]同时采用D值及ADC值,1篇[4]仅采用D值。文献[18]采用2种方法勾画病灶ROI以计算D值,分别以整个结节或其实性部分作为ROI进行分析,故D值诊断Meta分析共纳入该组6个数据集。QUADAS-2评分结果显示,多数文献具有中低偏倚风险及较好的临床适用性(图2)。
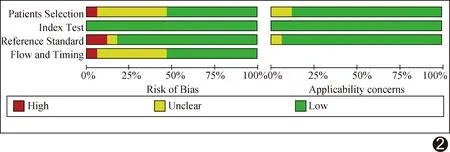
图2 QUADAS-2偏倚风险评价汇总图
2.2 Meta分析结果 采用双变量混合模型对ADC及D值鉴别甲状腺良恶性结节的效能进行Meta分析。ADC值的合并敏感度、合并特异度、PLR及NLR分别为0.88(0.85,0.91)、0.90(0.85,0.94)、8.86(5.66,13.88)及0.13(0.10,0.16),D值分别为0.85(0.71,0.92)、0.90(0.85,0.94)、8.77(5.29,14.55)及0.17(0.09,0.34)。SROC曲线(图3)显示,ADC值的AUC[0.92(0.89,0.94)]与D值[0.93(0.90,0.95)]差异无统计学意义(Z=-0.299,P=0.385)。诺谟图(图4)显示,根据临床表现或超声结果预测甲状腺结节恶性概率为50%时,如ADC或D值诊断为阳性,其验后恶性概率均增加至90%;如ADC或D值诊断为阴性,则恶性概率分别降低至11%及15%。

图3 ADC值(A)及D值(B)诊断甲状腺肿瘤良恶性的SROC
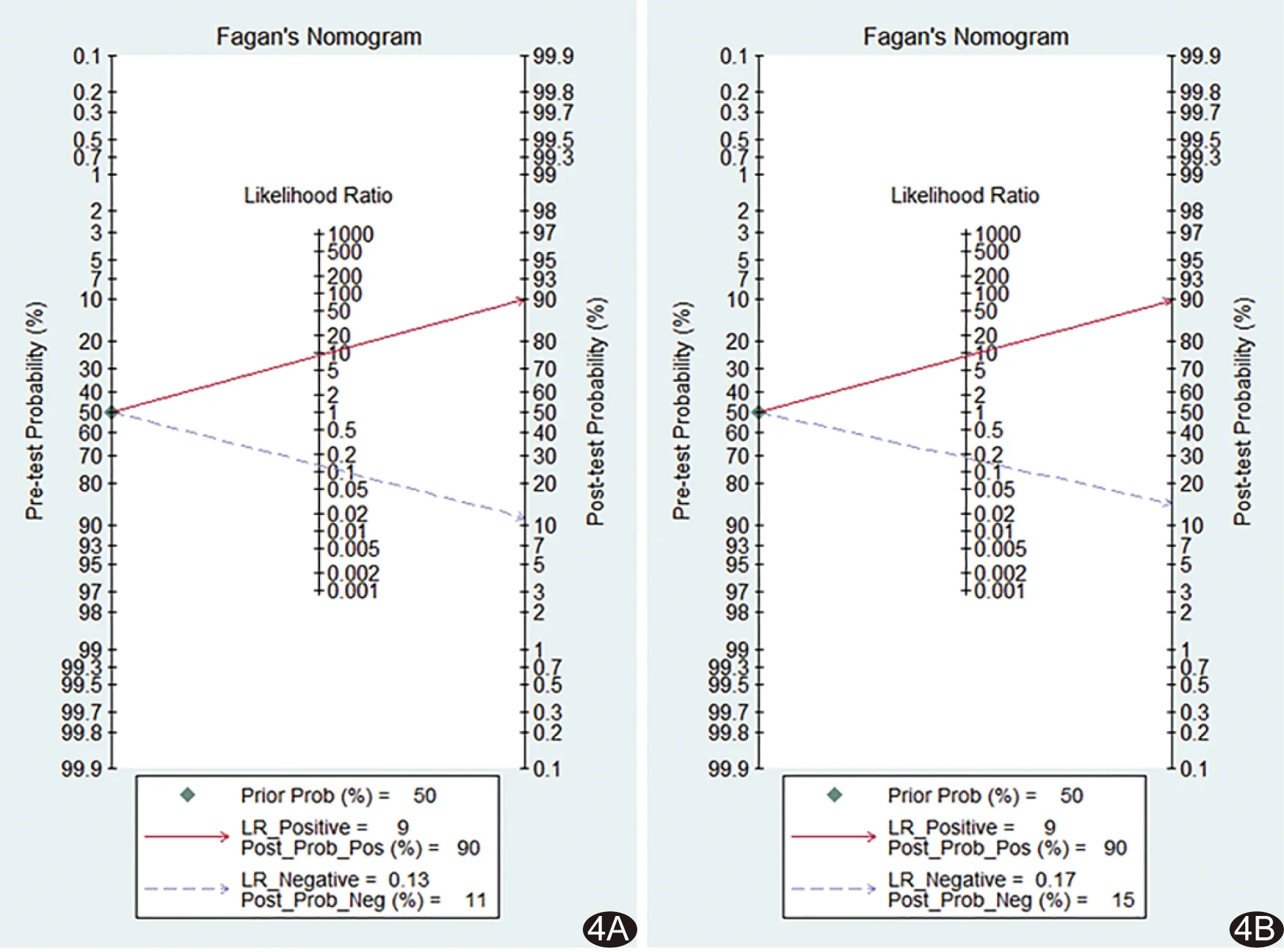
图4 ADC值(A)及D值(B)的诺谟图
异质性检验结果显示,ADC值的合并敏感度I2=55.0%、P=0.45,合并特异度I2=70.5%、P<0.001;而D值的合并敏感度I2=61.2%、P=0.02,合并特异度I2=0、P=0.47,提示文献中ADC值的合并特异度及D值的合并敏感度均存在异质性。ADC值及D值诊断甲状腺良恶性结节无明显阈值效应(r=-0.113、-0.145,P=0.676、0.784)。见表2。针对研究类型、设备场强、b值、ROI等因素进行分析,均未检出明确的异质性来源。
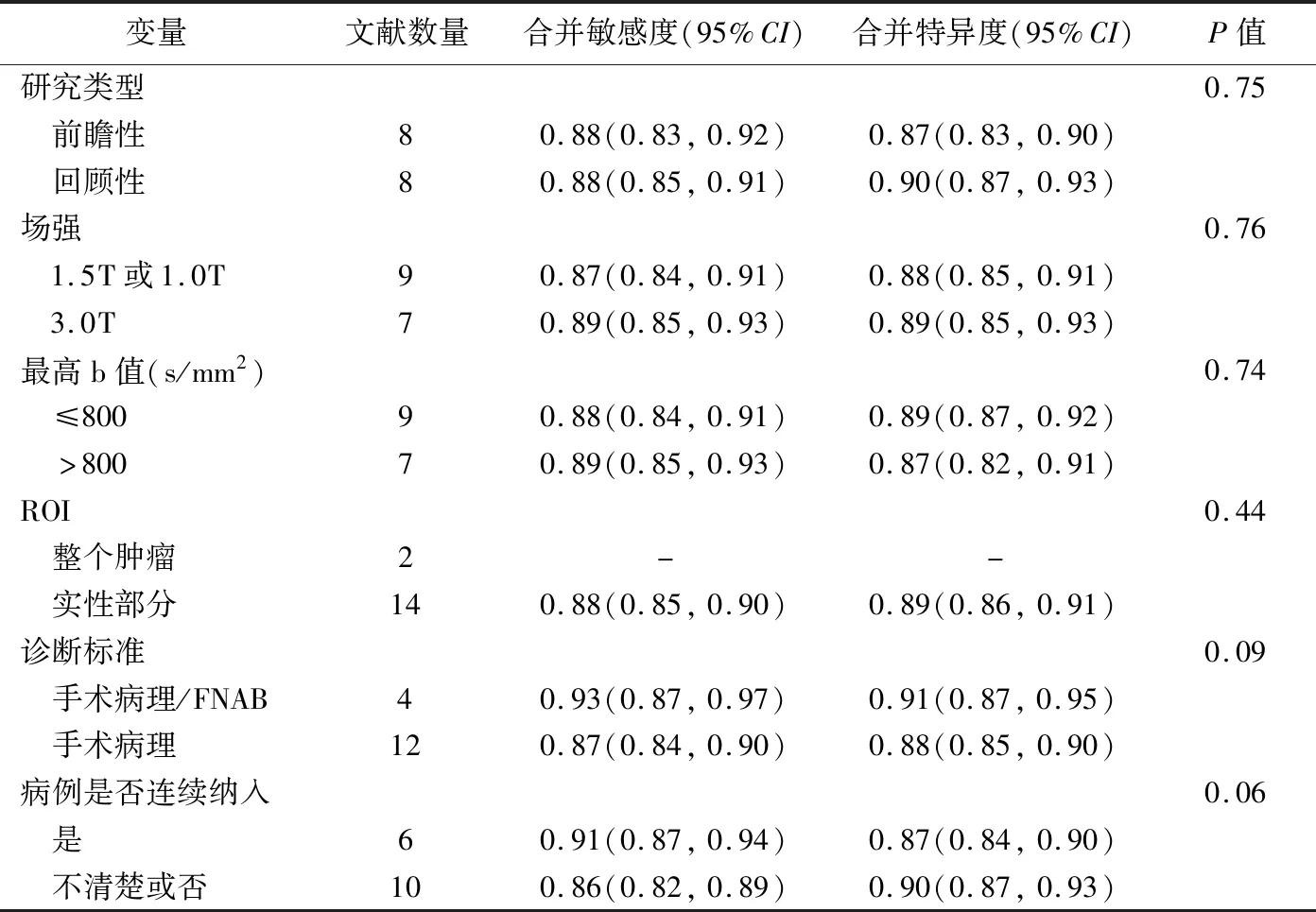
表2 ADC值的回归及亚组分析
Deek漏斗图(图5)显示,ADC的回归线近似垂直于诊断比值比轴线,ADC及D值相应Deek线性回归结果分别为t=0.45(P=0.66)和t=-1.13(P=0.32),提示无明显发表偏倚。
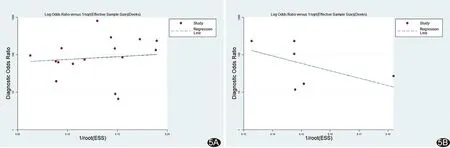
图5 ADC值(A)及D值(B)的Deek漏斗图
3 讨论
目前DWI已广泛用于临床,ADC值可提供分子水平的信息。IVIM-DWI可实现单独估测水分子弥散及毛细血管灌注状态,其中D代表缓慢扩散成分,反映真实的扩散水平;D*代表快速扩散运动组分,与平均血流速度及微血管长度有关;f为灌注分数,反映毛细血管血容量[19]。相比良性病变,甲状腺恶性结节细胞更密集、细胞外间隙更小,水分子布朗运动受限,使D及ADC值作为反映水分子弥散水平的参数在鉴别甲状腺良恶性结节中发挥重要作用。
既往有学者[20]采用Meta分析观察DWI鉴别甲状腺良恶性结节的价值。本研究以严格标准筛选文献,评价IVIM-DWI及不同指数模型的诊断效能,发现D值及ADC值对诊断甲状腺良恶性结节均有较高的敏感度及特异度;且诺谟图提示DWI及IVIM-DWI可有效提高诊断恶性甲状腺结节的准确率。理论上,IVIM-DWI中的D值较DWI的ADC值更接近组织的真实扩散程度。本研究发现IVIM-DWI的D值与ADC值的AUC差异无统计学意义,提示D值相比ADC值对于鉴别甲状腺良恶性结节并无明显优势;但D*及f可提供与微灌注相关信息,反映肿瘤血管生成状况,有助于鉴别诊断[4,15]。此外,甲状腺位置表浅,常规DWI易受磁敏感伪影影响导致信号丢失及图像变形[21],为获得更真实的扩散信息,往往需采用较高b值,使图像信噪比降低;而IVIM-DWI针对不同分布b值进行拟合,稳定性及可重复性更高[18]。
本研究发现ADC值的合并特异度及D值的合并敏感度存在异质性;Spearman相关性检验结果提示阈值效应并非主要异质性来源;亚组分析及Meta回归均未检出ADC值及D值异质性的明确来源,而对ADC值的汇总结果显示纳入连续性病例或随机研究可能具有更高的敏感度和较低的特异度(P=0.06),但可能由于纳入文献数量较少,导致差异无统计学意义。
综上所述,D值及ADC值鉴别甲状腺良恶性结节效能相当,而IVIM-DWI参数可提供更多结节相关信息,且结果稳定性及可重复性更佳。本研究的主要不足:①纳入的IVIM-DWI研究偏少;②未对IVIM-DWI各参数的诊断效能进行比较;③地域来源较单一。
