肺炎克雷伯菌胞外多糖抗生物膜活性研究
2021-05-31刘姝灵马小华潘建华石国民周前选龙江文易一行向延根
刘姝灵, 税 剑, 马小华, 潘建华, 石国民, 喻 容, 周前选, 龙江文, 易一行, 向延根
细菌生物膜(biofilm)是指细菌为适应周围复杂环境,黏附于接触介质表面、生长繁殖并分泌大量胞外基质(蛋白质、胞外多糖、DNA、脂质等),将其自身紧紧包裹形成致密的、三维立体结构的膜状聚合物。自然界中大多数细菌能以生物膜形式生长,相对于浮游态细菌,处于生物膜状态细菌代谢活性低、生长速度慢,容易对抗菌药物产生耐药性,同时生物膜构成渗透屏障阻碍抗菌药物渗透、逃避机体免疫攻击[1-2]。细菌形成生物膜后会导致耐药性升高,大量研究证实生物膜可使细菌耐药性提高10~1000倍[3]。有研究报道临床上超过65%慢性感染与生物膜密切相关[4-5]。如何有效防治细菌生物膜形成所引起的慢性感染成为亟待解决的公共卫生问题。目前,细菌多糖由于其广谱抗生物膜效果、无杀菌作用等优点而受到了广泛关注[6-7]。肺炎克雷伯菌是临床常见的条件致病菌,对环境适应能力强,可以充分利用各种营养成分,产生多种次级代谢产物,其中代谢产生的大量胞外多糖是否具有抗生物膜活性需要进一步探索。本研究以具有强成膜能力的表皮葡萄球菌ATCC 35984为模式菌株,探索肺炎克雷伯菌上清液的抗生物膜活性并鉴定该活性物质的化学性质;采用粗提多糖探讨不同浓度肺炎克雷伯菌胞外多糖对生物膜活性的影响;研究肺炎克雷伯菌多糖的广谱抗生物膜活性,以期寻找到一种新的具备抗生物膜功能的细菌胞外多糖,为临床生物膜相关性感染的有效防治提供一种新的广谱、安全、高效、低耐药性的治疗手段。
1 材料与方法
1.1 材料
1.1.1 菌株来源 收集2019—2020年南华大学附属长沙中心医院住院患者临床分离的肺炎克雷伯菌20株,成膜能力较强的大肠埃希菌、铜绿假单胞菌、鲍曼不动杆菌、表皮葡萄球菌、金黄色葡萄球菌临床分离菌各2株,生物膜模式菌株为表皮葡萄球菌ATCC 35984、铜绿假单胞菌PAO1。菌株鉴定使用VITEK 2-Compact 全自动微生物分析系统。
1.1.2 仪器与试剂 LB肉汤购于上海生工生物工程股份有限公司,TSB肉汤、无水乙醇、无水葡萄糖、结晶紫、蛋白酶K、DNA酶I、RNA酶A购于北京索莱宝公司,96孔板购于NEST/无锡耐思生物科技有限公司,0.22 μm滤菌器购于美国Millipore 公司,高碘酸钠购于国药集团化学试剂有限公司,苯酚购于衡阳市江东化学试剂厂,98%浓硫酸购于株洲市星空化玻有限公司,细菌比浊仪购于法国梅里埃公司,酶标仪购于深圳市汇松科技发展有限公司,恒温摇床购于金坛市荣华仪器制造有限公司,VITEK 2-Compact全自动微生物分析系统购于法国梅里埃公司。
1.2 方法
1.2.1 抗表皮葡萄球菌生物膜的肺炎克雷伯菌菌株筛选
1.2.1.1 肺炎克雷伯菌培养上清液制备 采用参考文献中的方法[8-9],将收集的20株肺炎克雷伯菌临床菌株转种于哥伦比亚血平板,取3~5个菌落用LB肉汤调整菌液浓度为2.0麦氏单位,取20 mL菌液于37℃、200 r/min条件下振荡培养48 h,随后4℃、4 000 r/min离心30 min,0.22 μm滤菌器过滤备用。
1.2.1.2 抗表皮葡萄球菌生物膜活性试验 挑取表皮葡萄球菌ATCC 35984单个菌落于TSB肉汤中37℃、200 r/min振荡培养24 h,调整菌液浓度为0.5麦氏单位。将96孔板分为实验组和对照组,吸取100 μL菌液加入到96孔细胞培养板,随后分别加肺炎克雷伯菌上清液100 μL或同等体积生理盐水于实验组和对照组中。所有组别均设置3个复孔,充分混匀,胶带封板,37℃培养16 h。弃去培养菌液并用生理盐水洗涤3遍,37℃晾干,0.1%结晶紫染色15 min,生理盐水洗涤以去除未结合染液,37℃晾干,95%乙醇溶解20 min后测定其570 nm处的吸光度(D570)值。
1.2.1.3 生物膜抑制率计算 生物膜抑制率=(对照组吸光度均值-实验组吸光度均值)/对照组吸光度均值×100%。
1.2.2 肺炎克雷伯菌上清液中抗生物膜活性物质的化学性质分析 以对表皮葡萄球菌ATCC 35984生物膜抑制率为73.5%肺炎克雷伯菌上清液作为研究对象进行下一步化学性质分析。
1.2.2.1 待测样本制备 ①煮沸法:肺炎克雷伯菌上清液37℃温育1 h,100℃煮沸30 min,4℃保存备用。②酶处理法:将1 g/L蛋白酶K、DNA酶I、RNA酶A分别与肺炎克雷伯菌上清液充分混匀使蛋白酶K、DNA酶I、RNA酶A浓度分别为100、100、80 mg/L,37℃温育1 h,100℃煮沸30 min,4℃保存备用。③高碘酸钠法:将30 mmol/L高碘酸钠100 μL与900 μL上清液充分混匀,避光37℃温育1 h,100℃煮沸 30 min,4℃保存备用。
1.2.2.2 抗生物膜活性物质的化学性质分析 取处理后的肺炎克雷伯菌上清液参照1.2.1.2所述方法进行抗表皮葡萄球菌ATCC 35984生物膜活性试验,探讨高温、酶、高碘酸钠对肺炎克雷伯菌上清液中的活性物质的影响,并分析该活性物质的化学性质。
1.2.3 肺炎克雷伯菌胞外多糖抗生物膜活性浓度依赖性测定
1.2.3.1 制定葡萄糖标准曲线 分别配制 250 mg/L葡萄糖标准溶液和5%苯酚溶液,并按表1顺序依次加入试剂。每组各取200 μL溶液于96孔板中,490 nm处测定其吸光度值,制定葡萄糖标准曲线。
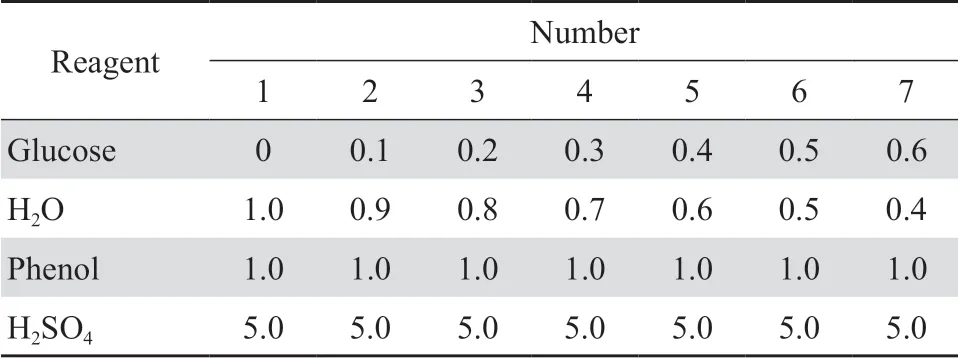
表1 葡萄糖标准曲线试剂Table 1 Reagents for glucose standard curve(mL)
1.2.3.2 肺炎克雷伯菌胞外多糖的提取 将上清液与无水乙醇充分混匀,调整无水乙醇终浓度为75%,4℃静置过夜,4 000 r/min离心30 min弃上清液,晾干后得到粗提多糖沉淀,加入无菌蒸馏水2 mL使多糖沉淀充分溶解,根据葡萄糖标准曲线用硫酸苯酚法测定多糖溶液的浓度。
1.2.3.3 多糖抗生物膜活性的浓度依赖性 用无菌蒸馏水将多糖浓度调整为5%、10%、20%、30%、40%、50%,取不同浓度多糖各100 μL加入至96孔板中,用TSB肉汤调整表皮葡萄球菌菌液浓度为0.5麦氏单位。按照1.2.1.2所述方法进行肺炎克雷伯菌胞外多糖抗生物膜活性的浓度依赖性测定。
1.2.4 多糖对表皮葡萄球菌生长的影响 调整0.5麦氏单位浓度表皮葡萄球菌菌液12 mL,实验组和对照组各取6 mL菌液于无菌试管中,随后分别加肺炎克雷伯菌胞外多糖3 mL和同等体积的生理盐水。充分混匀后置于37℃、200 r/min恒温摇床中振荡培养,间隔2 h分别取200 μL菌液测量实验组和对照组600 nm处的吸光度,观察24 h内多糖对表皮葡萄球菌生长是否有影响。
1.2.5 肺炎克雷伯菌胞外多糖广谱抗生物膜活性 收集具有较强成膜能力的大肠埃希菌、鲍曼不动杆菌、铜绿假单胞菌、表皮葡萄球菌、金黄色葡萄球菌、粪肠球菌等临床菌株,并将菌液浓度调整为0.5麦氏单位,取肺炎克雷伯菌胞外多糖参照1.2.1.2所述方法进行抗生物膜活性实验,鲍曼不动杆菌生物膜培养48 h,其余菌株生物膜培养16 h。
1.2.6 数据处理 用GraphPad Prism8软件进行数据分析。所有实验数据重复三次取平均值,实验组与对照组抗生物膜活性差异比较采用配对t检验,以P<0.05 为差异具有统计学意义。
2 结果
2.1 抗表皮葡萄球菌活性菌株的筛选
筛选了20株对表皮葡萄球菌ATCC 35984生物膜具有抑制作用的肺炎克雷伯菌临床菌株,抑制率在16.1%~73.5%,肺炎克雷伯菌上清液对表皮葡萄球菌ATCC 35984生物膜的抑制作用见图1。
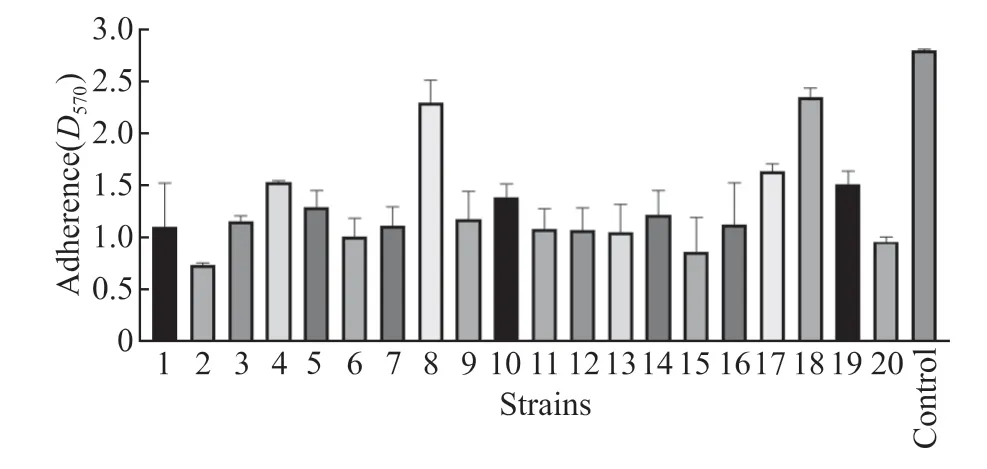
图1 肺炎克雷伯菌上清液对表皮葡萄球菌ATCC 35984生物膜的抑制作用Figure 1 Inhibition of the supernatant of each Klebsiella pneumoniae strain on the biofilm formation of Staphylococcus epidermidis ATCC 35984
2.2 肺炎克雷伯菌上清液中抗生物膜活性物质的化学性质分析
分别用高温、蛋白酶K、DNA酶I、RNA酶A处理肺炎克雷伯菌上清液,并用处理后的肺炎克雷伯菌上清液进行抗表皮葡萄球菌生物膜活性试验,所得吸光度均值分别为0.816 0±0.045 2、0.781 2±0.043 6、0.776 3±0.026 4、0.781 1±0.006 6,与对照组吸光度均值2.806 0±0.027 0比较,差异均有显著统计学意义(P<0.01),研究表明高温、蛋白酶、核酸酶无法使肺炎克雷伯菌上清液中抗表皮葡萄球菌生物膜活性物质失去活性,表明肺炎克雷伯菌上清液中含有的抗生物膜活性物质不属于蛋白质、核酸类物质。为了证实此抗生物膜活性是否由糖类引起,本研究采用30 mmol/L高碘酸钠处理上清液,吸光度均值为2.814 5±0.012 0,与对照组2.806 0±0.027 0比较,差异无统计学意义(P>0.05)。高碘酸钠作为一种氧化剂,可以选择性断裂分子中联二羟基或联三羟基处,生成相应的多糖醛、甲醛和甲酸,由此说明肺炎克雷伯菌上清液中的抗生物膜活性成分是一种多糖。肺炎克雷伯菌上清液中抗生物膜活性物质化学性质分析见图2。

图2 肺炎克雷伯菌上清液中抗生物膜活性物质化学性质分析Figure 2 Characterization of the chemical properties of the active anti-biofilm substances in Klebsiella pneumoniae supernatant
2.3 肺炎克雷伯菌胞外多糖抗生物膜活性的浓度依赖性
采用硫酸苯酚法制定葡萄糖标准曲线y=0.010 1x+ 0.193 3(R2= 0.997 9,P<0.01),将待测多糖的吸光度D490代入葡萄糖标准曲线测得肺炎克雷伯菌粗提多糖含量为200.1 mg/L。肺炎克雷伯菌胞外多糖对表皮葡萄球菌生物膜的抑制作用具有浓度依赖性,5%、10%、20%、30%、40%、50%多糖可使表皮葡萄球菌生物膜量由2.778 1±0.040 0,分别减少至2.730 7±0.031 2(P>0.05)、2.689 7±0.028 5(P>0.05)、2.511 9±0.043 0(P<0.05)、1.131 0±0.053 5(P<0.01)、0.609 7±0.045 3(P<0.01)、0.609 3±0.026 2(P<0.01)。不同浓度肺炎克雷伯菌胞外多糖对表皮葡萄球菌生物膜抑制活性见图3。
2.4 肺炎克雷伯菌胞外多糖对表皮葡萄球菌ATCC 35984生长的影响
在开始4 h内,多糖组与对照组细菌均处于延滞期,随着培养时间延长,两组细菌开始生长,到达16 h后两组细菌进入稳定期。研究发现肺炎克雷伯菌胞外粗提多糖对表皮葡萄球菌ATCC 35984的生长不具有抑制作用。两组细菌的生长曲线见图4。
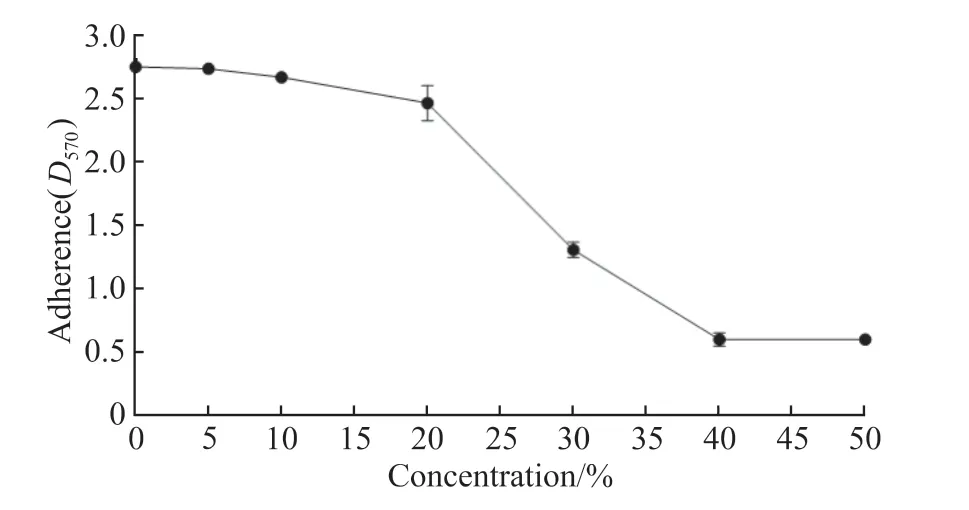
图3 不同浓度多糖对表皮葡萄球菌生物膜影响Figure 3 Effects of different concentrations of polysaccharides on Staphylococcus epidermidis biofilm formation
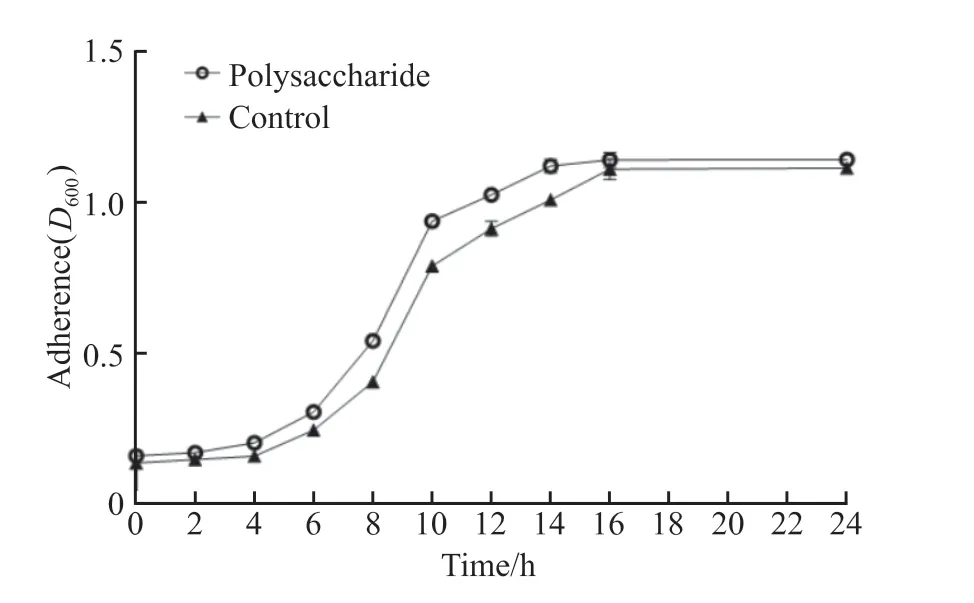
图4 肺炎克雷伯菌上清液对表皮葡萄球菌生长的影响Figure 4 The effect of Klebsiella pneumoniae supernatant on the growth of Staphylococcus epidermidis
2.5 肺炎克雷伯菌胞外多糖广谱抗生物膜活性
肺炎克雷伯菌胞外多糖对铜绿假单胞菌PAO1、铜绿假单胞菌15、铜绿假单胞菌16、大肠埃希菌06、大肠埃希菌39、鲍曼不动杆菌02、鲍曼不动杆菌10、粪肠球菌05、粪肠球菌18、表皮葡萄球菌06、表皮葡萄球菌13、表皮葡萄球菌ATCC 35984、金黄色葡萄球菌11、金黄色葡萄球菌23生物膜抑制率分别为40.3%、15.1%、13.0%、28.2%、33.3%、62.5%、64.7%、77.1%、88.9%、69.4%、72.9%、75.5%、85.9%、87.4%。肺炎克雷伯菌胞外多糖广谱抗生物膜活性见图5。
3 讨论
细菌生物膜是临床进行侵袭性诊疗操作常见的感染原因之一。常见的生物膜细菌感染有铜绿假单胞菌生物膜引起的慢性骨髓炎、金黄色葡萄球菌生物膜引起的导管相关血流感染、大肠埃希菌生物膜引起的泌尿生殖道感染等[10]。生物膜细菌引起的感染通常有耐药性强、反复发作等特点,这与生物膜的特殊结构有关:①生物膜特殊的三维结构导致药物无法渗透和扩散,生物膜内eDNA、胞外多糖等成分将抗菌药物等杀菌物质与细菌有效隔离;②生物膜内部细菌代谢活性低,且其基因易发生转移和突变,导致对药物敏感性降低;③生物膜群体感应系统使生物膜细菌对不利因素的适应性增强[11]。虽然上述特点导致生物膜细菌难以清除,但是近年来有研究报道某些细菌的代谢产物具有抗生物膜活性作用。2006年Valle等[12]研究发现大肠埃希菌CFT073的Ⅱ型荚膜多糖能够抑制大肠埃希菌、肺炎克雷伯菌、葡萄球菌和肠球菌生物膜的形成。此后的研究发现铜绿假单胞菌、放线菌、益生菌的胞外产物对生物膜形成均具有一定的抑制作用,经鉴定此物质为多糖、蛋白质或短链脂肪酸[13-15]。肺炎克雷伯菌是实验室分离的常见菌,并且其在培养基中纯度较高。因此,本研究提出假设:肺炎克雷伯菌或其代谢产物存在着某些抗生物膜活性物质,这些活性物质能有效抑制其他细菌生物膜的形成。为了验证上述假设,首先对分泌具有抗表皮葡萄球菌生物膜活性物质的肺炎克雷伯菌菌株进行筛选,然后对活性较强的肺炎克雷伯菌胞外产物进行化学成分鉴定,最后对肺炎克雷伯菌胞外产物进行广谱抗生物膜活性研究。
本研究发现肺炎克雷伯菌上清液具有抑制表皮葡萄球菌生物膜活性,抑制率在16.1%~73.5%。说明不同的肺炎克雷伯菌菌株之间表达的具有抗生物膜活性物质的含量不同。为了明确肺炎克雷伯菌上清液中抗生物膜活性物质的化学性质,本研究采用高温、酶法等处理上清液,发现该物质仍然能抑制表皮葡萄球菌生物膜形成,说明该物质不属于蛋白质、核酸类物质。而经30 mmol/L高碘酸钠处理后,发现该活性物质对表皮葡萄球菌生物膜抑制作用消失,说明该活性物质为多糖。因为高碘酸钠是一种强氧化剂,能选择性氧化多糖中的邻二羟基使多糖失活,进而对表皮葡萄球菌生物膜抑制作用消失。进一步采用无水乙醇粗提上清液中的多糖,发现多糖抑制生物膜形成具有浓度依赖性,与Jiang等[8]的研究结果相符。为了研究该多糖是否通过抑制细菌生长从而影响生物膜的形成,将多糖对表皮葡萄球菌生长的影响进行了研究,发现加入粗提多糖之后,表皮葡萄球菌生长并没有出现抑制,反而具有轻微的促生长作用。说明肺炎克雷伯菌胞外多糖不是通过抑制细菌生长发挥抗生物膜作用,具体抗生物膜作用机制有待进一步研究。
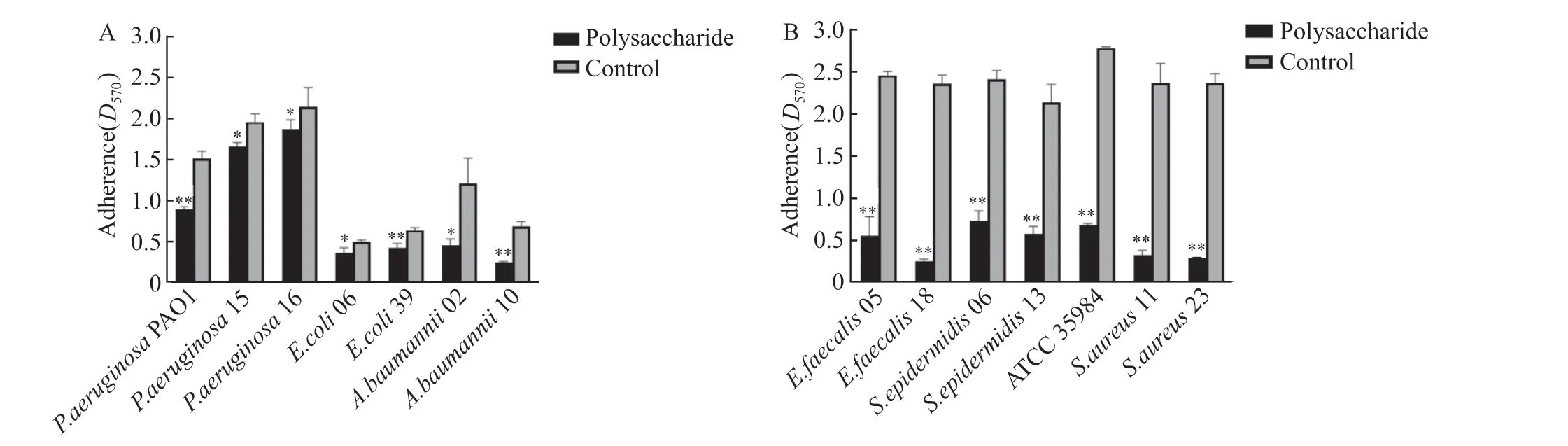
图5 肺炎克雷伯菌多糖的广谱抗生物膜活性Figure 5 Broad-spectrum anti-biofilm activity of Klebsiella pneumoniae polysaccharide
研究发现肺炎克雷伯菌胞外多糖,对大肠埃希菌、铜绿假单胞菌、鲍曼不动杆菌、金黄色葡萄球菌、粪肠球菌均具有不同程度的抗生物膜活性,其中该多糖对阳性球菌生物膜的抑制效果更强,可能机制是:①多糖能竞争性抑制细菌表面的黏附因子,降低了细菌表面张力,细菌生物膜无法形成;②多糖下调毒力基因抑制其他细菌胞外聚合物(EPS)的产生,导致无法建立有序的生物膜结构;③多糖抑制了群体感应系统中某些信号因子的产生,限制了细菌-细菌相互交流,导致生物膜无法成熟[16]。
综上所述,本研究发现一种具有广谱抗细菌生物膜活性肺炎克雷伯菌胞外多糖,该多糖抑制生物膜的效果有浓度依赖性。本研究结果可为将来抗生物膜活性药物研究提供实验依据。
