基于网络药理学联合分子对接探究玉屏风散治疗荨麻疹的作用机制
2021-05-31李春雨
武 燕,李春雨
安徽中医药高等专科学校(安徽 芜湖 241000)
荨麻疹(Urticaria)是由于皮肤、粘膜小血管扩张及通透性增加而引起的一种局限性的水肿反应[1],主要病理变化为真皮水肿,毛细血管及小血管扩张,淋巴管扩张及炎性细胞浸润[2]。荨麻疹在人群中的发病率达15%~20%,易反复发作。西医学对于荨麻疹的治疗主要为抗组胺药的对症治疗,其与组胺竞争效应细胞受体而缓解症状,但无法阻断组胺释放,且副作用明显[3]。荨麻疹在中医属于“隐疹”“风疹瘙痒”范畴,其基本病机为卫气不足,表虚不固,外感邪气。玉屏风散是中医扶正固表的名方,疗效卓著,应用广泛,是国家基本中成药,由黄芪、白术、防风组成[4]。方中黄芪益气固表为君,白术健脾益气,助黄芪之功为臣,芪君术臣,使气旺表固;防风祛风,固表而不留邪,主治气虚表弱,易感风寒。现代中医临床将玉屏风广泛用于荨麻疹的治疗,均取得较好的临床疗效[5]。药理学研究表明玉屏风散对于调节免疫有较强作用,本研究通过网络药理学联合分子对接技术从分子层面探讨玉屏风散治疗荨麻疹的作用机制。
1 资料与方法
1.1玉屏风散活性成分及潜在靶点的筛选在计算系统生物学实验室平台(TCMSP,http://tcmspw.com/tcmsp.php)及化学专业数据库(http://www.organchem.csdb.cn/scdb/default.htm)中,分别搜索中药黄芪(hedysarum multijugum maxim)、白术(atractylodes macrocephala koidz)、防风(saposhnikoviae radix)的活性成分及相关靶点信息,并依据药动学吸收、分布、代谢、排泄(ADME)参数进行筛选,设置筛选条件为OB≥30%、DL≥0.18。将所有潜在靶点进行合并,剔除重复项,得到玉屏风散活性成分的潜在靶点。
1.2玉屏风散活性成分靶点预测在Uniport数据库(https://www.uniprot.org/)中,借助Uniport KB功能检索玉屏风散活性成分对应靶点相关的人类基因简称,获得玉屏风散发挥治疗作用可能的基因靶点。
1.3荨麻疹相关疾病靶点预测分别在GeneCards、OMIM、Drugbank、PharmGKB、Therapeutic Target Database数据库中以urticaria为关键词检索相关的基因靶点。
1.4构建药物-活性成分-靶基因-疾病网络通过VennDiagram软件取药物与疾病基因靶点交集,得到药物发挥治疗作用可能的基因靶点。通过用Cytoscape3.7.0构建药物-活性成分-靶基因-疾病网络关系图。
1.5构建蛋白质相互作用网络(PPI)并分析核心基因将玉屏风散对荨麻疹发挥治疗作用可能的基因靶点输入String 11.0系统,构建PPI网络,设置置信区间为highest confidence=0.700,提高数据的可靠性。
对PPI网络进行拓扑学特征分析,通过Cytoscape的插件CytoNCA计算参数来评价网络中每个节点在功能上的重要性,以中间中心性(BC)、接近中心性(CC),度中心性(DC)、特征向量中心性(EC)、局部平均连通性方法(LAC)、网络中心性(NC)为参数对网络节点进行评分分析,筛选核心基因。
1.6核心基因的生物学过程及通路分析利用R语言的clusterProfiler软件包对核心基因进行GO富集分析和KEGG通路富集分析,以pvalue<0.05为纳入标准。对pvalue值最小的前30条通路绘制柱状图。
1.7分子对接选取PPI网络中的核心基因进行分子对接验证。在PubChem数据库检索玉屏风散对荨麻疹发挥治疗作用可能的活性成分的3D结构。在RCSB PDB数据库(http://www.rcsb.org/)搜索PPI网络中核心基因的靶蛋白,并下载其3D结构,保存为PDB文件。利用PyMOL软件对核心基因的靶蛋白结构进行去除水分子及小分子配体的处理,保存其构象文件。利用AutoDockTools软件对靶蛋白及药物活性成分的分子结构进行加氢、计算电荷等处理,并转换为PDBQT格式文件。以靶蛋白原型配体所在位置为中心确定活性口袋,设置参数size_x=40,size_y=40,size_z=40,spacing=1.0。利用AutoDock Vina 1.1.2软件进行分子对接,利用PyMOL软件对结合能最低的对接结果进行绘图分析。
2 结果
2.1玉屏风散活性成分及潜在靶点通过初步检索,得到黄芪活性成分20个,白术活性成分7个,防风活性成分18个,见表1。潜在靶点黄芪953个;白术774个,防风1 946个,剔除重复项,得到玉屏风散活性成分的潜在靶点共计723个。通过Uniport数据库,检索活性成分相对应的人类基因靶点共194个。

表1 玉屏风散有效生物活性成分

续表1
2.2荨麻疹相关疾病靶点预测以urticaria为关键词进行检索,在GeneCards数据库中检索到疾病相关基因靶点1 007个,OMIM数据库中检索到疾病相关基因靶点1个,Drugbank数据库中检索到疾病相关基因靶点57个,PharmGKB数据库中检索到疾病相关基因靶点1个,Therapeutic Target Database数据库中检索到疾病相关基因靶点5个。将所有疾病相关基因靶点取并集,共得到荨麻疹相关基因靶点1 071个。
2.3构建药物-活性成分-靶基因-疾病网络通过VennDiagram软件取药物与疾病基因靶点交集,得到玉屏风散治疗荨麻疹潜在的基因靶点86个。通过用Cytoscape3.7.0构建药物-活性成分-靶基因-疾病网络关系图,显示玉屏风散治疗荨麻疹相关的活性成分33个,其中对应的基因靶点数目最多的6个活性成分依次是槲皮素(MOL000098,quercetin)66个,山奈酚(MOL000422,kaempferol)28个,汉黄芩素(MOL000173,wogonin)22个,β-谷甾醇(MOL000358,β-sitosterol)16个,芒柄花黄素(MOL000392,formononetin)14个,异鼠李素(MOL000354,isorhamnetin)9个,见图1。

图1 药物-活性成分-靶基因-疾病(Urticaria)网络关系图
2.4构建PPI网络并分析核心基因将2.3中得到的基因靶点导入String数据库,构建玉屏风散治疗荨麻疹可能基因靶点的PPI网络图,见图2。
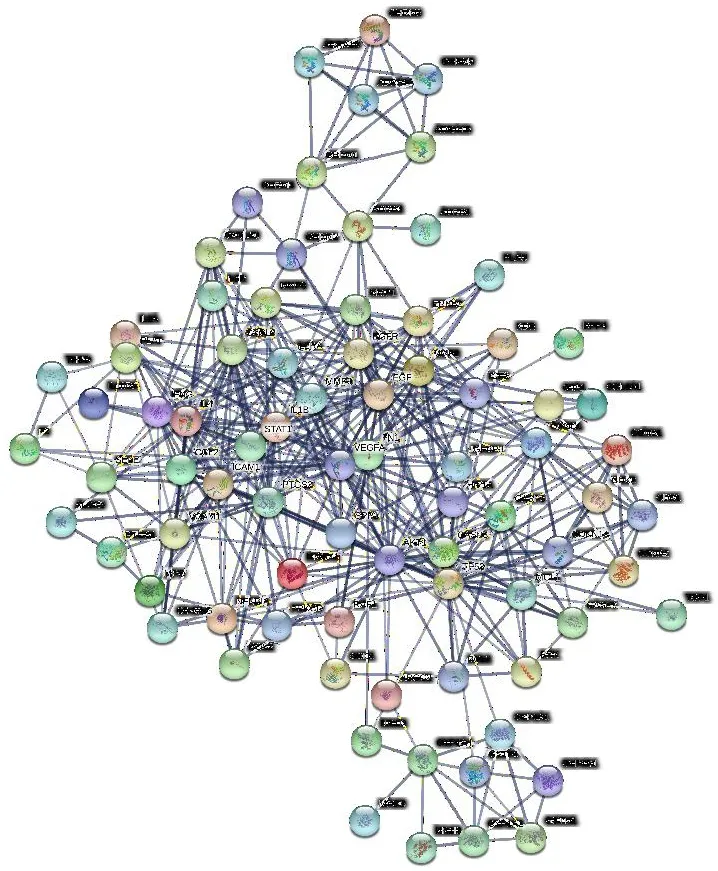
图2 玉屏风散治疗荨麻疹基因靶点的蛋白质PPI
利用Cytoscape 3.7.0软件的CytoNCA插件对PPI网络中的靶点进行拓扑学分析,设置过滤条件BC、CC、DC、EC、LAC、NC 6项评分均大于中位值。经过两次分析筛选,得到PTGS2、VEGFA、ICAM1、EGF、MMP9、IL4、CXCL8等11个核心基因靶点,见图3。
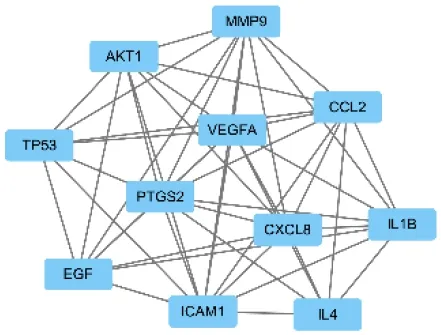
图3 玉屏风散对荨麻疹发挥治疗作用的核心基因靶点
2.5核心基因的生物学过程及通路分析GO富集分析结果显示生物过程主要涉及氧化应激反应(response to oxidative stress)、活性氧代谢过程(reactive oxygen species metabolic process)等,细胞组分主要涉及细胞膜膜筏(membrane raft)、细胞膜微结构域(membrane microdomain)等,分子功能涉及细胞因子受体结合(cytokine receptor binding)、G蛋白偶联胺受体活性(G protein-coupled amine receptor activity)等,见图4。
对86个靶点基因进行KEGG富集分析,P值排名靠前的主要有PI3K-Akt信号通路(PI3K-Akt signaling pathway)、糖尿病并发症中的AGE-RAGE信号通路(AGE-RAGE signaling pathway in diabetic complications)、流体剪切应力与动脉粥样硬化信号通路(Fluid shear stress and atherosclerosis)等,见图5。
2.6分子对接分子对接结果显示,槲皮素(quercetin)、山奈酚(kaempferol)、β-谷甾醇(β-sitosterol)、汉黄芩素(wogonin)等11个有效成分与对应基因靶点有较好的结合活性。其中,槲皮素通过氨基酸PHE-250与基因靶点MMP9结合,结合能为-11.0 kcal/mol;芒柄花黄素通过氨基酸TYR-136、LYS-468与基因靶点PTGS2结合,结合能为-9.6 kcal/mol;汉黄芩素通过氨基酸LYS-137、PRO-153、GLY-135与基因靶点PTGS2结合,结合能为-9.6 kcal/mol;槲皮素通过氨基酸ARG-645、GLY-613、ASP-611与基因靶点AKT12结合,结合能为-6.3 kcal/mol。可视化分析见图6-9。
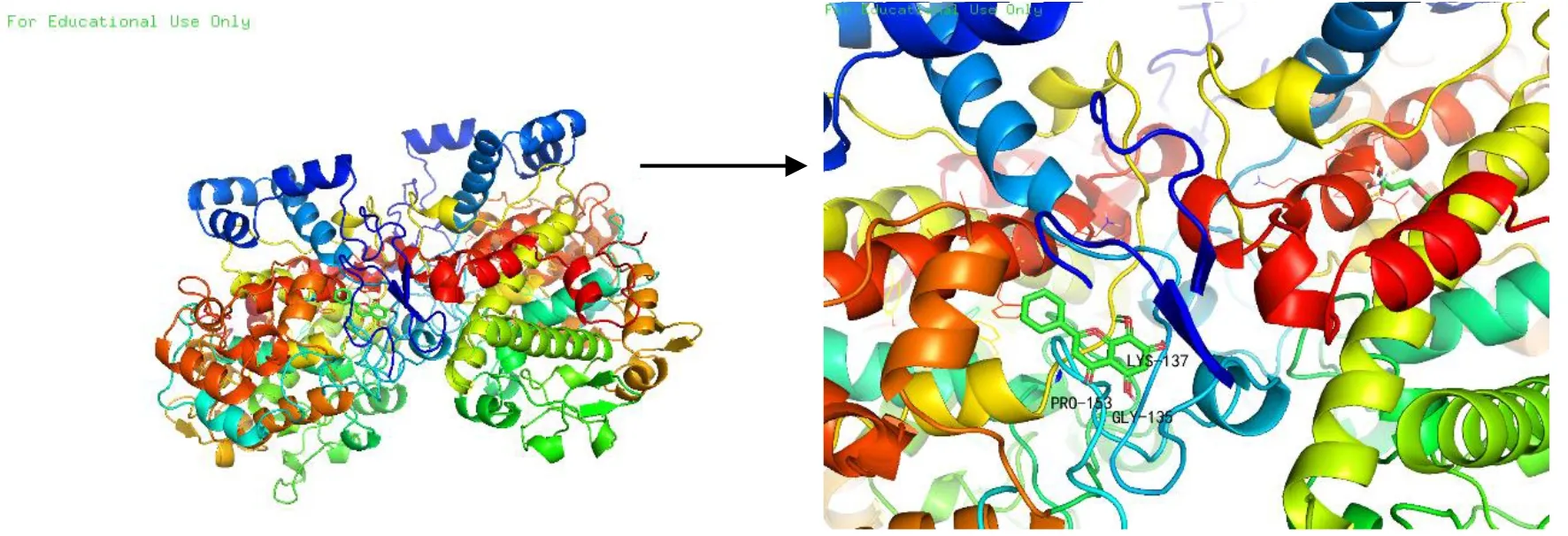
图8 汉黄芩素-PTGS2分子对接模式图(Affinity=-9.0 kcal/mol)
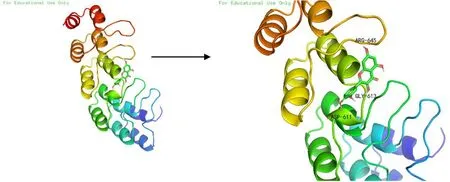
图9 槲皮素-AKT12分子对接模式图(Affinity=-6.3 kcal/mol)
分子对接虚拟技术显示,化合物均稳定位于对接口袋内,槲皮素在活性位点周围与氨基酸PHE-250形成氢键结合MMP9;芒柄花黄素在活性位点周围与氨基酸TRY-136、LYS-468形成氢键、碳键结合到PTGS2;汉黄芩素在活性位点周围与氨基酸LYS-137、GLY-135、PRO-153形成氢键、氧键结合到PTGS2;槲皮素在活性位点周围与氨基酸ARG-645、GLY-613、ASP-611氢键结合到AKT12。
3 讨论
本研究得到玉屏风散活性成分45个,通过构建药物-活性成分-靶基因-疾病网络,筛选出其治疗荨麻疹可能的活性成分33个,其中对应的基因靶点数目最多的依次是槲皮素,山奈酚,汉黄芩素,β-谷甾醇,芒柄花黄素,异鼠李素等6个活性成分,均具有抗炎、抗氧化应激、调节免疫等功能,是治疗荨麻疹的关键活性物质。研究表明[6-9]槲皮素可以通过调控PI3K-Akt信号通路下调炎症因子IL-1β、TNF-α等的表达发挥抗炎作用;槲皮素在体内可以提高一氧化氮水平和外周血总抗氧化能力,并保护血管内皮[10-11],在体外可以清除超氧阴离子、羟自由基、单线态氧等氧自由基而发挥抗氧化应激作用[12-13]。山奈酚通过抑制COX-2、PGE2、MMP9等炎性因子的释放而发挥抗炎作用[14]。汉黄芩素可降低炎症因子IL-6、IL-8和趋化因子MCP-1的释放,减轻炎症反应[15-16]。β-谷甾醇可抑制组胺、PEG2、缓激肽等炎症介质活性,降低毛细血管通透性而抗炎[17];通过清除氧自由基,并维护细胞膜结构的稳定而发挥抗氧化应激作用[18];通过降低TSLP的水平来降低过敏反应造成的皮肤细胞损伤[19]。芒柄花黄素可下调雌激素样受体水平,改善人体内分泌微环境而提高免疫力[20],还可以提高抗氧化超氧化物歧化酶、谷胱甘肽过氧化酶、过氧化氢酶的活性,减少氧自由基的生成,通过清除有害的氧自由基,继而提高机体的抗氧化应激能力[21]。异鼠李素可以上调Nrf2-ARE信号通路增加抗氧化酶的表达而发挥抗氧化应激的作用[22]。
通过对PPI网络核心基因分析,玉屏风散治疗荨麻疹的关键基因靶点有PTGS2、VEGFA、ICAM1、EGF、MMP9、IL4、CXCL8等11个。PTGS2是前列腺素内过氧化物合酶的一个亚型,为膜整合蛋白,可在多种因素诱导下产生和释放前列腺素从而调节炎症反应。VEGFA属于血管内皮生长因子,在缺氧状态下可诱发氧化应激反应并引起血管通透性增加。ICAM1是细胞表面诱导性糖蛋白,与特异性受体结合可增强内皮细胞及炎性细胞的粘附,诱发炎症反应。EGF为表皮生长因子,其依赖PI3K-Akt信号通路可降低IL-6、IL-1β等前炎性因子的释放及下调CCL2、CCL5及CXCL10等趋化因子的表达,在皮肤细胞中表现尤为明显[23]。IL-4对于B细胞、T细胞、肥大细胞、巨噬细胞和造血细胞均有免疫调节作用,IL-4基因多态性与荨麻疹、哮喘、过敏性鼻炎等多种免疫失调性疾病密切相关[24]。MMP9属于基质金属蛋白酶,对CXCL8、VEGFA具有调节作用而参与炎性反应[25]。以上表明,荨麻疹是免疫系统失调而诱发的皮肤细胞出现氧化应激及炎性反应的疾病。
GO富集分析显示,玉屏风散治疗荨麻疹可能通过调节氧化应激反应、脂多糖的反应等生物过程,干预相关细胞因子受体结合等分子功能而发挥抗炎、抗氧化应激、调节免疫的作用。KEGG富集分析显示,玉屏风散治疗荨麻疹的关键靶点富集于PI3K-Akt信号通路、糖尿病并发症中的AGE-RAGE信号通路、流体剪切应力与动脉粥样硬化信号通路等炎性反应、氧化应激、血管内皮细胞等信号途径上。PI3K-Akt信号通路是细胞信号传导的重要通路,通过多种效应调节细胞基本功能,其表达上调可激活淋巴细胞增殖分化而发生免疫失调。AGE-RAGE信号通路在免疫球蛋白RAGE受体诱导下可以促进氧化自由基的形成而诱发氧化应激反应。流体剪切应力与动脉粥样硬化信号通路通过调节内皮细胞中的炎症因子、VCAM-1和ICAM-1调控炎症反。
分子对接结果显示,槲皮素、芒柄花黄素、β-谷甾醇、汉黄芩素等化合物与PTGS2、EGF、MMP9、AKT12等对应基因靶点均有较好的结合活性,它们可能是玉屏风散治疗荨麻疹潜在的活性成分。
综上所述,网络药理学联合分子对接研究显示玉屏风散的多种活性成分通过多靶点、多通路、相互协同的复杂机制调节人体免疫功能,降低皮肤细胞的炎性反应及氧化应激反应从而对荨麻疹发挥治疗作用。鉴于目前医学对荨麻疹的发病机制的认识仍存在不足,网络药理学的研究方法有其局限性,后期还需要进一步的实验研究来探讨玉屏风散治疗荨麻疹的作用机制。
