基于真实问题解决的复习课设计策略
2021-05-30夏中伟
夏中伟


摘 要: 在中考复习中,教师对于知识和技能的复习通常用习题来完成.久而久之,学生对复习提不起兴趣.因此,创设真实情境,把复习课建立在真实的问题解决上.把枯燥的复习课改成实验课.在动手实验过程中收集证据,以证据推理的形式完成实验的探索.
关键词: 真实问题的解决;金属的性质复习;初中化学
中图分类号: G632 文献标识码: A 文章编号: 1008-0333(2021)35-0106-02
一、教学设计初衷
金属的性质,在教材中属于比较重要的内容.在教学中广大老师也会进行实验教学.但是通常是书本上的一些规定实验.有些实验甚至是错误的.在平时教学中,会遇到黄铜中铜元素质量分数的测定.按照一贯的做法,就是将黄铜取样后与足量的稀盐酸反应,充分反应后经过洗涤、烘干,再次称量剩余固体的质量即为金属铜的质量.实际操作中,笔者发现,这种操作根本不可能完成实验.黄铜是铜锌两种金属的合金,它们在合金中均匀的分散在一起.实际操作中,很难靠这种办法,将活泼的锌全部反应掉,留下不活泼的铜.因为表面的锌反应完了,表面留下的铜,会将内部的黄铜包裹起来,产生一种“屏蔽效应”,阻止了内部的锌继续反应.因此在教学中,笔者将实验的设计换了新的思路.为了避免在实验室灼烧过程中产生空气污染物,笔者在金属和酸反应的实验过程中,加入氧化剂双氧水,既能将金属反应掉,也避免了空气污染,更好地完成了实验.
二、课堂实录
[引入]教师首先展示一张白象牌干电池的照片
[问]你知道干电池的正极用的什么金属材料吗?(注:不同品牌的电池,所用的金属材料不同.此实验仅以白象电池为例.南孚等电池多数用铁.)
[生]可能是铁,因为颜色是银白色的.
[问]你还知道其他哪些金属的颜色呢?
[生]铝、镁、铁等大多数常见金属都是银白色,但也有一些金属不是银白色.比如铜是红色,黄金是金黄色.但同时,金属的颜色和它状态也有关系,铁粉、银粉就是黑色的.
[师]那么干电池正极所用金属中有没有铜呢?
[资料] 焰色反应:某些金属或它们的化合物,在无色火焰中灼烧时,使火焰呈现特殊颜色的反应.
[演示实验] 将铜帽在砂纸上打磨掉外面镀层.在酒精灯上灼烧片刻,再放入稀盐酸中浸泡,再次放在酒精灯上灼烧,观察焰色反应.(注:直接灼烧铜通常很难看到焰色反应.经过上述操作,形成铜的氯化物后,灼烧时焰色反应的现象比较明显.)
[生]看到了绿色火焰,证明白象电池的正极金属中确实含有铜.
[问]同学们,你知道电池工厂在生产的时候,为什么要在金属帽的表面镀一层银白色金属吗?
[生]可能是为了防锈并且镀的这种金属颜色更美观.
[问]铜的价值是比较高的,而且铜是我们国家的紧缺资源,同学们没有办法根据所学的知识回收其中的铜呢?
[生]我觉得可以试一试用盐酸将表面的镀层金属反应掉.
[师]那我们就来试一试,刚才同学说的方法行不行.
[学生实验]取一个金属帽,放入试管中,加入適量稀盐酸.对试管加热至沸腾后撤去酒精灯,并观察现象.
[现象]能看到金属帽表面在加热时有少量气泡,但是不加热现象很不明显.
[总结]看样子表面的这种金属是一种能和稀盐酸反应的金属.但是反应比较慢.不加热几乎没反应.我们换个角度来想一想,既然它能够在空气中保持不生锈,说明 它的耐腐蚀性是比较强的.这种方法可行,但效果显然不好.
[师]所以我们还要想点别的办法.请大家向刚才的试管中逐滴加入6%的过氧化氢溶液.并记录实验现象.
[现象] 剧烈反应,有气泡产生.金属帽表面的银白色物质消失,金属帽露出红色固体.过氧化氢溶液滴加过量会有蓝色溶液产生.
[问]产生的气泡是什么气体呢?
[生]可能是氢气或者氧气
[师]那我们用带火星的木条检验一下.
[现象]带火星的小木条复燃
[总结]加入的过氧化氢产生了氧气,帮助了酸和表面的银白色金属反应.剩下的红色固体是内部的铜.
[问]产生了蓝色溶液说明了说明呢?
[生]可能有氯化铜生成
[资料] 2Cu+4Cl+O2 △ 2CuCl2+22O
[师]反应过程中,我们需要控制滴加过氧化氢的量,否则就会有铜被反应,生成氯化铜而损失.我们有没有办法将氯化铜提炼出来呢?
[生]可以用价格便宜的活泼金属比如铁,将其置换出来
[师]请大家动手试一试能不能置换得到铜
[学生实验]另取一支试管,倒入少量得到的蓝色溶液.并在试管中插入一根打磨过的铁丝,观察实验现象.
[现象]铁丝表面有红色固体产生.
[问]大家从回收效率,反应速率,效益等方面,思考一下用这个方法回收铜好不好?
[生]反应速率较快,但是不容易控制,稍有不慎会损失部分铜.反而增加了回收步骤.
[师]老师也做了这个实验,如果精确控制加入的各种试剂的量,确实能回收其中的铜.回收得到的粗通产率为91.3%.
[学生实验]我们更进一步研究得到的固体的成分.将试管中的金属倒出,洗净,擦干,用砂纸轻轻的打磨表面,请观察颜色变化.
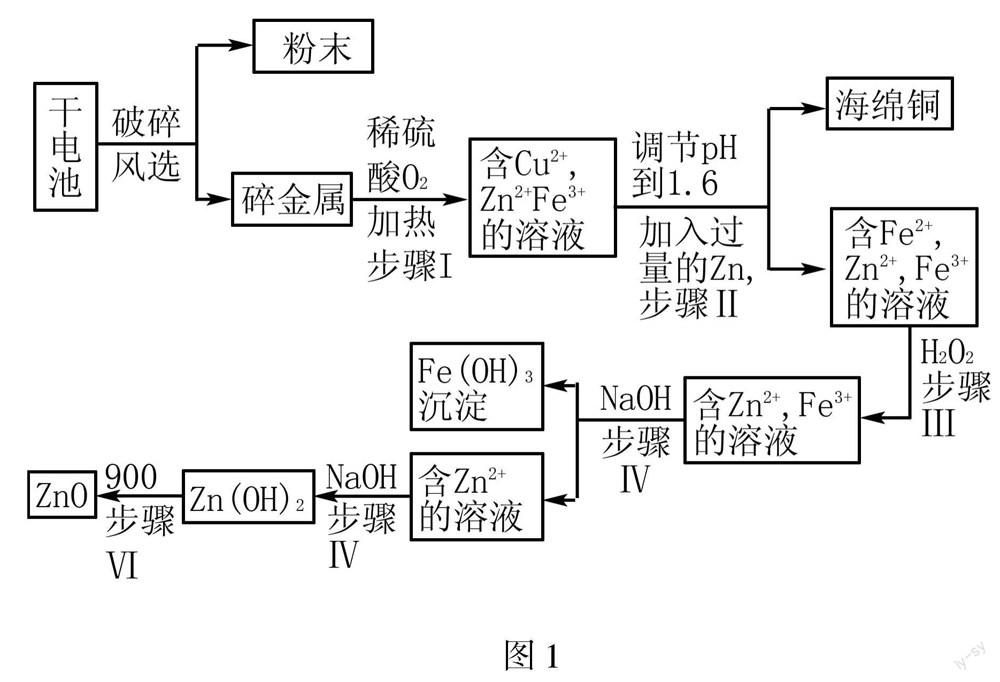
[师]同学们有没有观察到,经过打磨后,其实并不是红色,有点发黄.实际上金属帽用的是黄铜.黄铜是铜锌两种金属的合金,它们在合金中均匀的分散在一起.实际操作中,我们很难将活泼的锌反应掉,留下不活泼的铜.因为表面的锌反应完了,表面剩余的铜会将金属帽包裹起来,产生一种“屏蔽效应”,阻止了内部的锌继续反应.如果我们要回收得到纯铜,还需要进一步提炼.那么工业上是如何大规模提纯,分离各种金属成分的呢.我们来看看其中一种流程(如图1所示).
[总结]日常生活中,我们所用的金属通常为各种合金,很少会用到纯金属.工业上在回收金属时所遇到的问题会更复杂.如何高效,全面的回收各种金属,将效益最大化,是工厂追求的目标.因此采取的办法也比实验室更加复杂,要求也比实验室高的多.为适应大规模的生产,通常会用到各种专业机械和设备,这也是我们实验室提炼和工厂大规模生产的不同.在理论转化为实践的过程中,我们会遇到各种实验室没有的问题,就需要我们发挥聪明才智,调动我们的各种技能,希望同学们多掌握各种知识,做一个复合型人才.
[教学反思]本节课选取了生活中常见的物品,将原本枯燥的理论复习,转变成了有趣的实验.将复习课建立在实际问题的解决上.将学生学到的知识重新构建,再将所学的知识和能力在实际问题的解决中得到提升.这样就不会让学生觉得我们的化学课就是实验室瓶瓶罐罐,就是练习本上的刷题,就是一些书本上的理论知识.复习课也不再是令人反感的炒冷饭.这种基于就地取材的真是情境能让学生关注课堂,喜欢课堂.
参考文献:
[1]人民教育出版社,课程教材研究所,化学课程教材研究开发中心.义务教育教科书·化学[M].北京:人民教育出版社,2015.
[责任编辑:季春阳]
