氯喹通过阻断肿瘤坏死因子受体相关因子3自噬性降解抑制类风湿关节炎滑膜细胞活化
2021-05-28吕昌伟和晶张乾郗海涛强毅张静涛
吕昌伟 和晶 张乾 郗海涛 强毅 张静涛
西北大学附属医院/西安市第三医院骨科(西安710018)
类风湿性关节炎是一种慢性炎症性自身免疫性疾病,最终可导致骨关节损伤甚至残疾[1]。类风湿性关节炎病理改变以慢性滑膜炎和骨关节结构损害为特征,其发病机制尚未明确,目前并无完全有效的根治方法[2]。近来的研究显示,纤维样滑膜细胞(fibroblast⁃like synoviocyte,FLS)的异常活化在类风湿性关节炎的发展中发挥了关键作用,其可通过产生炎性因子引起滑膜炎症和病理损伤[3]。活化的FLS表现出过度增殖,并产生多种炎症因子、趋化因子和基质金属蛋白酶(matrix metalloproteinase,MMP),如TNF⁃α、IL⁃1β、IL⁃6、CXCL10、MMP⁃2和MMP⁃9,造成关节的慢性炎症和持续性破坏[4]。肿瘤坏死因子受体相关因子3(TNF receptor associated factor 3,TRAF3)是属于肿瘤坏死因子受体作用因子超家族成员,是细胞内一种重要的负性调控蛋白,包括抑制CREB、NF⁃κB和STAT3信号[5]。NF⁃κB信号的异常激活可引起持续高强度炎症,导致IL⁃6、MMP⁃2、MMP⁃9、CXCL10等多种炎性因子水平升高,诱发多种自身免疫性疾病[6],并在FLS的激活中发挥了重要作用[4]。
目前,氯喹用于类风湿性关节炎治疗取得了较好的疗效,但其作用机制尚不明确。本研究探讨氯喹对FLS异常激活的抑制作用,并通过探讨氯喹对TRAF3蛋白水平的影响,以及对TRAF3自噬性降解的影响,以期阐明氯喹抑制FLS活化的分子机制,为氯喹治疗类风湿性关节炎的临床应用提供依据。
1 材料与方法
1.1 细胞培养与处理类风湿关节炎滑膜细胞(MH7A)于重庆巴而思生物科技有限公司购买,采用RPMI⁃1640培养基(Gibco,美国)补充10%胎牛血清(AusGeneX,澳大利亚)和1%青链霉素(碧云天,中国)进行培养。采用TNF⁃α预处理建立类风湿关节炎滑膜细胞活化模型,即除对照组外,所有MH7A细胞接受5 ng/mL的重组人THF⁃α(BBI,中国)预刺激24 h。根据实验,分别采用20 μmol/L氯喹(MCE,美国)、10 μmol/L雷帕霉素(Rapa,MCE)和10 μmol/L蛋白酶体抑制剂MG⁃132(MCE)处理细胞24 h。siRNA干扰TRAF3表达细胞,进行siRNA转染后,进行上述药物处理。
1.2 si⁃RNA转染使用不含青霉素/链霉素的RPMI⁃1640培养基接种细胞至6孔板,培养12 h。将TRAF3 siRNA(Santa Cruz,美国)溶于optiMEM培养基(Gibco),将相应体积lipofectamin 2000(In⁃vitrogen,美国)溶于optiMEM培养基中,将配制好的siRNA溶液和lipofectamin 2000溶液等体积混合,室温稳定20 min,加入4倍体积新鲜optiMEM培养基混匀。吸出细胞旧培养基,每孔加入1 mL配制好的siRNA转染液,细胞培养箱中孵育5 h,换为正常培养基,继续培养24 h后用于后续实验。
1.3 细胞增殖检测细胞处理结束后,采用CCK⁃8试剂(碧云天)检测细胞增殖。吸出旧培养接,使用新培养基配制CCK⁃8溶液,加入各处理孔,37℃培养箱放置1 h,使用酶标仪(TECAN,瑞士)在450 nm测定吸光度。
1.4 Real⁃time PCR细胞处理结束后,RNAiso Plus(TaKaRa,中国)按照使用说明书提取总RNA,采用PrimeScriptRT Master Mix试剂盒(TaKaRa)按照说明书逆转录为cDNA。采用TB Green Premix Ex Taq II试剂盒(TaKaRa)按照使用说明,进行real⁃time PCR检测。引物序列如下:GAPDH:forward 5′⁃AGGTCGGTGTGAACGGATT⁃3′,reverse 5′⁃AAT CTCCACTTTGCCACTGC⁃3′;TRAF3:forward 5′⁃AC⁃ATCCGCCTAGCCGACATGG⁃3′,reverse 5′⁃CTGCT⁃TCCGCCGCTTGTAGTC⁃3′。
1.5 ELISA检测细胞处理结束后,收集细胞培养上清,采用ELISA试剂盒检测细胞培养上清中促炎因子含量。IL⁃6和CXCL10 ELISA检测试剂盒订购于博士德生物,按照产品说明书进行操作。
1.6 Western blot细胞处理结束后,RIPA裂解液(碧云天,中国)提取蛋白,BCA蛋白测定试剂盒(碧云天)测定蛋白浓度,加入4×Laemmli上样缓冲液(Bio⁃Rad,美国),97.5℃变性10 min。SDS⁃PAGE凝胶电泳,转模后5%脱脂奶粉室温封闭,洗膜后分别孵TRAF3一抗(1∶1 000,CST,美国)、LC3一抗(1∶1 000,CST)、MMP⁃2一抗(1∶1 000,Protein⁃tech)、MMP⁃9一抗(1∶1 000,Proteintech),β⁃actin一抗(1∶2 000,CST),4℃过夜。洗膜后羊抗鼠和羊抗兔二抗(1∶1 000,碧云天)室温孵育1 h,化学发光,ChemiDocTMXRS+凝胶成像系统(Bio⁃Rad)中曝光检测。
1.7 统计学方法结果数据采用()表示,采用GraphPad Prism 8.0软件进行统计分析。两组数据之间的比较采用t检验,多组数据之间的比较采用单因素方差分析并跟以Fisher′s post hoc检验进行两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 氯喹抑制类风湿关节炎滑膜细胞活化相比对照组,TNF⁃α刺激导致了MH7A细胞IL⁃6和CX⁃CL10分泌显著增加(图1B、C),并且引起了MH7A细胞侵袭蛋白MMP⁃2和MMP⁃9表达增加(图1D),表明TNF⁃α预刺激有效引起了MH7A细胞活化。与TNF组相比,氯喹处理显著抑制了MH7A细胞增殖(图1A),降低了TNF⁃α引起的IL⁃6和CXCL10分泌(图1B、C),以及MMP⁃2和MMP⁃9表达(图1D)。这些结果表明,氯喹可显著抑制类风湿关节炎滑膜细胞活化。
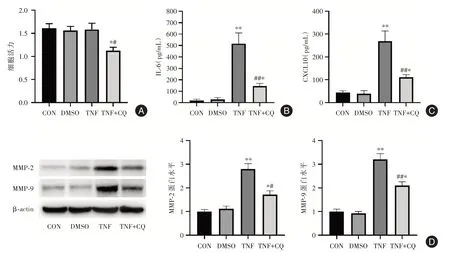
图1 氯喹抑制MH7A纤维样滑膜细胞活化Fig.1 Chloroquine inhibits the activation of MH7A fibroblast⁃like synoviocytes
2.2 氯喹引起MH7A细胞TRAF3蛋白含量升高TNF⁃α刺激和氯喹处理均未引起MH7A细胞TRAF3 mRNA表达的变化(图2A),表明氯喹并不引起TRAF3基因表达水平的改变。然而,Western blot结果显示。氯喹处理可导致MH7A细胞内TRAF3蛋白含量显著升高(图2B)。这些结果提示,氯喹所致的TRAF3蛋白水平升高,并不是源于其基因表达的上调,而可能源于氯喹抑制了TRAF3的降解。
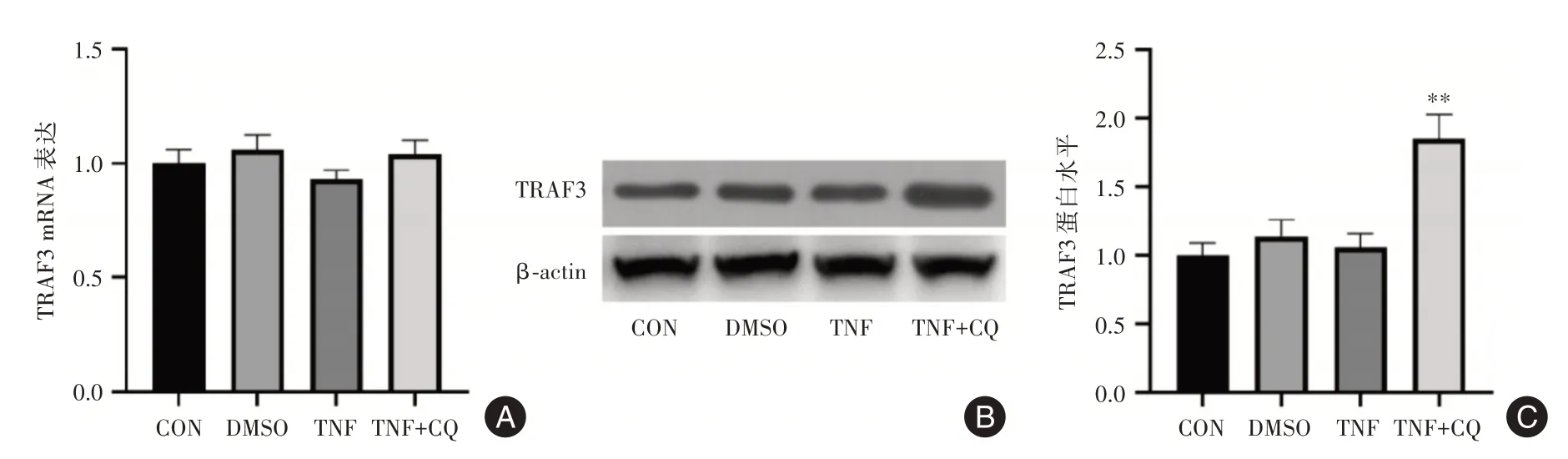
图2 氯喹引起MH7A滑膜细胞TRAF3蛋白表达升高Fig.2 Chloroquine increased the expression of TRAF3 protein in MH7A synoviocytes
2.3 TRAF3介导了氯喹对MH7A细胞活化的抑制通过TRAF3 siRNA下调MH7A细胞TRAF3蛋白表达,探讨TRAF3在氯喹抑制MH7A细胞活化中的作用。结果显示,si⁃TRAF3显著降低了MH7A细胞内TRAF3蛋白水平(图3A)。由结果可见,si⁃TRAF3可显著拮抗氯喹对MH7A细胞活化的抑制作用,阻断了氯喹对IL⁃6和CXCL10的分泌抑制(图3B、C),并解除了氯喹对MMP⁃2和MMP⁃9蛋白表达的抑制(图3D)。
2.4 氯喹抑制了TRAF3蛋白的自噬性降解进一步实验可见,氯喹可引起MH7A细胞LC3Ⅱ/Ⅰ蛋白比值降低(图4A),表明氯喹抑制了MH7A细胞自噬。自噬诱导剂雷帕霉素(RA)则显著增加了细胞自噬水平(图4A)。并且,雷帕霉素拮抗了氯喹的效应,导致MH7A细胞TRAF3蛋白水平明显降低(图4B)。此外,氯喹所致的TRAF3蛋白含量升高未被蛋白酶体抑制剂MG132进一步增强(图4B)。这些结果表明,氯喹可能主要通过抑制细胞自噬,阻断TRAF3的自噬性降解,导致了MH7A细胞TRAF3蛋白含量升高。
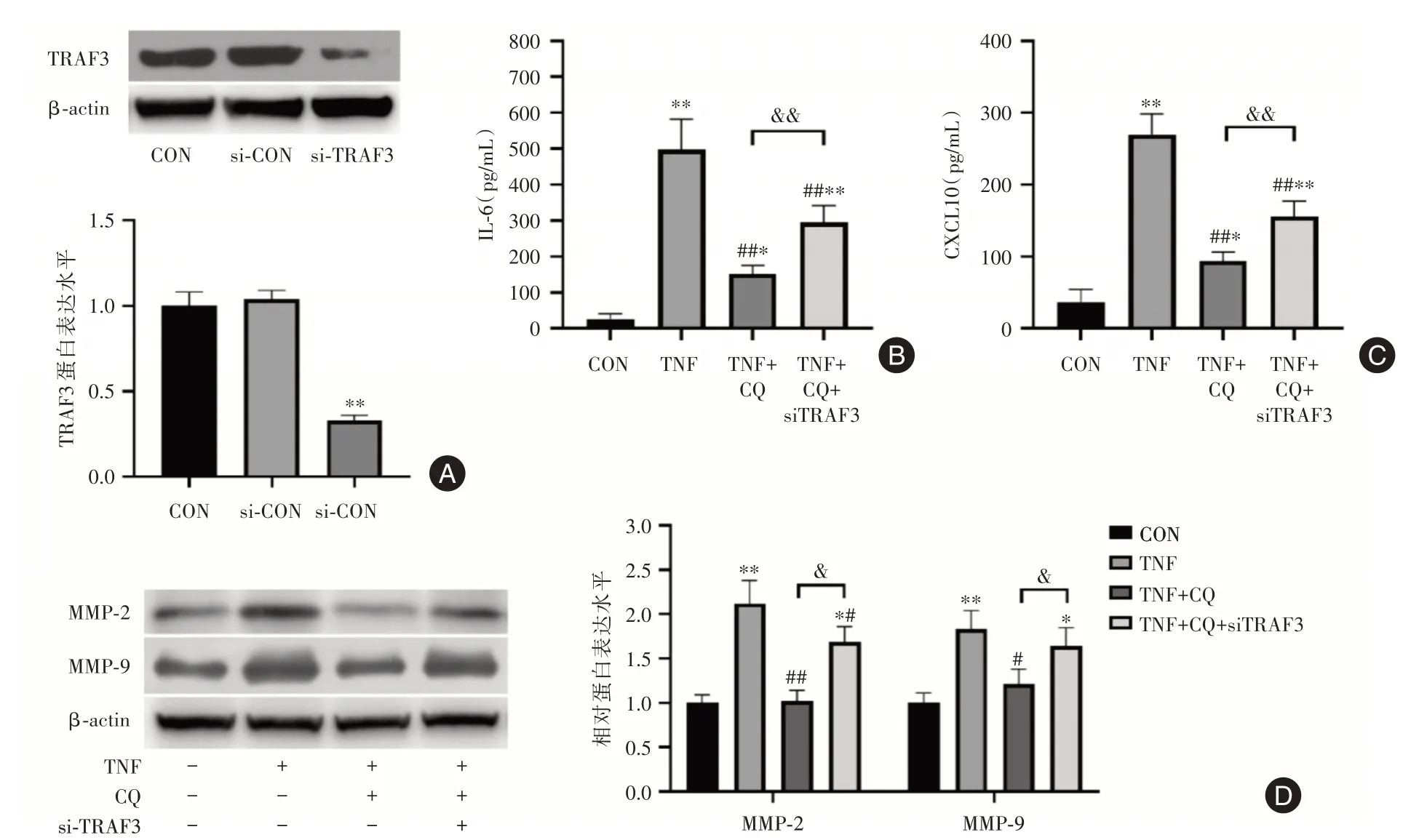
图3 TRAF3介导了氯喹对MH7A细胞的活化抑制Fig.3 TRAF3 mediated the inhibition of the activation of MH7A cells by chloroquine
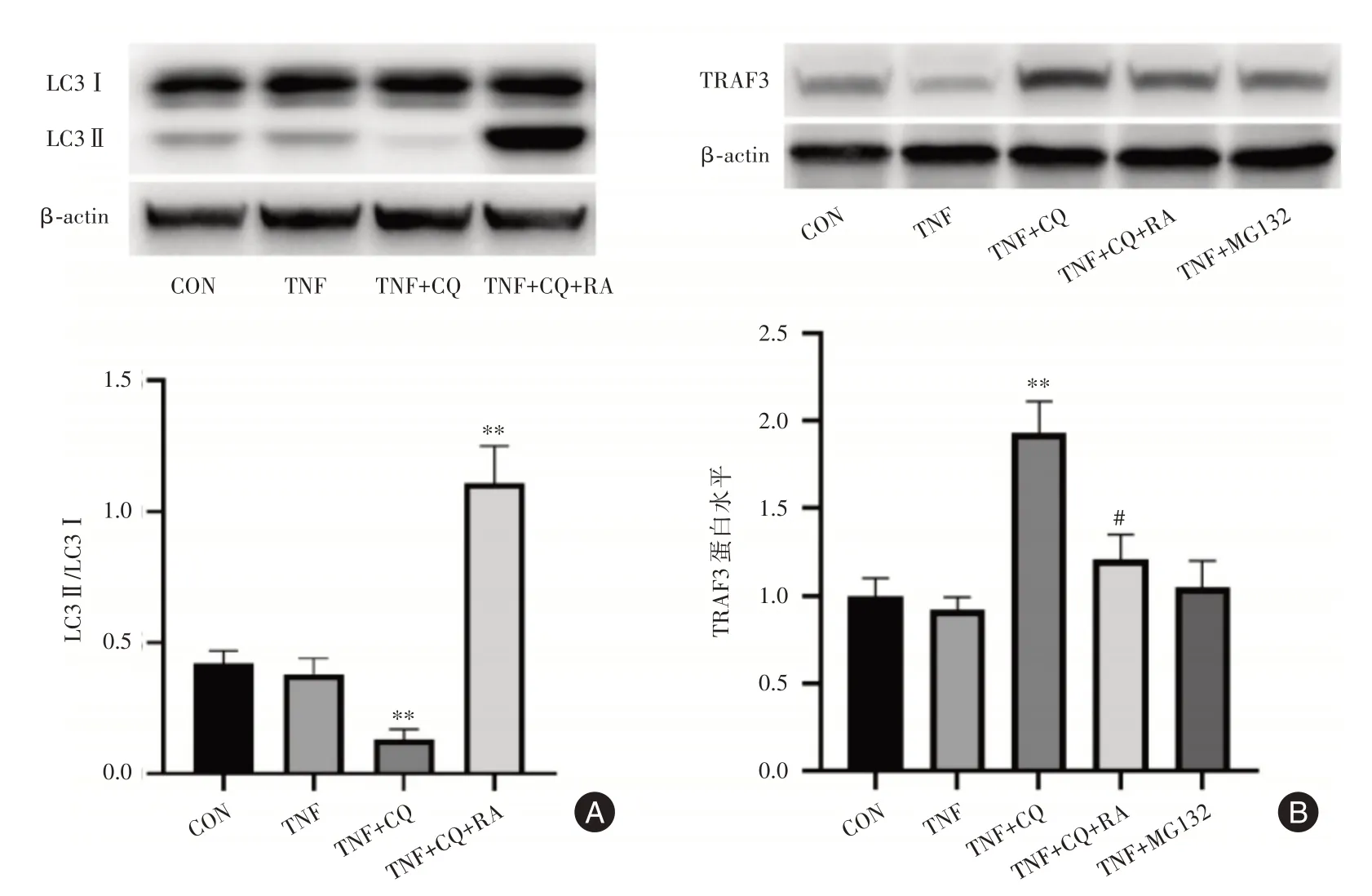
图4 氯喹抑制MH7A细胞自噬和TRAF3蛋白自噬性降解Fig.4 Chloroquine inhibits autophagy of MH7A cells and autophagic degradation of TRAF3 protein
2.5 诱导自噬可拮抗氯喹对MH7A细胞的活化抑制采用自噬诱导剂雷帕霉素和氯喹共处理MH7A细胞。可见,与氯喹处理组相比,雷帕霉素可对抗氯喹作用,显著促进MH7A细胞IL⁃6和CX⁃CL10分泌增加(图5A,B),并引起MH7A细胞MMP⁃2和MMP⁃9蛋白水平升高(图5C)。这些结果进一步证实了氯喹通过阻止TRAF3自噬性降解抑制MH7A细胞活化。
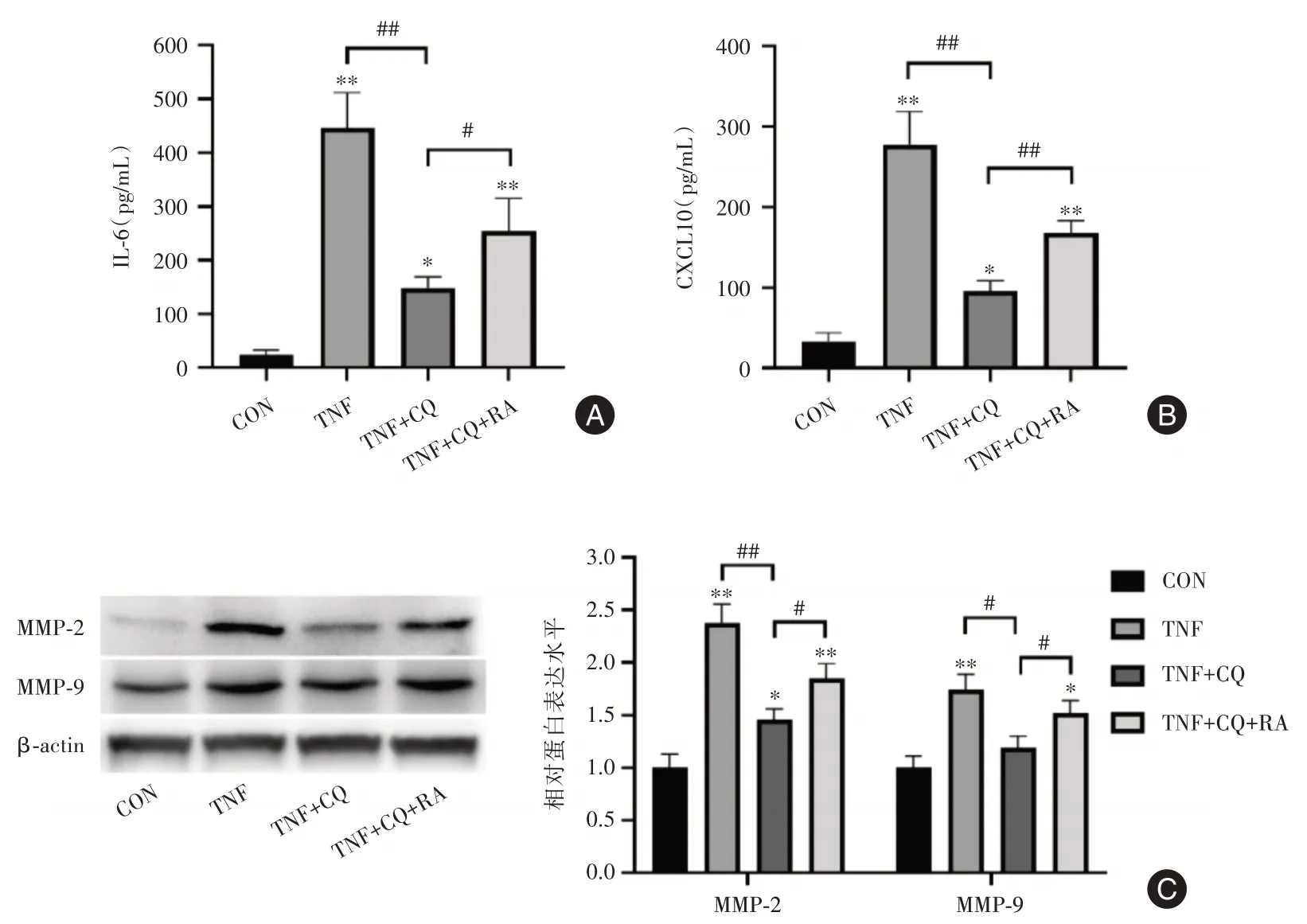
图5 诱导自噬可拮抗氯喹对MH7A细胞的活化抑制Fig.5 Induction of autophagy antagonized the inhibition of MH7A cell activation by chloroquine
3 讨论
类风湿性关节炎的病理机制至今尚未明确,使得其缺乏确切有效的根治方法。近来,纤维样滑膜细胞(FLS)的异常活化在类风湿性关节炎的发病机理中获得了重视。FLS在类风湿性关节炎的多种病理进程中均发挥了关键作用,如滑膜炎症,血管翳生长,以及最终的软骨和骨破坏[7]。FLS在炎性滑膜的异常增生是类风湿性关节炎的典型特征[7]。这种细胞的增多源于FLS的大量增殖和凋亡减少[8]。另外,FLS被激活后可分泌基质金属蛋白酶,使细胞表现出侵袭特性,并导致关节组织破坏[7,9]。在类风湿性关节炎的滑膜炎症中,FLS激活同样发挥了重要作用。活化的FLS可分泌多种促炎因子,如IL⁃6、IL⁃1β和CXCL10等[10-11],进而影响其他细胞和自身免疫反应性。本研究中,采用TNF⁃α预刺激建立FLS活化模型。结果可见,TNF⁃α预刺激可引起FLS细胞增殖,导致MMP⁃2和MMP⁃9蛋白表达升高,并引起IL⁃6和CXCL10分泌的增加,表明TNF⁃α刺激有效引起了FLS细胞的活化。
氯喹和羟氯喹已被应用于治疗轻中度类风湿性关节炎,以及重度类风湿性关节炎治疗时的联合用药[12]。虽然氯喹对免疫⁃炎症反应的抑制作用已被发现和报道,包括抑制免疫细胞增殖和活性,抑制炎症因子分泌,但对其治疗类风湿性关节炎的药理机制了解仍非常有限[13]。在本实验研究发现,氯喹处理可有效抑制FLS细胞的增殖、炎症因子分泌以及侵袭标志物MMP⁃2和MMP⁃9的表达,表明氯喹可有效抑制FLS的异常活化。这些结果表明,抑制FLS异常激活可能是氯喹治疗类风湿性关节炎的重要机制。同时,氯喹是一种高效的亲溶酶体抑制剂,可特异的抑制细胞溶酶体自噬途径[14]。自噬从多个方面参与了类风湿性关节炎的病理进程,包括FLS的存活、侵袭和凋亡抵抗[15]。最新的研究显示,抑制自噬可以提高类风湿性关节炎的治疗效果[16]。因此,氯喹可能通过抑制溶酶体自噬而发挥上述FLS活化抑制作用。本研究证实,氯喹处理可显著抑制FLS细胞自噬,表现为LC3Ⅱ/Ⅰ蛋白比值的降低。
TRAF3是一种重要的炎症⁃免疫负性调控因子,其通过抑制多种信号通路而抑制免疫细胞活化,如NF⁃κB、IL⁃6R、CD40和CREB信号通路[5,17]。已有研究显示,激活TRAF3信号可以抑制肝癌细胞的增殖和侵袭,并可减轻动物炎症反应[18-19]。本研究发现,氯喹能够增加MH7A细胞内TRAF3的蛋白含量,而干扰TRAF3表达阻断了氯喹对MH7A细胞活化的抑制,表明氯喹通过TRAF3增加抑制FLS活化。进一步研究发现,并且这种增加不是由于基因表达的增加。因此,氯喹可能通过抑制溶酶体自噬降解而实现TRAF3的蛋白含量升高。这一猜测被自噬诱导剂和蛋白酶体抑制剂实验证实。这些结果表明,氯喹通过阻断TRAF3溶酶体自噬降解,抑制FLS细胞活化。
NF⁃κB信号激活和类风湿性关节炎的滑膜病变程度程正相关,抑制NF⁃κB表达和信号激活,可显著抑制类风湿性关节炎的病情进展[20],而增加NF⁃κB表达可加速类风湿性关节炎的侵袭进展[21]。NF⁃κB是TRAF3的主要负性调控信号通路,因此TRAF3对纤维样滑膜细胞活化的抑制可能藉由抑制NF⁃κB信号实现。
本研究从类风湿性关节炎纤维样滑膜细胞异常活化角度,阐明了氯喹治疗类风湿性关节炎的药理机制。氯喹长时间大剂量的类风湿性关节炎治疗应用可诱发不良反应,尤其是眼毒性[22]。因此,阐明氯喹治疗类风湿性关节炎的药理机制,有助于指导临床联合用药,降低药物剂量,有利于降低不良反应的发生。
