神经节细胞复合体对糖尿病视网膜病变诊断的意义
2021-05-28沈培清李永蓉范玲玲
沈培清 李永蓉 范玲玲
1合肥市第二人民医院眼科(合肥230011);2安徽医科大学第一附属医院眼科(合肥230022)
糖尿病患病率快速上升且日趋年轻化,18岁及以上人群2型糖尿病患病率为10.4%[1],患病后可导致多器官系统并发症,影响患者生存质量[2],其中约1/3患者合并糖尿病视网膜病变(diabetic retinopathy,DR)[3],严重损害患者视力。治疗的关键是早期发现和干预[4]。DR的细胞病理学基础是细胞凋亡,在糖尿病早期出现视网膜微血管病变前,即存在神经退行性改变,其中视网膜神经节细胞最易受损[5⁃6],表现为视网膜神经纤维层、神经节细胞层及内丛状层厚度变化[7⁃8]。
频域光学相干断层成像扫描技术(spectral⁃domain optical coherence tomography,SD⁃OCT)可直观地分析视网膜组织结构的变化[9],具有良好的可重复性[10-11]。本研究使用SD⁃OCT对GCC厚度进行检测,GCC由神经纤维层、神经节细胞层及内丛状层构成,通过视网膜黄斑区GCC厚度检测,旨在明确早期糖尿病患者视网膜形态改变,为DR早期诊断寻找依据。
1 对象与方法
1.1 研究对象及分组本研究为回顾性病例分析,选取2018年3月至2020年6月在本院就诊的2型糖尿病患者83例(83眼)作为研究对象,其中男44例,女39例,年龄39~75岁,糖尿病病程5~15年。对入选患者,根据2002年国际眼科学会制定的DR分级标准进行分级,分为NDR组50例(50眼),其中男26例,女24例,年龄39~73(53.68±8.67)岁;轻中度NPDR组33例(33眼),其中男18例,女15例,年龄40~75(55.06±9.72)岁;对照组招募于本院眼科检查的无糖尿病健康者50例(50眼),其中男28例,女22例,年龄40~71(52.94±8.27)岁。本研究通过合肥市第二人民医院医学伦理委员会批准。
1.2 纳入排除标准纳入标准:(1)糖尿病患者符合糖尿病诊断标准且确诊后能常规接受药物控制血糖治疗;(2)三组观察对象均要求认知功能良好且无沟通交流障碍;(3)无明显心脑血管肝肾等疾病;(4)知晓本研究并签署知情同意书。排除标准:(1)恶性肿瘤患者;(2)传染性疾病患者;(3)屈光间质混浊、葡萄膜炎、青光眼、视网膜血管炎、视网膜静脉阻塞、年龄相关性黄斑变性、增殖性糖尿病视网膜病变等眼部病变患者;(4)有内眼手术史患者;(5)眼轴<22 mm或>25 mm患者。
1.3 方法
1.3.1 常规检查所有对象均常规进行裂隙灯显微镜、眼部A超、非接触眼压计等检查,并散瞳进行眼底检查,发现有视网膜内出血的DR患者再行荧光素眼底血管造影检查。
1.3.2 OCT扫描检查采用Spectralis SD⁃OCT(Heidelberg Engineering Gmbh,Heidelberg,Germany)后极部扫描模式进行扫描分析,调整扫描中心线,使之通过黄斑中心凹中心。检查参数:扫描光源波长870 nm,分辨率轴向5 μm,横向6 μm;扫描深度2 mm,最小扫描间距11 μm,扫描速度为40 000A⁃scon/s,扫描范围后极部8.8 mm×8.8 mm。检查由1名经验丰富的技术人员完成,被检者取坐姿下颌置于颌托上,双眼外眦角和支架刻度线对齐。扫描时嘱受检者盯住注视点,先对屈光不正进行补偿调整,成像清晰后开始获取图像。取得视网膜全层结构图像,再由仪器自带的分析软件根据早期糖尿病视网膜病变治疗研究(ETDRS)的定义,自动生成以黄斑中心凹为圆心的3个同心圆环,分别为直径≤1 mm的中央区、>1~3 mm的内环区和>3~6 mm的外环区,其中内环区及外环区又各有4条放射线将每个区分为上方(superior,S)、鼻侧(nasal,N)、下方(inferior,I)和颞侧(temporal,T)4个象限,共形成9个分区(ETDRS格栅,图1)。再利用系统自带的视网膜分层软件显示每个分区视网膜各分层的平均厚度。采集指标:中心凹区、内环区及外环区每个分区GCC厚度。
1.4 统计学方法采用SPSS 22.0统计软件进行统计学分析,性别分析采用卡方检验,先对样本计量资料进行正态分布和方差齐性检验,连续型变量符合正态分布数据以均数±标准差表示,三组间比较采用单因素方差分析,两组间比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况比较三组研究对象性别、年龄、眼轴、眼压等情况比较,组间差异无统计学意义(P>0.05),具有可比性(表1)。
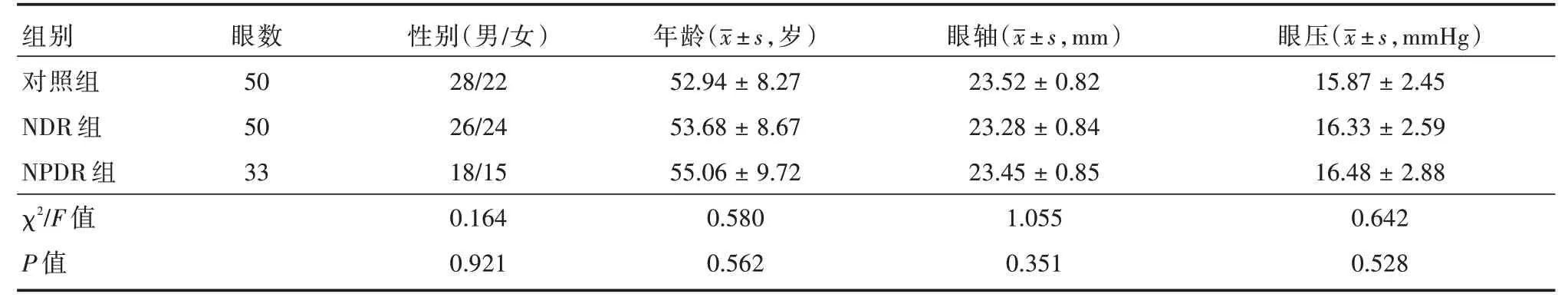
表1 三组观察对象性别、年龄、眼轴、眼压比较Tab.1 Comparison of gender,age,eye axis and intraocular pressure of the three groups
2.2 对照组与NDR组对应分区GCC厚度组间比较与对照组相比,NDR组S3、N3、S6、N6对应分区GCC厚度变薄,组间差异均具有统计学意义(P<0.05,表2)。
2.3 对照组与NPDR组对应分区GCC厚度组间比较与对照组相比,NPDR组S3、N3、S6、N6、I6对应分区GCC厚度变薄,组间差异均具有统计学意义(P<0.05,表3)。
2.4 NDR组与NPDR组对应分区GCC厚度组间比较与NDR组相比,NPDR组多个分区GCC厚度变薄,但两组间GCC厚度比较差异无统计学意义(P>0.05,表4)。
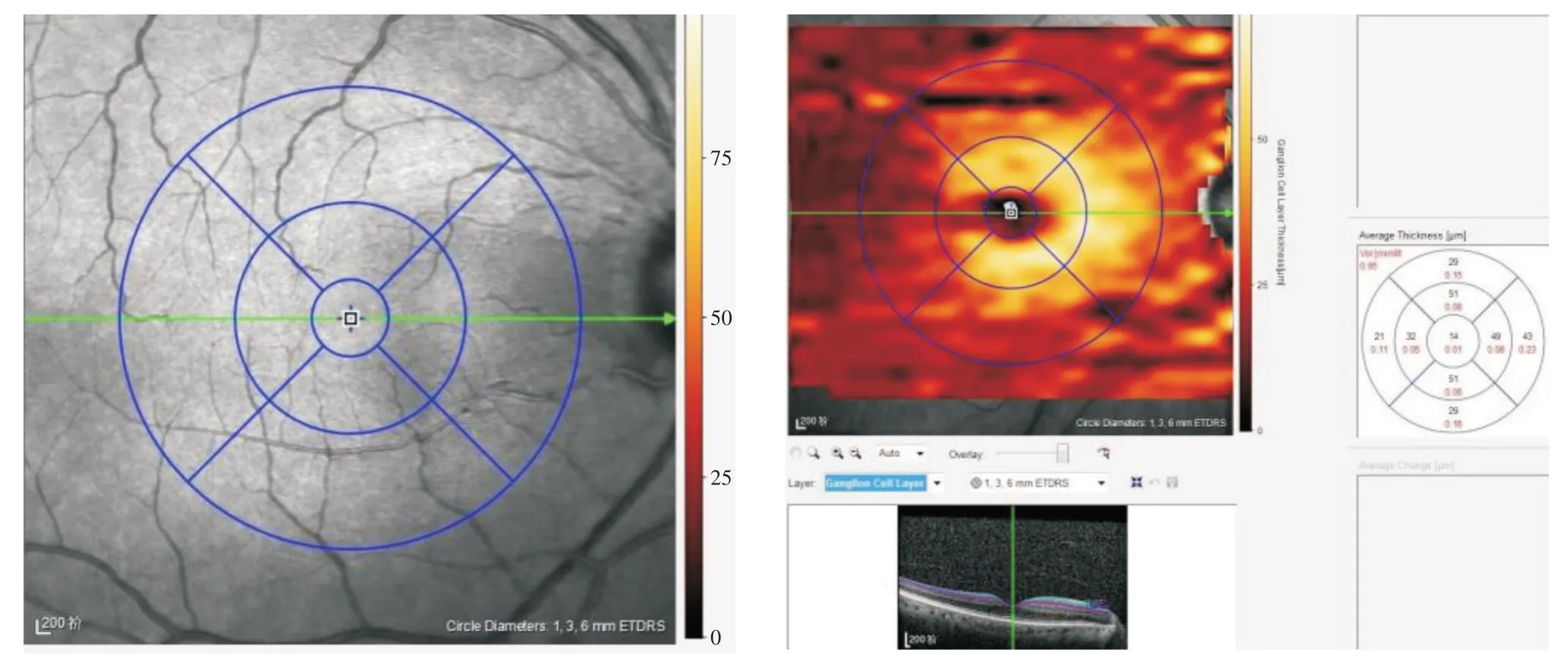
图1 视网膜全层结构图像Fig.1 Full⁃layer image of the retina
表2 正常对照组、NDR组各分区GCC平均厚度组间比较Tab.2 Comparison of GCC average thickness between normal control group and NDR group ±s,μm
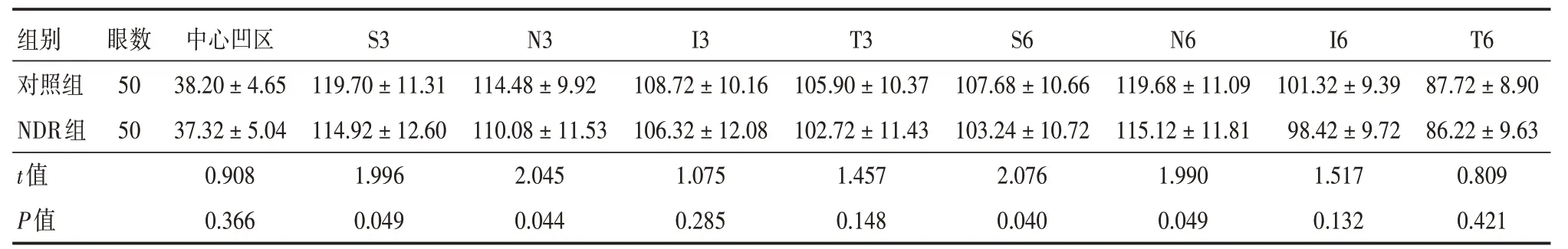
表2 正常对照组、NDR组各分区GCC平均厚度组间比较Tab.2 Comparison of GCC average thickness between normal control group and NDR group ±s,μm
注:S3,内环区上方;N3,内环区鼻侧;I3,内环区下方;T3,内环区颞侧;S6,外环区上方;N6,外环区鼻侧;I6,外环区下方;T6,外环区颞侧
组别对照组NDR组t值P值眼数50 50中心凹区38.20±4.65 37.32±5.04 0.908 0.366 S3 119.70±11.31 114.92±12.60 1.996 0.049 N3 114.48±9.92 110.08±11.53 2.045 0.044 I3 108.72±10.16 106.32±12.08 1.075 0.285 T3 105.90±10.37 102.72±11.43 1.457 0.148 S6 107.68±10.66 103.24±10.72 2.076 0.040 N6 119.68±11.09 115.12±11.81 1.990 0.049 I6 101.32±9.39 98.42±9.72 1.517 0.132 T6 87.72±8.90 86.22±9.63 0.809 0.421
表3 正常对照组、NPDR组各分区GCC平均厚度组间比较Tab.3 Comparison of GCC average thickness between normal control group and NPDR group ±s,μm
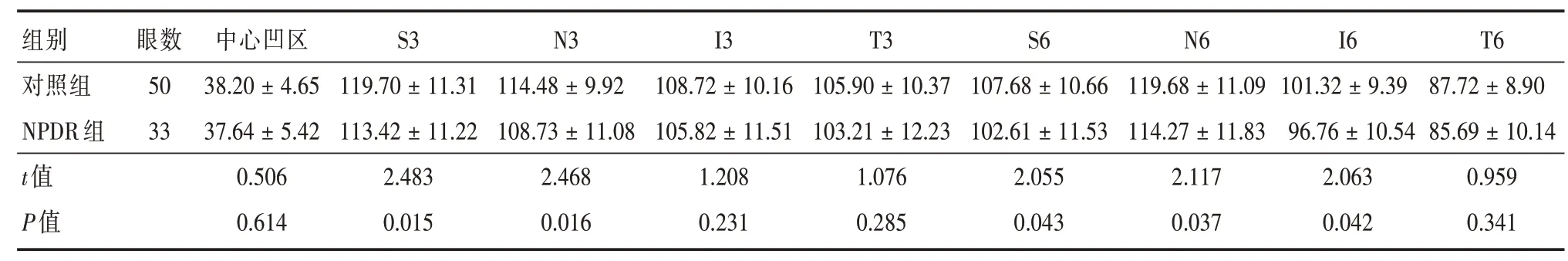
表3 正常对照组、NPDR组各分区GCC平均厚度组间比较Tab.3 Comparison of GCC average thickness between normal control group and NPDR group ±s,μm
组别对照组NPDR组t值P值眼数50 33中心凹区38.20±4.65 37.64±5.42 0.506 0.614 S3 119.70±11.31 113.42±11.22 2.483 0.015 N3 114.48±9.92 108.73±11.08 2.468 0.016 I3 108.72±10.16 105.82±11.51 1.208 0.231 T3 105.90±10.37 103.21±12.23 1.076 0.285 S6 107.68±10.66 102.61±11.53 2.055 0.043 N6 119.68±11.09 114.27±11.83 2.117 0.037 I6 101.32±9.39 96.76±10.54 2.063 0.042 T6 87.72±8.90 85.69±10.14 0.959 0.341
表4 NDR组、NPDR组各分区GCC平均厚度组间比较Tab.4 Comparison of GCC average thickness between NDR group and NPDR group ±s,μm
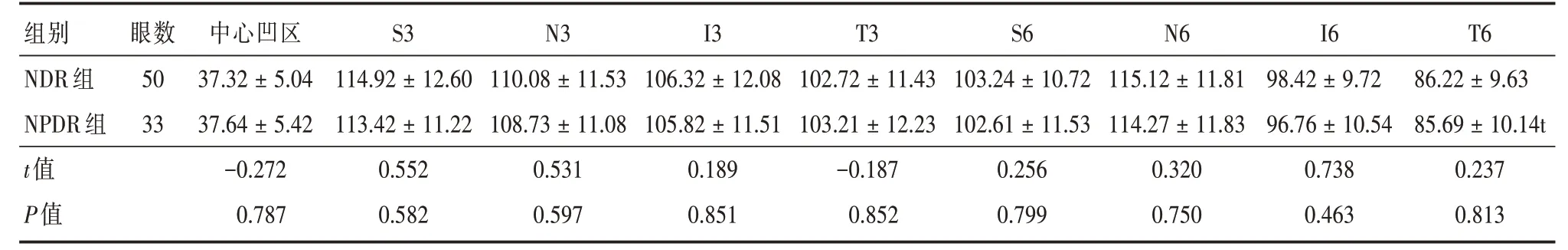
表4 NDR组、NPDR组各分区GCC平均厚度组间比较Tab.4 Comparison of GCC average thickness between NDR group and NPDR group ±s,μm
组别NDR组NPDR组t值P值眼数50 33中心凹区37.32±5.04 37.64±5.42-0.272 0.787 S3 114.92±12.60 113.42±11.22 0.552 0.582 N3 110.08±11.53 108.73±11.08 0.531 0.597 I3 106.32±12.08 105.82±11.51 0.189 0.851 T3 102.72±11.43 103.21±12.23-0.187 0.852 S6 103.24±10.72 102.61±11.53 0.256 0.799 N6 115.12±11.81 114.27±11.83 0.320 0.750 I6 98.42±9.72 96.76±10.54 0.738 0.463 T6 86.22±9.63 85.69±10.14t 0.237 0.813
3 讨论
DR是糖尿病常见的眼部并发症,年龄、糖尿病病程及血糖控制等多种因素与DR的发展和严重程度相关[12]。DR晚期可导致患者视力重度下降且难以逆转,因此早期诊断早期干预对预防患者视力减退非常重要。DR早期眼底检查可见微血管瘤、视网膜内出血或硬性渗出等,目前多以微血管的改变作为早期诊断标准,但在眼底出现可见的微血管病变之前,神经节细胞和神经胶质细胞已发生损害,导致早期糖尿病患者的视功能下降。有研究[13-14]提出,DR不仅是一种微血管疾病,也是一种神经退行性疾病,并认为视网膜神经细胞退化在糖尿病早期阶段即已存在。
本研究使用Spectralis SD⁃OCT对三组观察对象黄斑部GCC厚度进行检测,发现无DR的糖尿病患者黄斑部GCC厚度较对照组明显变薄,说明早期糖尿病患者已出现视网膜神经节细胞受损,我们在观察中注意到,GCC厚度变薄区域主要见于黄斑部上方及鼻侧。
目前认为糖尿病患者视网膜神经节细胞较早受到影响,通过OCT检测神经节细胞相应分层厚度变化,用于糖尿病视网膜病变早期诊断及病情评估已成为研究热点[15]。类似的实验及临床研究较多,HAMMES等[16]报道糖尿病模型建立后10周就出现视网膜神经节细胞及无长突细胞凋亡;ASCHAUER等[17]研究发现,糖尿病患者出现视网膜微血管病变前已经发生了神经节细胞的损害;另有研究[18-19]也证实了NDR患者神经节细胞层厚度下降。类似的研究还有:熊飞等[20]发现早期DR患者视盘旁神经纤维层变簿可能与视网膜神经节细胞凋亡导致的细胞数量减少有关。目前越来越多的研究表明神经细胞凋亡和视网膜神经退化在糖尿病早期阶段已经存在[21],并认为高血糖介导细胞氧化应激,视网膜内谷氨酸毒性水平增加,炎症反应以及神经营养因子的耗竭,均可导致视网膜神经节细胞的变性、凋亡,并启动DR的发生和发展。
SD⁃OCT分辨率高,信噪比高,视网膜神经纤维层在SD⁃OCT上呈高反射条带,主要由神经节细胞的轴突构成;神经节细胞层呈低反射条带,主要包含神经节细胞的胞体;内丛状层呈中高反射条带,对应的主要是神经节细胞的树突,三者易于区分,测量更加准确,SD⁃OCT显示视网膜的显微形态结构,犹如活体下视网膜组织病理学切片检查,对多数视网膜疾病具有较高的诊断价值,在视网膜疾病的诊断、治疗及随访观察中至关重要[22]。本研究所使用的Spectralis SD⁃OCT在视网膜检测中可自动划区、自动分层,为许多视网膜疾病的诊断提供了重要而详细的量化信息。
神经节细胞在视网膜黄斑部可有7~10层,而周围视网膜大部分区域只有1层[23]。因此神经节细胞变化在黄斑部表现更加明显,使用SD⁃OCT记录黄斑部神经纤维层、神经节细胞层、内丛状层厚度,对三组观察对象GCC厚度进行比较,发现NDR组中已经有部分分区GCC厚度明显变薄,说明糖尿病患者在出现DR临床可见病变前已经有神经节细胞的丢失。
本研究中考虑了各组观察对象性别、年龄等的一致并排除了一些全身及眼部疾病的影响,但本研究样本量有限,存在一定的局限性,需要进一步的实验及临床研究加以完善。通过本研究,认为应用OCT定期检测糖尿病患者黄斑部GCC厚度,通过随访观察GCC厚度变化,可对糖尿病人群视网膜病变的发生发展进行评估。
