miR-486-3p通过直接靶向BIK调控结直肠癌细胞增殖、凋亡、迁移和侵袭①
2021-05-27刘义冰河北医科大学第四医院肿瘤内科石家庄050011
冯 莉 刘 妍 荆 丽 韩 晶 张 雪 刘义冰(河北医科大学第四医院肿瘤内科,石家庄 050011)
近年我国结直肠癌发病率呈上升趋势,位居恶性肿瘤第3,经济发达地区发病率更高[1-2]。随治疗手段改善,系统的规范化诊疗使结直肠癌患者死亡率明显下降,但仍有约50%患者在结直肠癌根治术后不久发生延期肝转移。目前关于结直肠癌发生、发展、侵袭及转移的分子生物学机制尚未明确,一般认为其恶性生物学行为是涉及多基因、多步骤的调控过程[3-4]。细胞凋亡通路障碍是肿瘤发生发展过程中最重要的分子事件,诱导肿瘤细胞凋亡成为肿瘤治疗的思路之一。Bcl-2家族是细胞凋亡的关键调节因子,Bcl-2相互作用杀伤蛋白(Bcl-2 inter‑acting killer,BIK)是其中一种重要的促凋亡蛋白,作为BH3家族促凋亡蛋白的创始成员,通过线粒体途径诱导细胞凋亡[5]。BIK可结合的Bcl-2家族凋亡抑制蛋白最多,且与Bcl-2及Mcl-1的结合力最强[6]。随死亡信号刺激,BIK磷酸化后可与凋亡抑制蛋白相互作用,自主表达时强效杀伤细胞,提示BIK可能是细胞和病毒抗凋亡蛋白的重要靶点。miRNA是一类由19~25个核苷酸组成的内源性非编码RNA,可与mRNA互补片段结合导致mRNA降解或抑制其翻译调节基因表达,发挥细胞增殖分化及凋亡调节、影响细胞自我更新、诱导上皮细胞间质转化等作用[7]。miR-486-3p是新发现的miRNA,目前在结直肠癌中的研究较少,miR-486-3p对结直肠癌细胞的调控作用是否与BIK相关鲜有报道。本文研究miR-486-3p表达对结直肠癌细胞的调控作用并探讨其作用机制,从分子机制水平为结直肠癌治疗提供新策略。
1 材料与方法
1.1 材料
1.1.1 细胞株 结直肠癌细胞株SW620和正常结肠细胞系NCM-460购自美国模式菌种收集中心。
1.1.2 主要试剂DMEM培养基、胎牛血清、青霉素、链霉素、胰酶、Lipofectamine2000转染试剂、Trizol试剂购自美国Invitrogen Gibco公司;miR-486-3p模拟物(miR-486-3p mimics)、miR-486-3p抑制剂(miR-486-3p inhibitor)和阴性对照(NC)购自上海吉玛制药技术有限公司;定点突变试剂盒购自美国Agilent公司;双荧光素酶试验系统购自美国Pro‑mega公司;BIK siRNA、辣根过氧化物酶标记的二抗由美国Santa Cruz公司合成和化学修饰;MTT试剂、细胞色素C(Cytochrome C,Cyt C)一抗、半胱天冬酶-9(Caspase-9)一抗、半胱天冬酶-3(Caspase-3)一抗、GAPDH一抗、RIPA裂解液和BCA蛋白分析试剂盒购自上海碧云天公司;Transwell小室购自美国Costar公司;结晶紫购自美国Sigma公司;Annexin VFITC/PI试剂盒购自南京凯基生物科技有限公司;PrimeScriptTM逆转录试剂盒、SYBR®Premix Ex TaqTMⅡ购自日本TaKaRa公司;BIK一抗、APAF1一抗、p-Erk1/2一抗、Erk1/2一抗购自美国Abam公司;Su‑per SignalTM化学发光底物购自美国Thermo Scientific公司。
1.1.3 主要仪器-80℃冰箱购自日本SANYO公司;CO2恒温培养箱购自美国Precision公司;Syner‑gyTM2酶标仪购自美国Bio-Tek公司;5430R型低温离心机购自德国Eppendorf公司;FACSAria flow流式细胞仪购自美国BD Biosciences公司;凝胶扫描分析系统购自英国Syngene公司;Step One PlusTMrealtime PCR System购自美国Applied Biosystems公司;Western blot电泳和转膜系统、ChemiDoc成像系统购自美国BIO-RAD公司。
1.2 方法
1.2.1 RT-PCR和Western blot检测SW620细胞和NCM-460细胞miR-486-3p和BIK表达 从液氮中取出冻存细胞株,迅速复苏后转入培养瓶,采用DMEM培养(含10%胎牛血清)于37℃、5%CO2培养箱中培养,每24 h更换1次培养液,当细胞生长至对数生长期时用0.25%胰酶进行消化、传代,取第3~4代对数期细胞用于后续实验。采用RT-PCR测定SW620细胞和NCM-460细 胞miR-486-3p和BIK mRNA表达,Western blot法测定SW620细胞和NCM-460细胞BIK蛋白表达。
1.2.2 荧光素酶报告试验 从人cDNA中扩增BIK 3'-UTR序列,将BIK的野生型和突变3'-UTR区域克隆至pGL3 XbaⅠ位点,采用定点突变试剂盒对BIK 3'-UTR中的miR-486-3p靶位点进行位点定向突变。在转染前将细胞接种于24孔板培养14~16 h,3'-UTR质粒在SW620细胞中采用Lipofectamine2000转染试剂共转染,转染后24 h采用双荧光素酶试验系统进行报告试验,将相对Renilla荧光素酶活性归一化为萤火虫荧光素酶活性作为转染效率的内参。
1.2.3 细胞分组和转染 将SW620细胞分为阴性对照组(NC)、miR-486-3p mimics组、miR-486-3p in‑hibitor组和BIK siRNA组,各组SW620细胞采用Li‑pofectamine2000分别转染生理盐水、miR-486-3p mimics、miR-486-3p inhibitor和BIK siRNA,用于后续实验。
1.2.4 MTT检测细胞增殖 各组细胞转染24 h,1.0×105个/孔接种于6孔板,采用DMEM培养基(含10%胎牛血清)于37℃、5% CO2培养24 h、48 h和72 h,20µl/孔加入MTT溶液(5 mg/ml)培养4 h,弃上清,150µl/孔加入DMSO,振荡15 min,全自动酶标仪测定450 nm处吸光度(A)。
1.2.5 细胞划痕实验检测细胞迁移 各组细胞转染24 h,1.0×105个/孔接种于6孔板,DMEM培养基(含10%胎牛血清)培养至细胞铺满单层,20µl移液枪头沿培养板底部垂直划线,PBS冲洗3次去除细胞碎片,更换DMEM培养基(含10%胎牛血清),37℃、5%CO2继续培养12 h,拍照,测量划痕间距。
1.2.6 Transwell实验检测细胞侵袭 各组细胞转染24 h,1.0×105个/ml加入Transwell小室上室,放入含DMEM培养基(含10%胎牛血清)的细胞培养板孔(下室),37℃、5%CO2培养24 h,采用棉签将上室内非迁移细胞刮除,小室底部迁移细胞用4%多聚甲醛固定,0.2%结晶紫染色,双蒸水冲洗上室,相差显微镜下随机选择5个视野拍照、计数。
1.2.7 流失细胞术检测细胞凋亡 各组细胞转染24 h,更换为DMEM培养基(含10%胎牛血清),37℃、5%CO2培养至48 h,PBS洗涤2次,3 000 r/min离心2 min,去上清,预冷结合缓冲液重悬细胞,加入An‑nexin V-FITC/PI混匀,4℃避光培养15 min,加入10µl PI(4µg/ml,含RNA酶),避光室温孵育15 min,FACSAria流式细胞仪检测,FlowJo软件分析。
1.2.8 q-PCR检测mRNA表达 各组细胞转染24 h,更换为DMEM培养基(含10%胎牛血清),37℃、5% CO2培养至48 h,Trizol试剂提取总RNA,异丙醇法浓缩RNA,全自动酶标仪测定总RNA纯度,控制A260/A280为1.9~2.1,RNA电泳检测完整性。检测浓度及纯度后取2µg总RNA采用逆转录试剂盒合成第一链cDNA。逆转录条件:37℃15 min,85℃5 s。逆转录所得cDNA纯化后采用Step One PlusTMreal-time PCR System进行PCR扩增,反应总体积为20µl:1.5µl cDNA模板,1µl引物,10µl SYBR®Premix Ex TaqTMⅡ,7.5µl H2O。PCR反应条件为:95℃预变性30 s,扩增循环95℃5 s,60℃34 s,共40个 循 环。以GAPDH为 内 参,2-ΔΔCt法 计 算mRNA相对表达量。
1.2.9 Western blot检测蛋白表达 各组细胞转染24 h,更换为含10µmol/ml Flu的RPMI1640培养液37℃、5%CO2培养至48 h,收获各组细胞,RIPA裂解液裂解各组细胞,离心,BCA法测定蛋白浓度。蛋白变性后按20µg/孔进行10%SDS-PAGE凝胶电泳(90 V 30 min,120 V 1 h),湿转至PVDF膜(400 mA 2 h),5%BSA封闭1 h,TBST缓冲液洗膜,分别加入BIK、APAF1、p-Erk1/2、Erk1/2、Cyt C、Caspase-9、Caspase-3和GAPDH一抗后4℃过夜,TBST缓冲液充分洗膜,加入辣根过氧化物酶标记的二抗室温孵育1 h,TBST缓冲液充分洗膜30 min,SuperSignalTM化学发光试剂盒显色,显影,测定各组细胞目标蛋白表达,与β-actin为内参。
1.3 统计学分析 采用GraphPad Prer软件进行统计学分析,结果以±s表示,组间比较采用t检验或单向ANOVA分析,P<0.05表示差异有统计学意义。
2 结果
2.1 结直肠癌细胞和正常结直肠细胞miR-486-3p和BIK表达 结直肠癌细胞miR-486-3p表达水平较正常结直肠细胞(NCM-460)显著增加(图1A),BIK mRNA和蛋白水平均较正常结直肠细胞显著降低(图1B~D),提示miR-486-3p表达上调可能与结直肠癌细胞BIK表达下调有关。
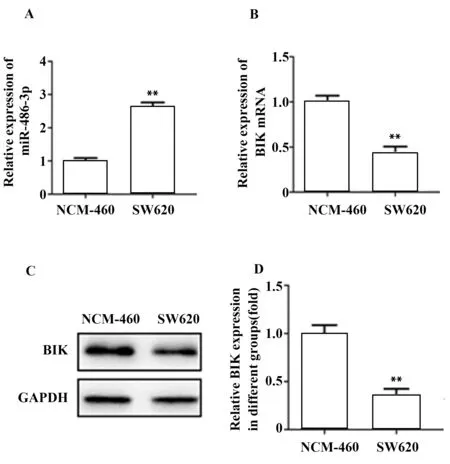
图1 结直肠癌细胞和正常结直肠细胞miR-486-3p和BIK表达Fig.1 miR-486-3p and BIK expressions in colorectal can-cer cells and normal colorectal cells
2.2 双荧光素酶报告试验 采用Targetscan和miR‑Walk进行生物信息学分析结果显示,BIK的3'-UTR存在与miR-486-3p种子序列匹配的区域(图2A)。双荧光素酶报告试验显示,miR-486-3p显著降低结直肠癌细胞BIK 3'-UTR荧光素酶活性(P<0.05),但不降低BIK 3'-UTR的突变序列(图2B),表明BIK 3'-UTR是miR-486-3p的直接靶标。转染miR-486-3p抑制剂导致BIK mRNA和蛋白表达显著升高,而转染miR-486-3p模拟导致BIK mRNA和蛋白表达显著下调(图2C、D),与转染BIK siRNA结果一致。

图2 双荧光素酶报告试验结果Fig.2 Dual luciferase reporter test
2.3 miR-486-3p对结肠癌细胞增殖的影响 与NC组相比,miR-486-3p抑制剂组24 h、48 h和72 h结肠癌细胞光密度显著降低(P<0.05或P<0.01),而miR-486-3p模拟剂组和BIK siRNA组显著增加(P<0.05或P<0.01,图3),提示miR-486-3p在结肠癌细胞增殖中发挥致癌基因作用。

图3 miR-486-3p对结直肠癌细胞增殖的影响Fig.3 Effect of miR-486-3p on proliferation of colorectal cancer cells
2.4 miR-486-3p对结肠癌细胞迁移的影响 与NC组相比,miR-486-3p抑制剂组细胞划痕宽度显著增加(P<0.01),而miR-486-3p模拟剂组和BIK siRNA组细胞划痕宽度显著降低(P<0.05,图4),提示miR-486-3p可促进结肠癌细胞迁移。
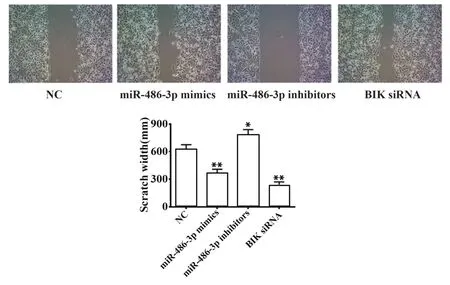
图4 miR-486-3p对结直肠癌细胞迁移的影响Fig.4 Effect of miR-486-3p on migration of colorectal cancer cells
2.5 miR-486-3p对结肠癌细胞侵袭的影响 与NC组相比,miR-486-3p抑制剂组穿膜细胞数显著减少(P<0.01),而miR-486-3p模拟剂组和BIK siRNA组穿膜细胞数显著增加(P<0.05,图5),提示miR-486-3p可促进结肠癌细胞迁移。
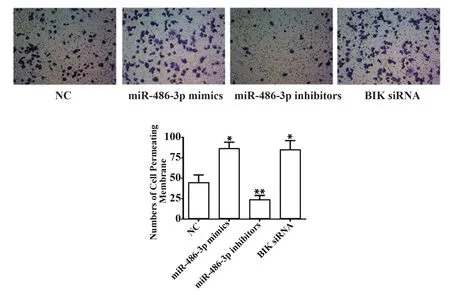
图5 miR-486-3p对结直肠癌细胞侵袭的影响Fig.5 Effect of miR-486-3p on invasion of colorectal can-cer cells
2.6 miR-486-3p对结肠癌细胞凋亡的影响 与NC组相比,miR-486-3p抑制剂组凋亡细胞数显著增加(P<0.01),而miR-486-3p模拟剂组和BIK siRNA组凋亡细胞数显著减少(P<0.01,图6),提示miR-486-3p可抑制结肠癌细胞凋亡。
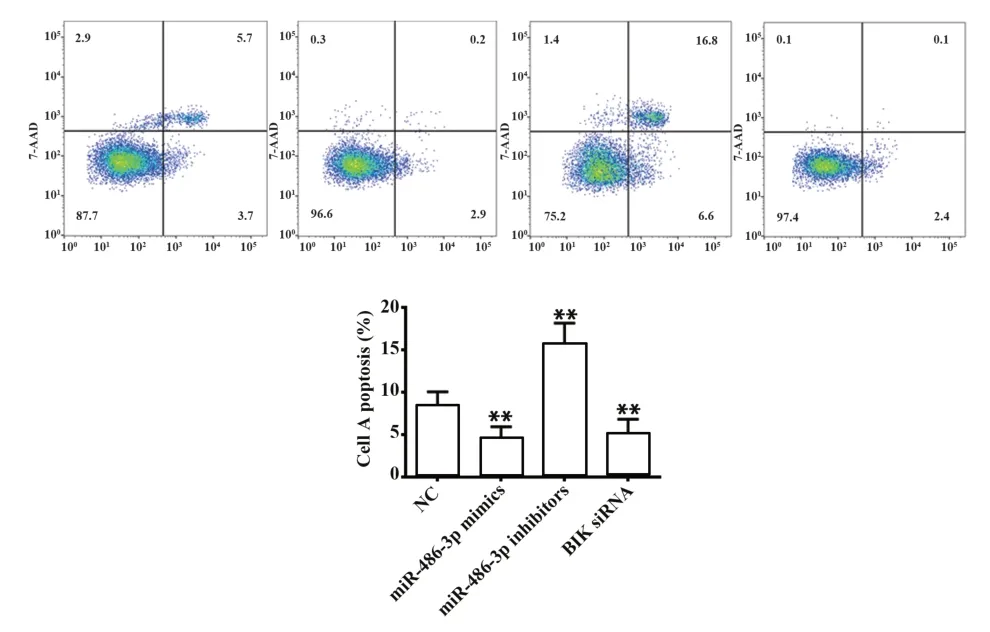
图6 miR-486-3p对结直肠癌细胞凋亡的影响Fig.6 Effect of miR-486-3p on apoptosis of colorectal can-cer cells
2.7 miR-486-3p对结直肠癌细胞线粒体凋亡通路蛋白表达的影响 与NC组相比,miR-486-3p抑制剂组Cyt C、APAF1、Caspase-9和Caspase-3蛋白表达显著增加,p-Erk1/2蛋白表达显著降低(P<0.01);miR-486-3p模拟组和BIK siRNA组Cyt C、APAF1、Caspase-9和Caspase-3蛋白表达显著降低,p-ERK1/2蛋白表达显著增加(P<0.01);4组细胞Erk1/2表达差异无统计学意义(P>0.05,图7),提示miR-486-3p可能通过调节线粒体凋亡通路在结直肠癌发生和发展中发挥致癌基因作用。
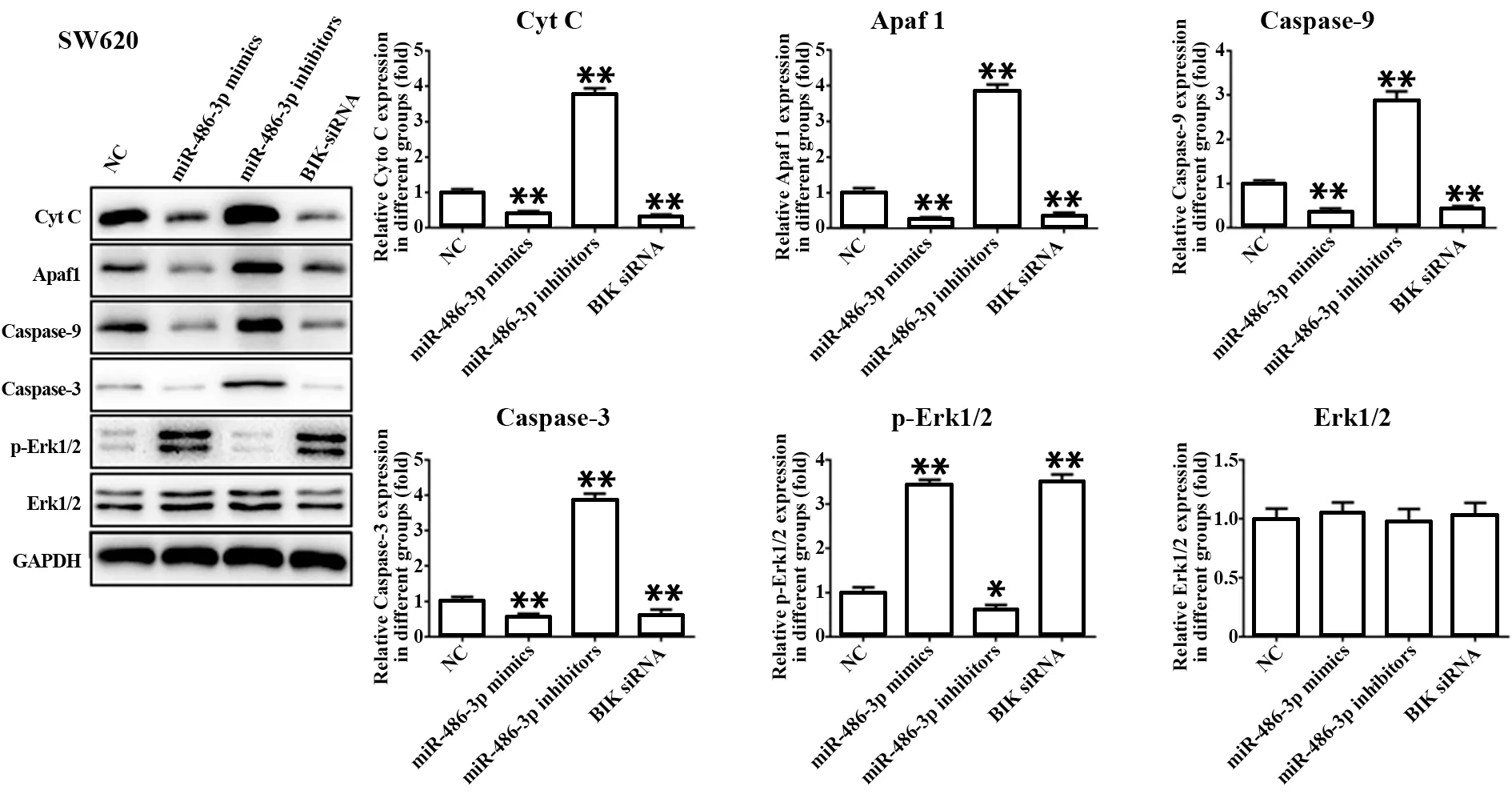
图7 miR-486-3p对结直肠癌细胞线粒体凋亡通路蛋白表达的影响Fig.7 Effect of miR-486-3p on expressions of mitochon-drial apoptosis pathway proteins in colorectal can-cer cells
3 讨论
全球每年结肠癌平均新发病例超过120万例,病死率约50%[8]。外科手术技术的发展及化疗药物的应用使结直肠癌疗效显著提高,但其发病率仍位居恶性肿瘤第3,仅次于肺癌和乳腺癌,是肿瘤相关死亡的第4大病因。我国近年结直肠癌发病率及死亡率呈上升趋势,2015年我国结直肠癌预测发病率、死亡率分别为376.3/10万、191.0/10万,严重威胁人们生命健康[2]。手术治疗在结直肠癌治疗中占据主要地位,但多数患者仍会出现局部或全身转移,并对传统化疗方案耐药[9]。最新研究表明,术前放化疗根治性手术是治疗局部进展性结直肠癌的有效方法,但仍有约40%患者疗效较差[10]。
miRNA是一类广泛存在于真核细胞中的内源性非编码小RNA,参与机体多种生理过程调控,如生长发育、造血功能、细胞增殖与凋亡、器官形成、脂肪代谢等,目前人类有10%~30%基因受miRNA调节,miRNA可发挥原癌基因作用,也可发挥抑癌基因作用[11]。miRNAs可有效沉默靶基因并参与一系列基因调节过程,有利于癌症作为一种异质性疾病治疗[12]。miR-519b是一类包括miR-519a、miR-519b和miR-519c 3个miRNA的家族,目前关于miR-519b的研究鲜有报道。乳头状甲状腺癌组织中miR-486-3p表达显著升高[13];而在喉癌组织中miR-519b-3p表达明显低于癌旁组织,且miR-519b-3p类似物可显著抑制喉部生长鳞状Hep-2细胞增殖[14]。YE等[15]研究发现,miR-486-3p可直接靶向ECM1而抑制宫颈癌细胞增殖和转移。研究显示,miR-519b-3p表达与局部进展性结直肠癌患者对术前放化疗根治性手术的反应性相关,miR-519b-3p在对术前放化疗根治性手术样品相应的标本中呈高表达,miR-519b-3p以ARID4B依赖的方式直接参与直肠癌患者对术前放化疗根治性手术的反应[16]。本研究显示,结直肠癌细胞SW620 miR-486-3p表达较正常结直肠细胞NCM-460显著增加(P<0.05),miR-486-3p抑制剂组细胞增殖、增殖、凋亡、迁移和侵袭均较正常对照组显著降低,而miR-486-3p模拟剂组细胞增殖、增殖、凋亡、迁移和侵袭均较正常对照组显著增加,提示miR-486-3p是结直肠癌的致癌基因。
细胞凋亡是由基因控制的自主性有序性死亡,维护内环境稳定、调节生长发育,凋亡失衡可能导致肿瘤及神经退行性疾病。线粒体是细胞凋亡的主要发起者和执行者,主要由Bcl-2家族成员调节。Bcl-2家族成员在细胞凋亡调节中发挥关键作用,由促凋亡和抗凋亡成员组成,其共同特点是均含有BH3结构域。BIK是一种仅含有BH3结构域的促凋亡蛋白,其活性受Thr33和Thr35磷酸化程度调节。伴随死亡信号刺激,BIK磷酸化后可与抗凋亡蛋白结合,促使其他促凋亡蛋白直接激活Bax,Bax移位至线粒体并形成同源二聚体通道,促进Cyt C释放,导致Caspase蛋白激活和细胞凋亡[6]。3'-UTR克隆可用于miRNA靶标验证、预测靶标功能验证和miR‑NA对靶标调控作用的研究。miRNA通过靶向mRNA 3'-UTR导致mRNA降解或抑制其翻译调节基因表达[17]。BIK 3′-UTR包含与miR-486-3p种子序列匹配的区域,双荧光素酶报告试验显示miR-486-3p显著降低结直肠癌细胞中BIK 3′-UTR荧光素酶活性,但不降低BIK 3′-UTR突变序列,表明BIK 3′-UTR是miR-486-3p的直接靶标。miR-486-3p模拟剂组和BIK siRNA组细胞增殖、增殖、凋亡、迁移和侵袭较正常对照组显著增加,进一步说明miR-486-3p通过BIK直接发挥对结直肠癌细胞增殖、增殖、凋亡、迁移和侵袭的调节作用。
研究发现,肿瘤细胞中存在细胞凋亡调节失调和细胞死亡基因调控异常,线粒体凋亡通路是细胞凋亡最重要和研究最为深入的途径之一,细胞受凋亡刺激后Cyt C从线粒体内释出是线粒体步入凋亡途径的标志。Cyt C释放至胞浆导致APAF1活化,诱导凋亡的半胱天冬酶活化[18]。本研究发现,miR-486-3p表达上调可显著抑制Cyt C、APAF1、Caspase-9和Caspase-3表达,增加p-ERK1/2表达,揭示miR-486-3p调节结直肠癌细胞增殖、凋亡、迁移和侵袭的分子机制。
