铜绿假单胞菌群体感应代谢产物通过细胞表面脂质结构域溶解诱导宿主淋巴细胞死亡的机制
2021-05-27祝司霞攀枝花学院医学院病原生物与免疫学教研室攀枝花617000
祝司霞(攀枝花学院医学院病原生物与免疫学教研室,攀枝花 617000)
群体感应是原核生物基于化学物质的交流机制[1]。基本模式下,社区中其他成员的胞内受体可感应出部分个体释放的自体诱导剂,从而导致集体等基因自体诱导剂合成和同步活动,对于与宿主共生、毒力和社区生物膜形成具有重要意义[2-3]。铜绿假单胞菌是急性医院感染的最常见病原体之一,尤其影响免疫功能低下的个体或重症监护病房患者[4]。铜绿假单胞菌引起的感染包括呼吸机相关性肺炎、烧伤创面和手术部位感染及尿路感染,与患者高死亡率(>30%)密切相关[5]。铜绿假单胞菌还可引发囊性纤维化、慢性阻塞性肺疾病或支气管扩张患者慢性呼吸道感染[6]。铜绿假单胞菌具有2个群体感应电路:lasR-lasI及RhlR-RhlI,前者采用N-(3-氧代十二烷基)高丝氨酸内酯(3OC12 HSL或3oc)作为自动诱导剂,后者采用C4(丁酰基)HSL4[7-8]。3oc是研究最多的群体感应自动诱导剂,在哺乳动物宿主中具有重要作用[9]。3oc及类酰基链长度类似物可与膜型和活细胞双层膜相互作用[10]。高浓度3oc可破坏质膜偶极电位,影响受体配体结合[11]。但低浓度3oc(5µmol/L)可明显调节T淋巴细胞、嗜中性粒细胞和巨噬细胞活性[12]。本文将探讨铜绿假单胞菌群体感应代谢产物通过细胞表面脂质结构域溶解诱导宿主淋巴细胞凋亡的机制。
1 材料与方法
1.1 材料
1.1.1 实验动物SPF级C57BL/6野生型小鼠购自重庆医科大学动物中心,8~10周龄时,感染铜绿假单胞菌,并进行3oc治疗。感染前3 d给予无菌水代替3oc治疗,另一组持续给予3oc治疗直到实验结束。性别、年龄相匹配的常规定植小鼠作为未经3oc治疗的对照组。所有实验程序经动物保护和使用委员会批准,并根据《实验动物护理和使用指南》进行实验。
1.1.2 主要试剂与仪器 铜绿假单胞菌培养物上清(碧云天生物试剂公司);V-FITC和PI(英国Ab‑cam公司);SYBR greenⅠMaster Mix试剂盒(赛默飞世尔);山羊抗小鼠抗体(美国Invitrogen公司);兔抗caspase-3、兔抗caspase-9抗体(D35G2,美国Bio Legend公司);流式细胞仪(美国贝克曼库尔特有限公司);Real-Time PCR System(应用生物系统公司)。
1.2 方法
1.2.1 铜绿假单胞菌菌株处理MDR铜绿假单胞菌分离株由1例医院内肺炎患者的呼吸道材料培养而成,感染前,将铜绿假单胞菌置于37℃有氧气氛中的cetrimid琼脂(Oxoid)上培养24 h。
1.2.2 AnnexinV/PI凋亡检测法检测细胞凋亡HSL刺激细胞或不作处理,6 h后收集细胞,室温下采用膜联蛋白V-FITC和PI染色15 min,流式细胞术检测细胞凋亡情况。铜绿假单胞菌共培养试验中,分离C57BL/6小鼠骨髓淋巴细胞,并与WT型、lasI缺陷型或lasR缺陷型铜绿假单胞菌培养上清共同孵育6 h,显微镜下进行淋巴细胞计数。
1.2.3 免疫共沉淀和Western blot检测蛋白表达免疫沉淀4µg山羊抗小鼠抗体与100µl蛋白A/G琼脂糖室温孵育2 h,HSL处理脾细胞(3×106个/ml)或不进行治疗,收集细胞,免疫沉淀裂解缓冲液(50 mmol/L HEPES,pH=7.0,150 mmol/L NaCl,1%NP-,1 mmol/L EDTA,1 mmol/L苯基甲基磺酰氟,1 mmol/L NaF,1 mmol/L NaVO3和蛋白酶抑制剂混合物)裂解,4℃下加入抗体-珠子混合物反应3 h,低速离心(1 000 g,5 min)收集珠子,免疫沉淀裂解缓冲液(添加300 mmol/L NaCl)洗涤4次,最后1次洗涤后将沉淀物采用70µl 2×SDS上样缓冲液悬浮并煮沸5 min,兔抗caspase-3和兔抗caspase-9抗体(D35G2)检测caspase-3和caspase-9表达。HSL处理THP-1细胞(3×106个/ml)或不做处理。交联测定:HSL刺激或不处理从C57BL/6小鼠脾脏或人THP-1细胞分离的CD4+T细胞,收集细胞,室温下采用10 mmol/L DTSSP交联30 min,1 mol/L Tris-HCl(pH=7.5)淬灭15 min,采用来自Bytotime Bio‑technology的RIPA缓冲液(50 mmol/L Tris,pH=7.4,150 mmol/L NaCl,1%Triton X-100,1%脱氧胆酸钠,0.1%SDS,1 mmol/L EDTA,1 mmol/L苯甲基磺酰氟,1 mmol/L NaF,1 mmol/L NaVO3和蛋白酶抑制剂混合物)与非还原SDS上样缓冲液混合,如前所述分离脂筏。将THP-1细胞在MN缓冲液[25 mmol/L 2-(Nmorpholino)乙磺酸 和150 mmol/L NaCl,pH=6.5]中的1 ml 1%Triton X-100于冰上溶解20 min。将细胞裂解液用松散的dounce匀浆器匀浆10次,4℃下500 g离心7 min。上清7 000 g离心12 min,4℃下100 000 g离心50 min,记为DIG分数。所有样品与3×SDS上样缓冲液混合并煮沸5 min后进行Western blot分析。
1.2.4 RT-qPCR检测mRNA表达 采用RVana miRNA分离试剂盒提取总RNA,TRIzol试剂分离RNA,采用Script逆转录试剂盒进行RT反应,反应条件:42℃60 min,85℃5 min。SYBR greenⅠMaster Mix试剂盒采用7300 Real-Time PCR System进行实时PCR反应,反应条件:95℃变性3 min,45个PCR周期(95℃15 s,60℃20 s),2-ΔΔCt法计算IL-1和IL-6相对表达,β-actin为内参,引物序列见表1。

表1 RT-PCR引物序列Tab.1 RT-PCR primer sequences
1.3 统计学分析 采用SPSS17.0软件和Graph Pad Prism软件进行统计学分析,实验至少重复3次,数据以±s表示,多组间检验采用t检验或单因素方差分析,χ检验或Fisher精确检验计算Ftx表达和临床病理学变量,Kaplan-Meier法建立生存曲线,并采用对数秩检验进行比较,P<0.05为差异具有统计学意义。
2 结果
2.1 3oc剂量依赖性降低细胞活性AnnexinV/PI凋亡检测法检测T细胞凋亡结果显示,10、20和50µmol/L 3oc可促进T细胞凋亡,且呈剂量依赖性(P<0.05,图1、表2)。

图1 AnnexinV/PI法检测细胞凋亡情况Fig.1 Annexin V/PI detected cell apoptosis
表2 3oc对T细胞活化的影响(±s,%)Tab.2 Effect of 3oc on T cell activation(±s,%)
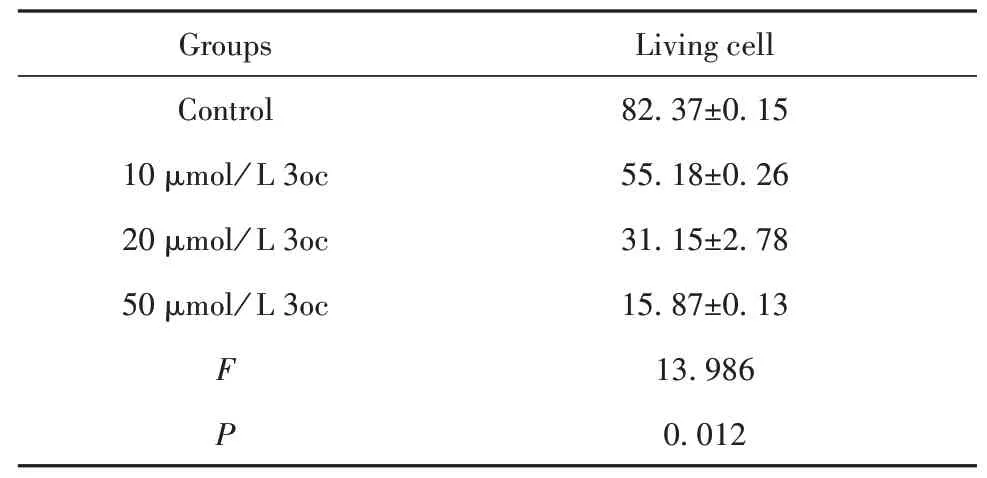
表2 3oc对T细胞活化的影响(±s,%)Tab.2 Effect of 3oc on T cell activation(±s,%)
Groups Control 10µmol/L 3oc 20µmol/L 3oc 50µmol/L 3oc F P Living cell 82.37±0.15 55.18±0.26 31.15±2.78 15.87±0.13 13.986 0.012
2.2 凋亡相关蛋白活性检测 与对照组相比,3oc处理的CD4 T细胞中caspase-3和caspase-9蛋白活性降低,Cld caspase-3和Cld caspase-9蛋白活性增强(P<0.05),3oc浓度与caspase-3和caspase-9表达呈负相关,与Cld caspase-3和Cld caspase-9表达呈正相关(P<0.05,图2、表3)。
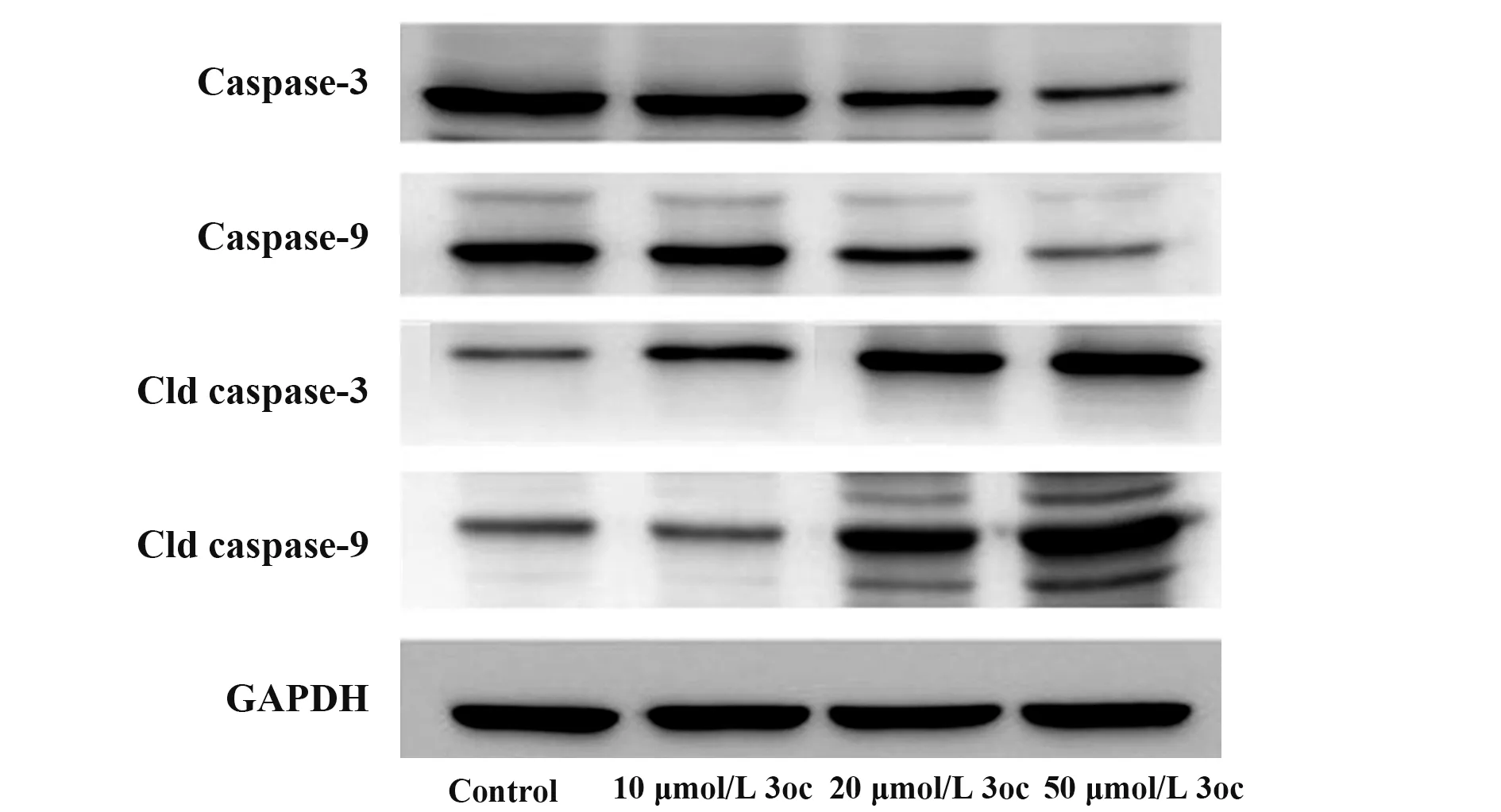
图2 Western blot检测凋亡相关蛋白表达Fig.2 Expressions of apoptosis related proteins by Western blot
表3 凋亡相关蛋白表达(±s)Tab.3 Expressions of apoptosis related proteins(±s)

表3 凋亡相关蛋白表达(±s)Tab.3 Expressions of apoptosis related proteins(±s)
Groups Control 10µmol/L 3oc 20µmol/L 3oc 50µmol/L 3oc F P caspase-3 1.13±0.12 0.78±0.13 0.47±0.06 0.15±0.03 12.342 0.013 caspase-9 3.37±0.31 2.58±0.15 1.74±0.13 1.05±0.12 25.187 0.017 Cld caspase-3 0.28±0.06 0.54±0.13 1.27±0.18 2.15±0.19 13.946 0.018 Cld caspase-9 0.05±0.01 0.27±0.11 0.68±0.19 1.39±0.16 14.128 0.012
2.3 RT-qPCR检测炎症因子IL-1和IL-6 mRNA表达 与对照组相比,3oc处理的IL-1和IL-6 mRNA表达增加,且呈剂量依赖性(P<0.05,表4)。
表4 IL-1和IL-6 mRNA表达(±s)Tab.4 Expressions of IL-1 and IL-6 mRNA(±s)
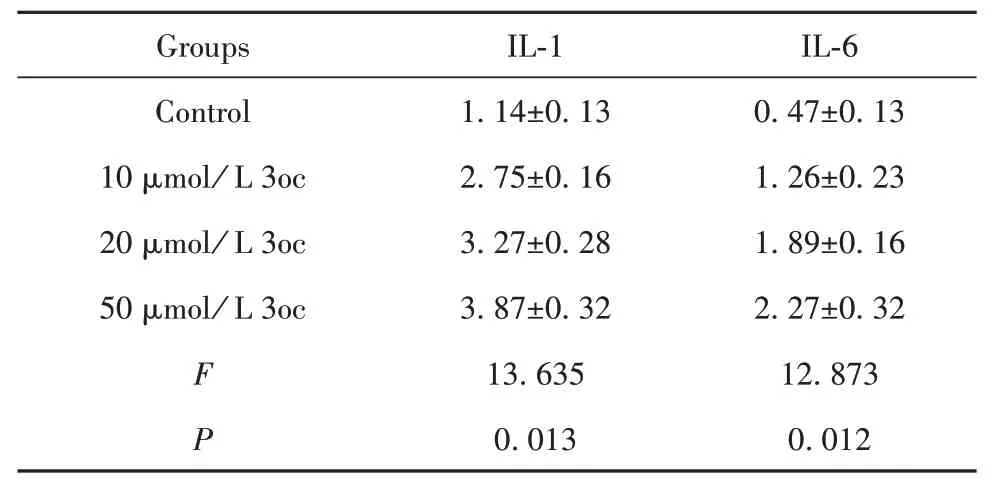
表4 IL-1和IL-6 mRNA表达(±s)Tab.4 Expressions of IL-1 and IL-6 mRNA(±s)
Groups Control 10µmol/L 3oc 20µmol/L 3oc 50µmol/L 3oc F P IL-1 1.14±0.13 2.75±0.16 3.27±0.28 3.87±0.32 13.635 0.013 IL-6 0.47±0.13 1.26±0.23 1.89±0.16 2.27±0.32 12.873 0.012
2.4 有序脂质结构域中的3oc为验证HSL是否保留于质膜中,课题组将H9细胞(避免凋亡细胞的干扰)与500µmol/L 3oc HSL或3-oxo-C8HSL或3-oxo-C10 HSL孵育5/10 min,分级,并按不同方式提取和分离3oc HSL或3-oxo-C8或3-oxo-C10 HSL(上清、细胞溶质和膜),发现质膜级分中,膜和上清中3oc和3-oxo-C10含量更高,细胞溶质中3-oxo-C8 HSL含量更高(P<0.05,表5)。
表5 有序脂质结构域中的3oc(±s,n=6)Tab.5 3oc in ordered lipid domain(±s,n=6)

表5 有序脂质结构域中的3oc(±s,n=6)Tab.5 3oc in ordered lipid domain(±s,n=6)
Groups Supernatant Cytosol Cell membrane F P 3oc 48.62±3.91 5.25±0.14 46.13±3.26 12.287 0.016 3-oxo-C8 HSL 38.75±3.18 40.12±2.87 21.13±2.26 13.254 0.027 3-oxo-C10 HSL 36.21±2.56 12.33±1.72 51.46±3.82 11.175 0.018
2.5 铜绿假单胞菌通过3oc诱导感染宿主细胞的淋巴细胞凋亡 为验证HSL毒力是否可通过自动诱导剂介导的免疫抑制降低宿主防御能力,课题组采用WT(PAO1)、lasI缺陷型(ΔlasI)和lasR缺陷型(ΔlasR)铜绿假单胞菌培养物上清培养C57BL/6小鼠淋巴细胞,结果显示ΔlasI和ΔlasR均可导致淋巴细胞数减少(P<0.05),可能通过3oc发挥作用(图3、表6)。为进一步证实结果,课题组 在C57BL/6小鼠气管内接种PAO1、ΔlasI和ΔlasR突变体,突变体感染小鼠的肺部提取物显示,铜绿假单胞菌菌落形成单位减少(P<0.05,表7)。
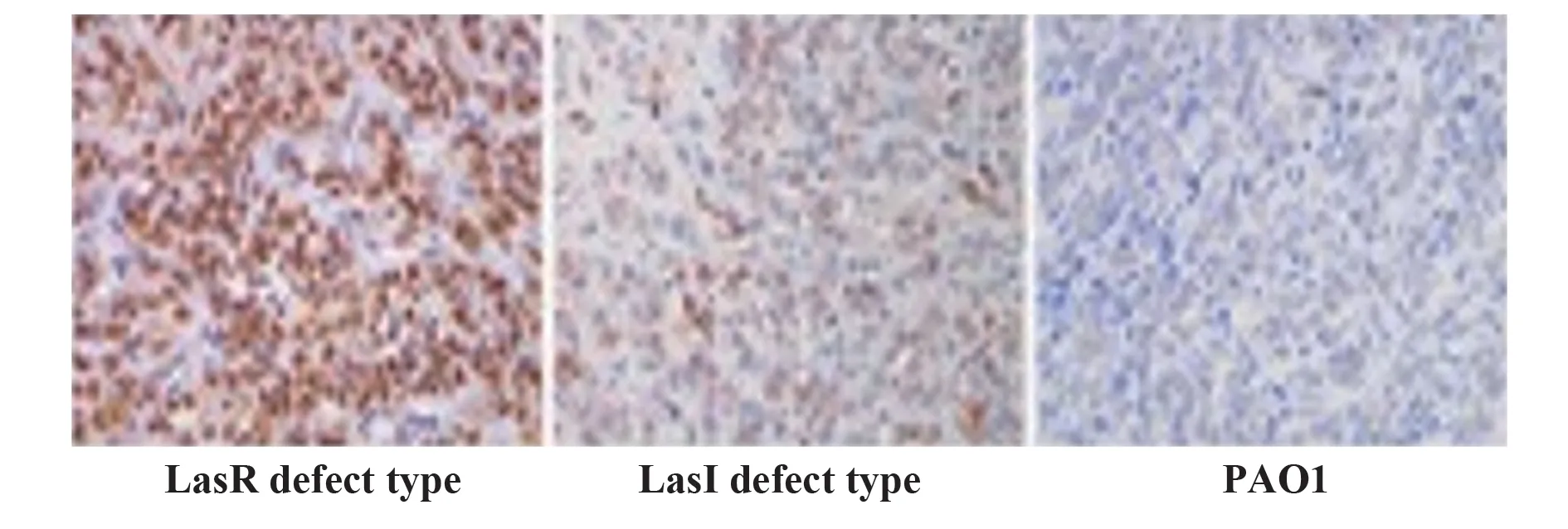
图3 细胞HE染色Fig.3 Cell HE staining
表6 细胞lasI缺陷和lasR缺陷对细胞数的影响(±s,%)Tab.6 Effect of lasi and lasR defections on cells number(±s,%)

表6 细胞lasI缺陷和lasR缺陷对细胞数的影响(±s,%)Tab.6 Effect of lasi and lasR defections on cells number(±s,%)
Groups PAO1 ΔlasI ΔlasR F P Number of cells 8.56±0.13 25.33±2.18 27.26±2.47 9.456 0.011
表7 3oc对T细胞活化的影响(±s)Tab.7 Effect of 3oc on T cell activation(±s)

表7 3oc对T细胞活化的影响(±s)Tab.7 Effect of 3oc on T cell activation(±s)
Groups PAO1 ΔlasI ΔlasR F P Colony formation 5.23±0.34 2.82±0.21 2.94±0.26 11.373 0.014
3 讨论
独立于Tolllike受体和NOD样受体的传统先天感应机制已提出几种基于蛋白的HSL信号转导机制,其中转录因子X-box结合蛋白1可介导内质网应激相关的胱天蛋白酶激活[13-14]。另有研究显示,3oc可作为调节剂在一定程度上调节PPAR-β/δ和PPAR-γ转录活性,后者参与上皮细胞炎症反应[15]。本研究提出了一种独立于直接蛋白相互作用的机制,结果表明,细菌代谢产物可通过膜干扰改变哺乳动物细胞表面,诱导部分细胞凋亡。
3oc诱导的免疫细胞凋亡效果显著,效果强于TNF-α本身触发的凋亡[16]。本研究表明,20µmol/L 3oc可诱导细胞凋亡。尽管3oc浓度在机体感染部位较高,如在生物膜上可达数百µmol/L,但可能形成扩散梯度,最终在多数环境下测得的浓度都不超过10µmol/L。对氧磷酶2(para-oxonase-2,PON2)是一种攻击HSL内酯环的内酯酶,在部分细胞中的表达可显著降低3oc的促凋亡作用[17]。本研究小鼠模型证实,趋化性吸引至感染部位的淋巴细胞可能暴露于比多数临床测量值高的3oc水平。铜绿假单胞菌中,Las和Rhl群体感应可调节至少600个细菌基因[18]。本研究表明,小鼠急性肺部感染模型中,3oc至关重要,可作为独立毒力因子,但其他群体感应基因也可能导致铜绿假单胞菌感染。
膜结构域在真核细胞中具有特异性,其功能发挥依赖于鞘脂和胆固醇的微型晶体状聚集[19]。尽管研究已发现结构相关的类胡萝卜素,但细菌却不含胆固醇和大多数真核固醇。膜结构域在更高的顺序上与多种饱和磷脂结合,动态脂质结构域形成栅栏样排列,受长链磷脂上黏附的潜在皮质细胞骨架制约[20]。该分区为高度多样化的真核表面受体信号传导提供了通用平台,使得真核膜对脂质结构域破坏特别敏感。既往粗粒度模型研究多采用由饱和/不饱和磷脂和胆固醇形成的膜中的芳香族和脂肪族疏水分子,该膜在室温下表现出典型的有序与无序相分离,研究显示芳族化合物可稳定相分离,而脂族结构可通过破坏其边界促进脂质域混合,因此,具有12个碳的侧链HSL属于后者,与本研究结论相符。细菌群体感应自动诱导剂是释放的小化学物质,用于控制微生物群落行为。N-(3-氧代十二烷酰基)高丝氨酸内酯是铜绿假单胞菌lasIlasR电路的自诱导物,可引发淋巴细胞大量凋亡。本研究发现该分子被并入哺乳动物的质膜并诱导真核脂质结构域溶解。肿瘤坏死因子受体1因其无配体的自发三聚作用而进入无序脂质相,并引发caspase-3、caspase-9介导的凋亡。铜绿假单胞菌释放N-(3-氧代十二烷酰基)高丝氨酸内酯以抑制宿主免疫功能,从而更好地存活。相反,阻断胱天蛋白酶可显著降低感染严重程度,揭示微生物与哺乳动物宿主间未知的交流方法,提示可通过拦截群体感应信号治疗细菌感染。
本研究认为,“群集感应”是指细菌特有的,因受到个体数量影响而“开启”或“关闭”的转录调控机制。绿脓杆菌中,存在一类称为“N-oxo-dodecanoyl-L-Ho‑moserine lactone(3oc)”的亲脂性群集感应分子。既往研究发现,该分子除在细菌内部具有转录调控活性外,还可直接影响宿主信号传导,主要分为抑制免疫信号及促进细胞凋亡2个方面。3oc的促凋亡作用是其“免疫调节”活性的本质,3oc通过插入及改变细胞膜的有序度影响TNFR1的膜运动特性,从而促进TN‑FR1及下游caspase-9与caspase-3激活,引发细胞凋亡,而3oc引发的中性粒细胞凋亡有助于抑制宿主天然免疫反应及促进绿脓杆菌体内增殖。
综上所述,3oc可通过直接引发宿主自身的TN‑FR1信号抑制免疫反应治疗铜绿假单胞菌感染,揭示了直接与宿主细胞防御信号转导偶联的自动诱导剂的免疫调节机制,即细菌脂类分子可通过改变膜结构间接导致宿主细胞受体分子激活,揭示了细胞膜受体激活的新方式,为调节宿主固有免疫力及微生物代谢产物研究提供了重要线索。
