艾拉莫德对干燥综合征小鼠颌下腺炎症及NF-κB信号通路的影响①
2021-05-27高丽霞郭惠芳河北医科大学第二医院风湿免疫科石家庄050000
齐 晅 田 玉 孙 超 高丽霞 郭惠芳(河北医科大学第二医院风湿免疫科,石家庄 050000)
干燥综合征为一种自身免疫性疾病,主要侵犯外分泌腺,临床主要表现为眼干、口干、内脏系统损害等;干燥综合征发病率较高,对患者的健康造成严重危害。干燥综合征的病理特征为大量淋巴细胞浸润外分泌腺,外分泌腺体炎症细胞因子水平升高[1]。因此抑制炎症因子产生及其信号通路是治疗干燥综合征的关键。艾拉莫德为新型小分子免疫调节药物,具有抑制炎症细胞因子产生、抑制免疫球蛋白形成等作用,是常用的抗风湿药物[2]。近年艾拉莫德在干燥综合征治疗中的作用也受到关注,如吴晓畅等[3]研究发现,艾拉莫德可减轻干燥综合征小鼠下颌腺淋巴细胞浸润程度,降低血清IL-17及IFN-γ水平。上述研究表明艾拉莫德可降低血清炎症细胞因子水平,但其对下颌腺组织中炎症细胞水平及其可能信号通路的影响尚不明确。核因子(nuclear factor,NF)-κB信号通路在炎症反应和干燥综合征的发病中均发挥重要作用[4]。故本文对艾拉莫德对干燥综合征小鼠下颌腺组织中炎症因子水平及NF-κB信号通路的影响进行研究,探讨艾拉莫德在干燥综合征中的作用及可能机制。
1 材料与方法
1.1 材料8周龄SPF级雌性NOD小鼠和C57BL/6小鼠购自上海实验动物研究中心,许可证号:SYXK(沪)2019-0003。艾拉莫德片(先声药业公司,批号:A17-185346);兔抗鼠NF-κB/p50单克隆抗体、兔抗鼠NF-κB/p65单克隆抗体、兔抗鼠IκBα单克隆抗体等抗体(美国Sigma公司);伊红-苏木素(HE)染液(杭州联科生物);IL-6、TNF-α、IFN-γ ELISA试剂盒(美国Abcam公司)。
1.2 方法
1.2.1 动物分组和处理 将36只NOD小鼠根据随机数字法分为模型组(M组)、艾拉莫德1组(I1组)、艾拉莫德2组(I2组),12只/组,12只C57BL/6小鼠作为对照组(C组)。各组小鼠于我院动物中心饲养适应1周,I1组小鼠每天给予0.5%羧甲基纤维素+10 mg/kg艾拉莫德灌胃治疗,I2组小鼠每天给予0.5%羧甲基纤维素+30 mg/kg艾拉莫德灌胃治疗[3]。C组和M组小鼠每天给予等量0.5%羧甲基纤维素灌胃,给药剂量根据动物和人等效剂量换算表计算。共进行8周。
1.2.2 饮水量和唾液分泌量测定 每天记录各小鼠饮水瓶质量,每日饮水量=前一天饮水瓶质量-当天饮水瓶质量,记录第8周末小鼠的日饮水量。次日,各小鼠禁食1 h,不禁水,测量唾液分泌量。具体方法:0.7%无巴比妥麻醉小鼠,取头低位,称取干的小棉球质量,将其放入小鼠口底,收集唾液15 min,取出棉球,再次称取小棉球质量,计算分泌唾液量(mg),分泌唾液量=测量后小棉球质量-测量前小棉球质量。
1.2.3 颌下腺指数和脾脏指数测定 饮水量和唾液分泌量测定结束后,称取小鼠重量,脱臼法处死小鼠,摘取双侧颌下腺和脾脏称重,颌下腺指数=颌下腺重量/小鼠体重,脾脏指数=脾脏重量/小鼠体重。
1.2.4 颌下腺组织HE染色 将部分颌下腺组织固定于福尔马林,石蜡包埋,切成5µm厚切片,常规HE染色,镜下拍照并观察颌下腺组织的病理形态学变化。参照CUTZLER等[5]提出的方法评价下颌腺病理学评分:偶见淋巴细胞浸润为0分,2~3个散在淋巴细胞浸润为1分,中度淋巴细胞浸润伴轻度实质损伤为2分,偶见0~1个淋巴细胞浸润灶伴中度实质损伤为3分,2~3个淋巴细胞浸润灶伴中度实质损伤为4分。
1.2.5 ELISA测定颌下腺组织IL-6、TNF-α、IFN-γ水平 取各小鼠0.1 g下颌腺组织剪碎,置入无菌管,加入生理盐水2 ml,匀浆1 min,3000 r/min离心20 min,取上清液,ELISA测定下颌腺上清液中IL-6、TNF-α、IFN-γ水平。
1.2.6 Western blot测定下颌腺组织NF-κB/p50、NF-κB/p65、IκBα蛋白水平 取下颌腺组织加入裂解液裂解、匀浆,提取总蛋白,经电泳、转膜后,脱脂奶粉封闭2 h,加入一抗:兔抗鼠NF-κB/p50单克隆抗体(1:300)、兔抗鼠NF-κB/p65单克隆抗体(1:300)、兔抗鼠IκBα单克隆抗体(1:300),过夜孵育,加入二抗(1:5 000)孵育2 h,显影、定影、冲洗、晾干,扫描胶片,采用Image J软件分析NF-κB/p50、NF-κB/p65、IκBα蛋白水平,以β-actin为内参照,目标蛋白水平=目标条带灰度值/β-actin条带灰度值。
1.3 统计学分析 采用SPSS20.0软件分析,每日饮水量、唾液分泌量、颌下腺指数、脾脏指数、病理评分、颌下腺组织IL-6、TNF-α、IFN-γ水平及下颌腺组织NF-κB/p50、NF-κB/p65、IκBα蛋白水平以±s表示,采用方差分析,组内两两比较采用LSD检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠每日饮水量和唾液分泌量比较 与C组相比,M组小鼠每日饮水量增多,唾液分泌量降低(P<0.05);与M组相比,I组小鼠每日饮水量减少,唾液分泌量升高(P<0.05),其中I2组小鼠每日饮水量低于I1组,唾液分泌量高于I1组(P<0.05),见表1。
表1 各组小鼠每日饮水量和唾液分泌量比较(±s,n=12)Tab.1 Comparison of daily drinking water and saliva secretion in each group of mice(±s,n=12)
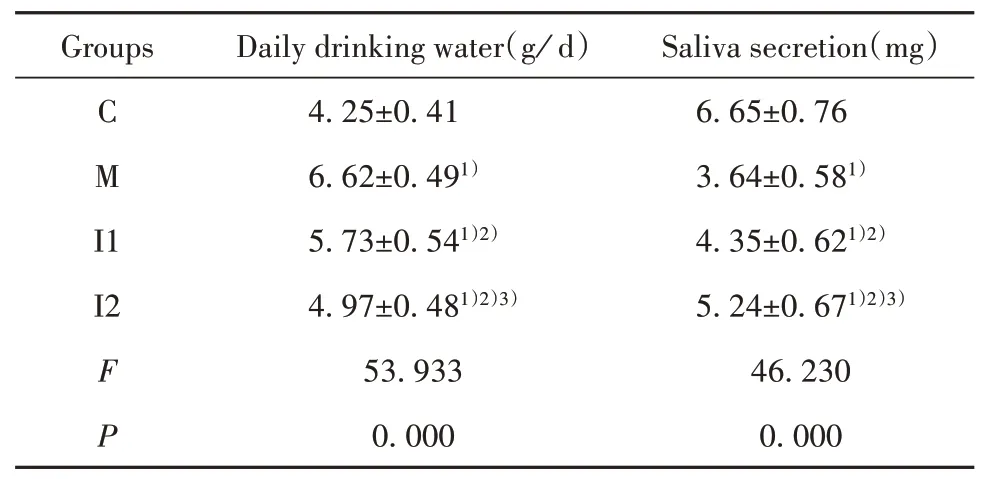
表1 各组小鼠每日饮水量和唾液分泌量比较(±s,n=12)Tab.1 Comparison of daily drinking water and saliva secretion in each group of mice(±s,n=12)
Note:Compared with C group,1)P<0.05;compared with M group,2)P<0.05;compared with I1 group,3)P<0.05.
Saliva secretion(mg)6.65±0.76 3.64±0.581)4.35±0.621)2)5.24±0.671)2)3)46.230 0.000 Groups C M I 1 I2 F P Daily drinking water(g/d)4.25±0.41 6.62±0.491)5.73±0.541)2)4.97±0.481)2)3)53.933 0.000
2.2 各组小鼠颌下腺指数和脾脏指数比较 与C组相比,M组小鼠颌下腺指数降低,脾脏指数升高(P<0.05);与M组相比,I组小鼠颌下腺指数升高,脾脏指数降低(P<0.05),其中I2组小鼠颌下腺指数高于I1组,脾脏指数低于I1组(P<0.05),见表2。
表2 各组小鼠颌下腺指数和脾脏指数比较(±s,n=12,mg/g)Tab.2 Comparison of submandibular gland index and spleen index in each group of mice(±s,n=12,mg/g)

表2 各组小鼠颌下腺指数和脾脏指数比较(±s,n=12,mg/g)Tab.2 Comparison of submandibular gland index and spleen index in each group of mice(±s,n=12,mg/g)
Note:Compared with C group,1)P<0.05;compared with M group,2)P<0.05;compared with I1 group,3)P<0.05.
Spleen index 2.97±0.28 4.12±0.431)3.85±0.371)2)3.41±0.461)2)3)20.014 0.000 Groups CMI 1 I2 FP Submandibular gland 0.77±0.15 0.39±0.121)0.48±0.131)2)0.62±0.141)2)3)18.071 0.000
2.3 各组小鼠颌下腺组织形态学和病理评分比较C组小鼠颌下腺腺泡大小规则,排列紧密,未见导管扩张和淋巴细胞浸润;M组小鼠颌下腺腺泡大小不一,排列不规则,导管明显扩张,见大量淋巴细胞浸润;I组小鼠下颌腺腺泡大小不一和形态不规则明显改善,导管扩张减轻,淋巴细胞浸润减少,其中与I1组相比,I2组小鼠下颌腺组织病理改善更显著。见图1。与M组相比,I组小鼠病理评分降低(P<0.05),其中I2组小鼠病理评分低于I1组(P<0.05),见表3。
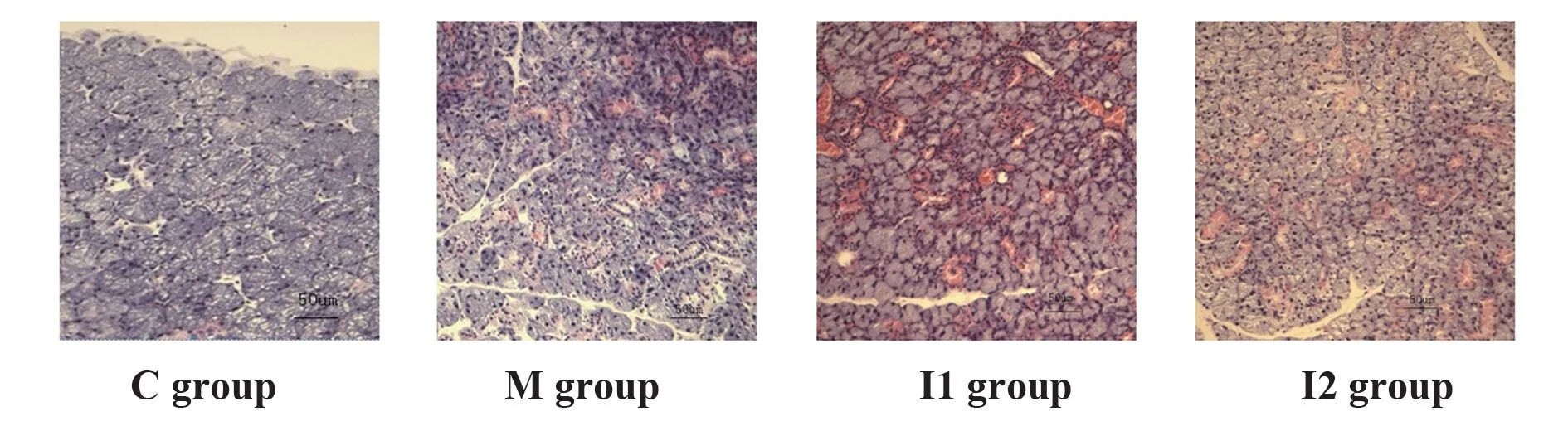
图1 各组小鼠颌下腺组织HE染色(×200)Fig.1 HE staining of submandibular gland of each group of mice(×200)
表3 各组小鼠病理评分比较(±s)Tab.3 Comparison of pathological scores of mice in each group(±s)

表3 各组小鼠病理评分比较(±s)Tab.3 Comparison of pathological scores of mice in each group(±s)
Note:Compared with M group,1)P<0.05;compared with I1 group,2)P<0.05.
Pathological scores 3.14±0.62 2.31±0.581)1.42±0.511)2)27.155 0.000 Groups M I 1 I 2 n 12 12 12 F P
2.4 各组小鼠颌下腺组织IL-6、TNF-α、IFN-γ水平比较 与C组相比,M组小鼠颌下腺组织IL-6、TNFα、IFN-γ水平升高(P<0.05);与M组相比,I组小鼠颌下腺组织IL-6、TNF-α、IFN-γ水平降低(P<0.05),其中I2组小鼠颌下腺组织IL-6、TNF-α、IFN-γ水平低于I1组(P<0.05),见表4。
表4 各组小鼠颌下腺组织IL-6、TNF-α、IFN-γ水平比较(±s,n=12,ng/L)Tab.4 Comparison of IL-6,TNF-αand IFN-γlevels in submandibular gland of mice in each group(±s,n=12,ng/L)

表4 各组小鼠颌下腺组织IL-6、TNF-α、IFN-γ水平比较(±s,n=12,ng/L)Tab.4 Comparison of IL-6,TNF-αand IFN-γlevels in submandibular gland of mice in each group(±s,n=12,ng/L)
Note:Compared with C group,1)P<0.05;compared with M group,2)P<0.05;compared with I1 group,3)P<0.05.
IFN-γ 873.26±154.32 1482.34±186.491)1356.49±192.311)2)1152.47±175.941)2)3)26.831 0.000 Groups C M I 1 I2 F P IL-6 97.83±15.43 182.64±16.471)152.1615.291)2)127.8314.681)2)3)64.966 0.000 TNF-α 382.16±38.21 602.31±43.251)546.28±41.321)2)472.37±39.541)2)3)66.063 0.000
2.5 各组小鼠下颌腺组织中NF-κB信号通路蛋白比较 与C组相比,M组小鼠下颌腺组织NF-κB/p50、NF-κB/p65蛋白水平升高,IκBα蛋白水平降低(P<0.05);与M组相比,I组小鼠下颌腺组织NF-κB/p50、NF-κB/p65蛋白水平降低,IκBα蛋白水平升高(P<0.05),其中I2组小鼠下颌腺组织NF-κB/p50、NF-κB/p65蛋白水平低于I1组(P<0.05),IκBα蛋白水平高于I1组(P<0.05),见表5、图2。
表5 各组小鼠下颌腺组织NF-κB/p50、NF-κB/p65、IκBα蛋白水平比较(±s,n=12)Tab.5 Comparison of NF-κB/p50,NF-κB/p65 and IκBα protein levels in submandibular gland of mice in each group(±s,n=12)

表5 各组小鼠下颌腺组织NF-κB/p50、NF-κB/p65、IκBα蛋白水平比较(±s,n=12)Tab.5 Comparison of NF-κB/p50,NF-κB/p65 and IκBα protein levels in submandibular gland of mice in each group(±s,n=12)
Note:Compared with C group,1)P<0.05;compared with M group,2)P<0.05;compared with I1 group,3)P<0.05.
IκBα 0.79±0.14 0.18±0.051)0.35±0.061)2)0.47±0.081)2)3)99.128 0.000 Groups C M I 1 I2 F P NF-κB/p50 0.10±0.03 0.72±0.091)0.53±0.081)2)0.29±0.061)2)3)186.105 0.000 NF-κB/p65 0.19±0.02 0.51±0.061)0.44±0.051)2)0.31±0.041)2)3)119.062 0.000
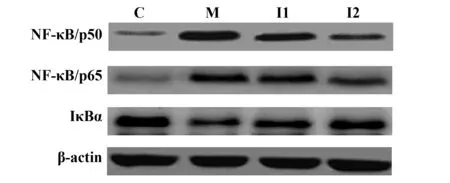
图2 各组小鼠下颌腺组织NF-κB/p50、NF-κB/p65、IκBα蛋白水平Fig.2 NF-κB/p50,NF-κB/p65 and IκBαprotein levels in submandibular gland of mice in each group
3 讨论
干燥综合征的治疗方法主要包括系统性治疗和局部治疗,系统性治疗主要应用糖皮质激素、免疫抑制剂、生物制剂等药物延缓和控制由自身免疫反应引起的组织器官损害;局部治疗是主要以改善眼干、口干及其他部位干燥症状为目的的治疗[6]。但干燥综合征目前尚不能根治,药物治疗主要控制疾病发展,且免疫抑制剂及激素等药物长期应用可引起一系列副作用。艾拉莫德为临床上用于治疗类风湿关节炎的抗风湿药物,为一种新药,具有抑制炎症因子产生和抑制Ig合成的作用,在治疗干燥综合征中也具有较好效果[7-10]。如王雪等[11]研究发现,艾拉莫德可有效改善干燥综合征患者病情,调节B细胞亚群、降低免疫球蛋白水平。NOD小鼠早期出现饮水量增加、口干等临床表现,且血清中自身抗体升高,外分泌腺存在淋巴细胞浸润,为理想的自发性干燥综合征模型小鼠。本文采用NOD小鼠作为干燥综合征小鼠模型,发现干燥综合征小鼠每日饮水量升高、唾液分泌量降低、颌下腺指数降低、脾脏指数升高、下颌腺病理评分升高;给予艾拉莫德治疗后,模型组小鼠每日饮水量降低、唾液分泌量升高、颌下腺指数升高、脾脏指数降低、下颌腺病理评分降低。表明艾拉莫德可有效改善干燥综合征小鼠的临床症状,减轻下颌腺的病理损伤,且呈剂量依赖性。
干燥综合征为一种以血清中含多种自身抗体和高度淋巴细胞浸润为特征、侵犯泪腺、唾液腺等外分泌腺的自身免疫性疾病,其发病机制复杂,目前认为其主要病理学机制为:在大量T淋巴细胞作用下,B淋巴细胞功能紊乱,产生多种免疫复合物、自身抗体、多克隆免疫球蛋白,导致分泌腺产生炎症性病变,并导致分泌腺发生破坏性改变。Th17细胞在干燥综合征中发挥重要作用,Th17细胞可产生IL-6、TNF-α、IL-17等炎症细胞因子,促进干燥综合征的发生发展。IL-6由T淋巴细胞、B淋巴细胞、单核细胞、内皮细胞等细胞产生,可影响T淋巴细胞增殖活化,诱导T淋巴细胞产生抗体,影响粒细胞分化和杀伤细胞的能力[12-13]。TNF-α主要由巨噬细胞和活化的单核细胞产生,具有促进中性粒细胞吞噬、抗感染、诱导细胞增殖分化等作用,为重要的炎症因子,在自身免疫性疾病中发挥重要作用[14]。IL-6和TNF-α在干燥综合征中水平升高,TNF-α可诱导IL-6等细胞因子释放,形成放大连锁反应,引起干燥综合征的外分泌腺体损伤[15]。IFN-γ可通过促进Th1细胞的活化和增殖,抑制Th2细胞的活化和增殖,从而参与免疫调节过程,IFN-γ在干燥综合征患者外分泌腺体和血清中水平显著升高,并可诱导IL-6、TNF-α等炎症细胞因子高表达,促进干燥综合征的进展[16-17]。本研究发现干燥综合征小鼠下颌腺组织中IL-6、TNF-α、IFN-γ水平升高,表明IL-6、TNFα、IFN-γ参与干燥综合征下颌腺的损伤过程,艾拉莫德可抑制干燥综合征小鼠下颌腺组织IL-6、TNFα、IFN-γ水平,表明艾拉莫德可能通过抑制下颌腺组织的炎症反应发挥对下颌腺的保护作用。
NF-κB在真核细胞中普遍存在,为炎症反应和免疫反应的核心物质,NF-κB信号通路在多种自身免疫性疾病和感染性疾病的发生发展中发挥重要作用。在静息状态时,NF-κB和NF-κB抑制蛋白IκB形成复合物,在细胞质中以无活性的形式存在,IκB的主要功能为抑制NF-κB活化,当细胞受到细胞外信号(如IL-6、TNF-α等)刺激时,可降解IκB,激活NF-κB,活化的NF-κB进一步增强IL-6、TNF-α等炎症因子释放,IL-6、TNF-α等炎症因子进一步激活NF-κB,形成正反馈机制,NF-κB激活时,具有免疫活性的NF-κB/p50和NF-κB/p65大量表达,和其调控因子一起参与疾病的病理损伤过程[18]。NF-κB在干燥综合征的发生发展中也发挥重要作用[19]。艾拉莫德可通过NF-κB信号通路发挥对疾病的治疗作用[20],如黄颖等[21]研究发现艾拉莫德通过NF-κB信号通路发挥对Ⅱ型胶原诱导性关节炎大鼠的治疗作用。介于NF-κB在干燥综合征中发挥重要作用,艾拉莫德可通过NF-κB信号通路发挥作用,故推测艾拉莫德可能通过NF-κB信号通路发挥对干燥综合征小鼠的保护作用。本文对该推测进行研究,发现干燥综合征模型小鼠下颌腺组织NF-κB/p50、NF-κB/p65蛋白水平升高,IκBα蛋白水平降低;与模型组小鼠相比,I组小鼠下颌腺组织NF-κB/p50、NF-κB/p65蛋白水平降低,IκBα蛋白水平升高。表明NF-κB信号通路激活参与干燥综合征小鼠的下颌腺病理损伤过程,艾拉莫德可能通过抑制NF-κB信号通路激活抑制干燥综合征小鼠下颌腺的炎症反应,从而发挥对下颌腺的保护作用。
