TGF-β1对大鼠肾小球系膜细胞纤维化蛋白及长链非编码RNA uc.412表达的影响
2021-05-27杨思慧王锦黄婵安梦如张爱青甘卫华
杨思慧,王锦,黄婵,安梦如,张爱青,甘卫华
南京医科大学第二附属医院,南京210003
慢性肾脏病(CKD)是由多种原因引起的慢性肾脏结构及功能障碍,肾纤维化是其主要病理学基础。转化生长因子β1(TGF-β1)具有调节细胞生长、分化、凋亡和迁移等多种生物学活性,能够介导肾小球系膜纤维化,是肾脏纤维化发病机制中的关键介质[1-3]。Smad蛋白是TGF-β下游的主要效应蛋白,在肾脏受到各种病理性因素(缺血、缺氧或高糖等)和外界环境诱导因素时,活化的TGF-β1结合Ⅰ型和Ⅱ型TGF-β受体以及受体相关Smad(R-Smad),即Smad2和Smad3;磷酸化的Smad2/3与Smad4形成低聚物,进入细胞核调控下游靶基因的转录,诱导纤维化相关蛋白α平滑肌肌动蛋白(α-SMA)及胶原蛋白(Collagen)形成,进一步诱导肾小管上皮—间充质转化(EMT),从而促进肾纤维化[4-5]。长链非编码RNA(lncRNA)虽然不参与编码蛋白质,但可作为重要的调控分子发挥多种生物学功能,在某些细胞的增殖调控中发挥重要作用[6]。本课题组前期通过高通量lncRNA微矩阵芯片技术在TGF-β1处理的系膜细胞中筛选出lncRNA uc.412,证实其表达与系膜细胞增殖密切相关,但其在系膜细胞中的具体生物学功能尚不明确[7-9]。SIS3是Smad3磷酸化特异性抑制剂,2020年6—11月,本研究采用SIS3抑制TGF-β1诱导的Smad3磷酸化,观察TGF-β1诱导大鼠肾小球系膜细胞纤维化蛋白表达的作用,并进一步探讨其作用机制与lncRNA uc.412的关系,为临床防治肾纤维化相关的CKD奠定基础。
1 材料与方法
1.1 细胞与试剂 大鼠肾小球系膜细胞HBZY-1细胞株购自中国典型培养物保藏中心。过表达慢病毒lncRNA uc.412购自上海吉凯基因科技有限公司,1型胶原蛋白(Collagen-1)、α-SMA抗体购自美国Abcam公司,TGF-β1购自Novoprotein公司,SIS3购自MCE公司,低糖DMEM培养基、胎牛血清和胰蛋白酶购自Gibco公司,GAPDH购自Affinity公司,二抗兔IgG、二抗鼠IgG、BCA蛋白定量试剂盒购自凯基生物,TRIzol试剂购自Invitrogen公司,PCR试剂盒购自TaKaRa公司,PCR引物由上海锐真生物合成。
1.2 细胞培养 将HBZY-1细胞置于含10%胎牛血清的DMEM培养基(含100 U/L青霉素、100 mg/L链霉素)中,37℃、5%CO2细胞培养箱中培养。每天于倒置显微镜下观察细胞形态,2~3 d更换培养基,当细胞融合率达到80%~90%时,加入0.25%胰酶进行消化传代。当细胞长至60%~70%融合时,用无血清培养基继续培养24 h,使细胞生长同步化。取对数生长期细胞用于后续实验。
1.3 细胞lncRNA uc.412表达检测 采用Real-time PCR法。取对数生长期细胞,按(2~8)×105/孔接种至6孔板,随机分为对照组、TGF-β1组、TGF-β1+SIS3组。对照组仅加入培养基,TGF-β1组加入10 ng/mL TGFβ1,TGF-β1+SIS3组同时加入10 ng/mL TGF-β1和1µmol/L SIS3,继续培养24 h。收集各组细胞,TRIzol法提取总RNA,逆转录合成cDNA。配置10µL PCR反应体系,以β-actin作为内参,参照PCR试剂盒说明书进行Real-time PCR。引物序列:lncRNA uc.412上游5'-CTTGAATTCCAAGCAGCA⁃CA-3',下游5'-CAGCAATTAATCCCCCAAGA-3';βactin上游5'-CGGGAAATCGTGCGTGAC-3',下游5'-TGGAAGGTGGACAGCGAGG-3'。反应体系(20µL):SYBR 5µL,上下游引物各0.4µL,Rox 0.2µL,cDNA 1µL,ddH2O 3µL。反应条件:预变性95℃30 s;变性95℃5 s;退火60℃34 s;延伸60℃1 min,40个循环;降温50℃30 s。通过熔解曲线分析扩增产物的特异性,2-ΔΔCt法计算目的基因的相对表达量。每个样本设置3个复孔,实验重复3次。
1.4 细胞Collagen-1、α-SMA及p-Smad3表达检测采用Western blotting法。细胞分组与干预方法同“1.3”。收集各组细胞,加入蛋自裂解液冰上裂解30 min,4℃、12 000 r/min离心15 min,取上清液。BCA法进行蛋白定量,加入5×上样缓冲液,变性处理(95℃,10 min)。取30µg蛋白上样,10%十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳,湿转至PVDF膜,5%脱脂奶粉封闭2 h。加入一抗(稀释比例为1∶1 000)4℃孵育过夜,TBST缓冲液洗涤3次;加入二抗(稀释比例为1∶2 000)室温孵育1 h,TBST缓冲液洗涤3次。加入ECL发光液显色,凝胶成像系统图像扫描,Image J软件测定灰度值。以GAPDH作为内参,计算目的蛋白与GAPDH蛋白灰度值的比值,作为目的蛋白的相对表达量。
1.5 过表达lncRNA uc.412对肾小球系膜细胞纤维化蛋白表达的影响观察
1.5.1 细胞分组与慢病毒转染 取对数生长期细胞,接种于6孔板,置于37℃、5%CO2细胞培养箱中培养。待细胞融合率达到60%~70%,加入无血清DMEM培养基继续培养24 h,使细胞生长同步化。将细胞分为对照组、过表达组和病毒空载组,过表达组加入lncRNA uc.412过表达病毒液,病毒空载组加入不含lncRNA uc.412的慢病毒液,对照组加入等量培养基,继续37℃培养24 h。
1.5.2 细胞Collagen-1、α-SMA mRNA表达检测采用Real-time PCR法。PCR引物序列:α-SMA上游5'-AACTATGCTTCTGGACGTACAA-3',下 游5'-CATAGCCCTCATAGATAGGCAC-3';Collagen-1上游5'-AAAGATGGACTCAACGGTCTC-3',下游5'-CAG⁃GAAGCTGAAGTCATAACCA-3'。具体操作步骤参照“1.3”。
1.5.3 细胞Collagen-1、α-SMA蛋白表达检测 采用Western blotting法。具体操作步骤参照“1.4”。
1.6 统计学方法 采用GraphPad Prism8统计软件。计量资料以±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞lncRNA uc.412表达比较 见表1。与对照组比较,TGF-β1组lncRNA uc.412表达升高;与TGF-β1组比较,TGF-β1+SIS3组lncRNA uc.412表达下降(P均<0.01)。
表1 各组细胞lncRNA uc.412表达水平比较(±s)

表1 各组细胞lncRNA uc.412表达水平比较(±s)
注:与对照组相比,*P<0.01;与TGF-β1组相比,#P<0.01。
?
2.2 各组细胞Collagen-1、α-SMA及p-Smad3蛋白表达比较 见表2。与对照组比较,TGF-β1组细胞Collagen-1、α-SMA及p-Smad3蛋白表达升高(P均<0.05);与TGF-β1组 比 较,TGF-β1+SIS3组 细 胞Collagen-1、α-SMA及p-Smad3蛋白表达下降(P均<0.05)。
表2 各组细胞Collagen 1、α-SMA及p-Smad3蛋白表达水平比较(±s)
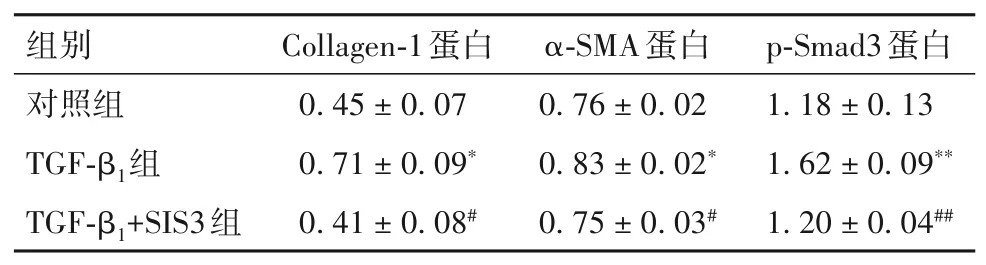
表2 各组细胞Collagen 1、α-SMA及p-Smad3蛋白表达水平比较(±s)
注:与对照组相比,*P<0.05,**P<0.01;与TGF-β1组相比,#P<0.05,##P<0.01。
?
2.3 过表达lncRNA uc.412对细胞纤维化蛋白及mRNA的影响 见表3。与对照组相比,病毒空载组Collagen-1、α-SMA蛋白及mRNA表达无明显变化(P均>0.05),过表达组Collagen-1、α-SMA蛋白及mRNA表达均升高(P均<0.05)。
表3 各组细胞Collagen-1、α-SMA蛋白及mRNA表达水平比较(±s)
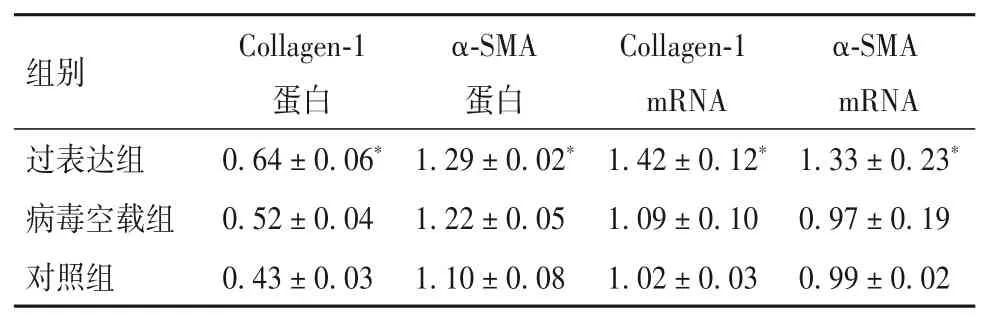
表3 各组细胞Collagen-1、α-SMA蛋白及mRNA表达水平比较(±s)
注:与对照组、病毒空载组相比,*P<0.05。
?
3 讨论
了解肾纤维化的分子发病机制,对开发CKD的新型治疗策略有重要作用。肾脏纤维化是一个复杂的过程,主要病理表现为细胞外基质沉积和纤维细胞过度增殖,共同导致肾间质、肾小球硬化及慢性炎症细胞浸润,引起各种诱因导致的慢性肾脏疾病[10]。研究表明,进行性肾纤维化是由多种介质通过多种途径介导的,包括生长因子、细胞因子、代谢毒素和应激分子等,其中TGF-β1是肾脏纤维化的发病机制中的关键介质。TGF-β1是TGF-β超家族的成员,具有调节细胞生长、分化、凋亡和迁移等多种生物学过程[11]。本研究结果显示,肾小球系膜细胞中加入TGF-β1处理后,纤维化相关蛋白Collagen-1、α-SMA蛋白表达升高,证实TGF-β1可以诱导肾小球系膜纤维化。
lncRNA在某些细胞的增殖调控中发挥重要作用。近年来,关于lncRNA与肾脏疾病的研究越来越多,已有文献报道lncRNA参与肾纤维化[12]。FENG等[13]报道,在输尿管梗阻性肾病(UUO)和抗肾小球基底膜肾小球性肾炎(抗GBM-GN)小鼠中,发现151个Smad3依赖性的lncRNA,其中Erbb4-IR是通过下调Smad7来导致TGF-β/Smad3介导肾纤维化。WANG等[14]报道,TGF-β/Smad3相互作用长非编码RNA(lnc-TSI)受Smad3转录调控,并特异性抑制TGF-β诱导的Smad3磷酸化和下游纤维化基因表达,从而阻止Smad3与独立于Smad7的TGF-β受体1相互作用,抑制肾脏纤维化。因此,研究lncRNA对于治疗肾纤维化导致的慢性肾脏疾病具有重要意义。lncRNA uc.412基因全长268 bp,位于人类17号染色体q12片段,其表达水平与系膜细胞增殖程度有关。本研究结果显示,肾小球系膜细胞加入TGF-β1后,与对照组相比,TGF-β1组lncRNA uc.412表达明显上调;建立过表达lncRNA uc.412的系膜细胞模型,发现过表达组纤维化相关蛋白Collagen-1、α-SMA蛋白及mRNA表达均显著增加。这表明lncRNA uc.412参与介导肾小球系膜纤维化,但TGF-β1通过lncRNA uc.412调控系膜纤维化的机制有待进一步研究。
Smad蛋白家族是TGF-β下游的主要效应蛋白,在肾脏受到各种病理性因素(如缺血、缺氧或高糖等)和外界环境诱导因素影响时,TGF-β受体被激活,与下游底物Smad蛋白家族结合,形成复合体转移入细胞核,调控下游基因转录,进一步诱导肾小管上皮间充质转化,从而促进肾纤维化。其中Smad3是有效的致纤维化因子,敲除Smad3有效减轻肾脏纤 维 化[1]。XU等[15]发 现,敲 除Smad3可 降 低lncRNA Erbb4-IR转录,同时增加miR-29b转录,保护小鼠肾脏免受进行性肾损伤,Smad3可能成为糖尿病肾病的新型有效治疗靶标。ZHOU等[16]在Smad3野生型/敲除型的小鼠上构建单侧输尿管结扎诱导的肾脏纤维化模型,发现lncRNA np_5318和np_17856参与了TGF-β1介导的肾纤维化,并可能成为肾脏纤维化的潜在治疗靶点。因此推测,TGF-β1可能通过与下游Smad3信号通路上调lncRNA uc.412,进而促进系膜细胞纤维化相关蛋白表达。SIS3是Smad3的特异性抑制剂,可抑制TGF-β1诱导的Smad3磷酸化。JI等[17]研究发现,SIS3通过抑制单侧输尿管结扎小鼠肾脏中的TGF-β/Smad3信号转导通路,改善了肾组织纤维化、细胞凋亡及炎症。本研究结果显示,与TGF-β1组比较,TGF-β1+SIS3组p-Smad3水平下调,证实SIS3能特异性抑制Smad3磷酸化;用SIS3干预后,与TGF-β1组相比,TGF-β1+SIS3组Collagen-1、α-SMA蛋白及mRNA表达显著降低,证实TGF-β1通过Smad3信号途径诱导系膜细胞纤维化蛋白表达增加;与TGF-β1组相比,TGF-β1+SIS3组系膜细胞lncRNA uc.412表达降低,提示TGF-β1可以通过Smad3信号通路上调lncRNA uc.412表达,从而参与肾小球系膜纤维化的进程。
综上所述,TGF-β1能够诱导肾小球系膜纤维化,其作用机制可能是通过Smad3信号通路上调lncRNA uc.412表达从而发挥作用,提示lncRNA uc.412可能具有治疗CKD的潜在前景,但其具体机制仍有待进一步深入研究。
