二甲双胍对糖基化终末产物诱导牙周膜成纤维细胞凋亡及p38 MAPK/NF-κB通路的影响
2021-05-27黄辉于大海黄炫赓罗智杰
黄辉,于大海,黄炫赓,罗智杰
广西医科大学附属口腔医院,南宁530001
糖尿病是临床常见的慢性代谢紊乱性疾病,其高血糖环境能诱发多种并发症,疾病负担较重[1]。糖尿病牙周炎是糖尿病的常见并发症之一,最终因牙周支持组织破坏导致牙齿松动、脱落[2-3]。晚期糖基化终末产物(AGEs)是蛋白质、核酸等大分子自发与葡萄糖等还原单糖在无酶参与条件下生成的稳定共价加成物,与糖尿病并发症的发生相关[4]。牙周膜成纤维细胞(PDLCs)是牙周膜中最主要的细胞,其在刺激下产生的炎症反应在牙周炎进展中发挥重要作用[5]。p38丝裂原活化蛋白激酶(MAPK)/核因子κB(NF-κB)通路是炎症相关通路,可被AGEs引起的氧化应激反应诱导激活,诱发一系列炎症反应[6-7]。二甲双胍是糖尿病治疗的一线用药,研究发现,二甲双胍可以调控凋亡相关蛋白Caspase-3表达,抑制AGEs诱导人皮肤成纤维细胞凋亡反应[8],但对AGEs诱导PDLCs凋亡的影响尚缺乏研究。2019年8月—2020年6月,我们采用AGEs诱导PDLCs凋亡,观察二甲双胍对AGEs诱导的PDLCs凋亡及p38 MAPK/NF-κB通路的影响,旨在为糖尿病牙周炎的治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞与药物 人PDLCs细胞株购自美国Sciencell公司,AGEs购自英国Biorbyt公司,二甲双胍(国药准字H20023371)购自中美上海施贵宝制药有限公司。
1.1.2 试剂与仪器 胎牛血清购自澳大利亚Aus⁃GeneX公司,DMEM培养基购自德国Merck公司,CCK-8试剂购自日本同仁化学研究所。AnnexinⅤ-FITC/PI细胞凋亡检测试剂盒购自哈尔滨新海基因检测有限公司,超氧化物歧化酶(SOD)、丙二醛(MDA)ELISA检测试剂盒购自上海晶抗生物工程有限公司,白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)ELISA试剂盒购自北京索莱宝科技有限公司。p-p38 MAPK抗体、p38 MAPK抗体、NF-κB p65抗体、GAPDH抗体购自Abcam公司;辣根过氧化物酶标记的羊抗兔购自美国Santa公司。恒温培养箱购自美国Shellab公司;全自动酶标仪(MODEL550)购自美国Bio-Rad公司;流式细胞仪(BD FACSCantoⅡ)购自美国BD公司。
1.2 细胞培养 取PDLCs细胞,加入含10%胎牛血清、1%青霉素—链霉素的DMEM培养基,置于37℃、5%CO2恒温培养箱中培养。每1~2 d换液1次,待细胞生长至85%左右融合时传代,传代3次后,选择生长良好的对数生长期细胞进行后续实验。
1.3 AGEs最佳作用浓度与作用时间的筛选 取对数生长期细胞,加入培养液稀释为1×105/mL,以100µL/孔接种于96孔板。将细胞分为4组,分别加入0、100、200、300µg/mL的AGEs,放入培养箱常规培养。于培养24、48、72 h时采用CCK-8法检测细胞增殖情况,结果显示,48 h和72 h时,300µg/mL AGEs处理的细胞OD值较0µg/mL AGEs处理的细胞降低50%以上,故以300µg/mL和48 h作为AGEs最佳作用浓度和作用时间。
1.4 细胞分组与处理 取对数生长期细胞,加入培养液稀释为1×105/mL,以100µL/孔接种于96孔板。将细胞分为对照组、AGEs组及2、4、8 mmol/L二甲双胍组,对照组仅加入培养基,AGEs组加入终浓度为300µg/mL的AGEs,2、4、8 mmol/L二甲双胍组加入终浓度为300µg/mL的AGEs及终浓度分别为2、4、8 mmol/L的二甲双胍,培养48 h。
1.5 细胞增殖观察 采用CCK-8法。收集各组细胞,加入20µL CCK-8试剂,避光条件下孵育2 h;加入200µL DMSO,避光条件下震荡10 min。使用全自动酶标仪检测波长450 nm处的光密度(OD)值。
1.6 细胞凋亡观察 采用流式细胞术。收集各组细胞,加入0.25%胰蛋白酶消化,制成细胞密度为1×106/mL的细胞悬液。取200µL细胞悬浮液,按照AnnexinⅤ-FITC/PI凋亡检测试剂盒说明书,依次加入5µL AnnexinⅤ-FITC溶液、10µL PI染液混匀,避光条件下孵育1 h,使用流式细胞仪检测细胞凋亡情况,以早期凋亡细胞与晚期凋亡细胞占总细胞量的比例表示凋亡率。
1.7 细胞中SOD、MDA水平检测 采用ELISA法。收集各组细胞,加入细胞裂解液充分裂解,分别按照SOD、MDA试剂盒说明书步骤,使用全自动酶标仪测定450 nm、532 nm波长处的OD值,计算SOD活性和MDA含量。
1.8 细胞上清液中IL-6、TNF-α水平检测 采用ELISA法。收集各组细胞,离心取上清液,按照ELISA试剂盒说明书步骤,使用全自动酶标仪测定450 nm波长处的OD值,根据标准液OD值结果计算IL-6、TNF-α水平。
1.9 细胞p38 MAPK/NF-κB通路相关蛋白表达检测 采用Western blotting法。细胞培养48 h后,收集细胞,提取细胞总蛋白,Bradford法测定蛋白浓度。取总蛋白50µg与蛋白上样缓冲液混合,煮沸5 min,经10%聚丙烯酰胺凝胶电泳分离,转移至PVDF膜上,用含5%脱脂奶粉的TBST缓冲液封闭1 h。洗膜,分别加入p-p38 MAPK抗体、p38 MAPK抗体、NF-κB p65抗体和GAPDH抗体(稀释比例1∶500)4℃孵育过夜;洗膜,加辣根过氧化物酶标记的羊抗兔第二抗体(稀释比例1∶2 000),室温孵育1 h。免疫反应化学发光法显色、曝光、显影、定影、晾干,对条带进行灰度扫描。以NF-κB p65与内参GAPDH灰度值的比值表示NF-κB蛋白的相对表达量,以p-p38 MAPK与p38 MAPK灰度值的比值表示p38 MAPK的活化程度。
1.10 统计学方法 采用SPSS24.0统计软件。符合正态分布的计量资料以±s表示,多组间比较进行单因素方差分析,两两比较进行SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞增殖情况比较 对照组、AGEs组以及2、4、8 mmol/L二甲双胍组的OD值分别为0.59±0.06、0.24±0.03、0.33±0.03、0.40±0.03、0.49±0.05。与对照组相比,AGEs组OD值降低(P<0.05);与AGEs组相比,2、4、8 mmol/L二甲双胍组OD值升高(P均<0.05),其中8 mmol/L组高于2、4 mmol/L组,4 mmol/L组高于2 mmol/L组(P均<0.05)。
2.2 各组细胞凋亡情况比较 对照组、AGEs组以及2、4、8 mmol/L二甲双胍组的细胞凋亡率分别为8.02%±1.11%、47.46%±3.86%、35.88%±3.97%、28.93%±3.72%、15.24%±1.69%。与对照组相比,AGEs组细胞凋亡率升高(P<0.05);与AGEs组相比,2、4、8 mmol/L二甲双胍组细胞凋亡率降低(P均<0.05),其中8 mmol/L组低于2、4 mmol/L组,4 mmol/L组低于2 mmol/L组(P均<0.05)。
2.3 各组细胞中SOD、MDA水平比较 与对照组相比,AGEs组细胞中SOD活性降低,MDA水平升高(P均<0.05);与AGEs组相比,2、4、8 mmol/L二甲双胍组细胞中SOD水平升高,MDA水平降低(P均<0.05),其中8 mmol/L组SOD高于、MDA低于2、4 mmol/L组,4 mmol/L组SOD高于、MDA低于2 mmol/L组(P均<0.05)。见表1。
2.4 各组细胞上清液中IL-6、TNF-α水平比较 与对照组相比,AGEs组细胞上清液中IL-6、TNF-α水平升高(P均<0.05);与AGEs组相比,2、4、8 mmol/L二甲双胍组细胞上清液中IL-6、TNF-α水平降低(P均<0.05),其中8 mmol/L组低于2、4 mmol/L组,4 mmol/L组低于2 mmol/L组(P均<0.05)。见表2。
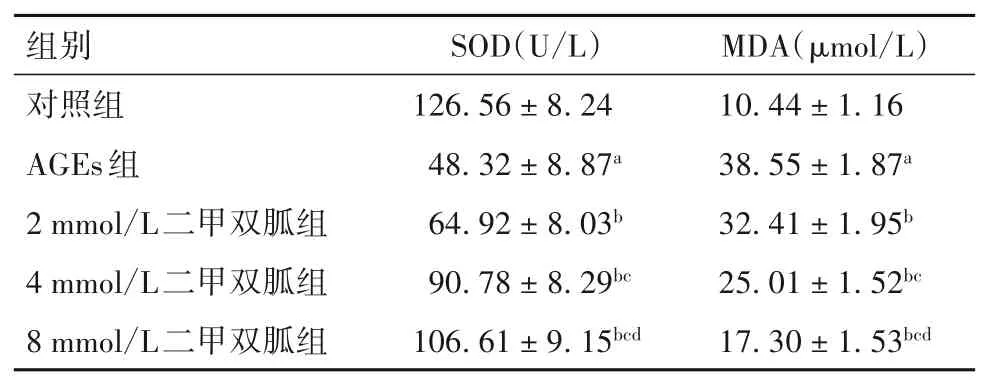
表1 各组细胞中SOD、MDA表达水平比较(xˉ±s)

表2 各组细胞上清液中IL-6、TNF-α水平比较(pg/mL,xˉ±s)
2.5 各组细胞中p-p38 MAPK、NF-κB p65蛋白表达比较 与对照组相比,AGEs组细胞中p-p38 MAPK、NF-κB p65蛋白表达均升高(P均<0.05);与AGEs组相比,2、4、8 mmol/L二甲双胍组细胞中p-p38 MAPK、NF-κB p65蛋白表达均降低(P均<0.05);其中8 mmol/L组低于2、4 mmol/L组,4 mmol/L组低于2 mmol/L组(P均<0.05)。见表3。
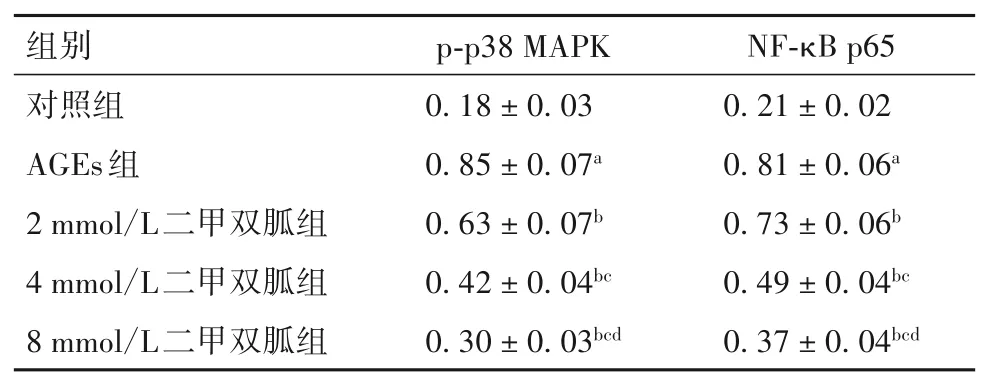
表3 各组细胞中p-p38 MAPK、NF-κB p65蛋白相对表达量比较(xˉ±s)
3 讨论
AGEs是葡萄糖等还原糖的醛基与蛋白质、核酸、脂质等大分子物质的氨基基团经过一系列复杂反应,在非酶促条件下形成的稳定共价加成物,能与其相应受体RAGEs相互作用或直接修饰蛋白质、核酸、脂质等诱发氧化应激反应,进而引起机体各类细胞的炎症等反应[9-10]。PDLCs是牙周结缔组织的主要细胞成分,能够合成并分泌多种细胞因子,在牙周组织的形成和再生、牙周组织的改建、牙周膜组织的完整性维持中发挥关键作用[11]。本研究结果显示,在不同浓度AGEs的作用下,PDLCs细胞增殖能力均显著降低,细胞凋亡率显著升高,表明AGEs可影响PDLCs细胞的增殖和凋亡过程。
二甲双胍是一线口服降糖药,能有效降低血糖,且不良反应小。近年研究表明,二甲双胍还具有抗氧化、抗衰老、抗肿瘤等生物学特性[12]。ZHOU等[13]报道,二甲双胍可以有效治疗糖尿病牙周炎小鼠的牙周感染和组织破坏,并降低血糖及血清IL-1β水平。本研究结果显示,与AGEs组相比,不同浓度二甲双胍组细胞增殖能力均显著升高,细胞凋亡率显著降低;且二甲双胍越高,其促进细胞增殖,降低细胞凋亡的效果越明显。这表明二甲双胍对AGEs诱导的PDLCs细胞凋亡具有抑制作用,同时促进其增殖再生。
SOD、MDA分别为氧化应激反应中的抗氧化应激标志物及氧化应激标志物。改善机体氧化应激水平是治疗糖尿病牙周炎的的重要作用机制[14]。ARAÚJO等[15]报道,50 mg/kg二甲双胍可以减轻结扎诱导的牙周炎大鼠的炎症反应、氧化应激和骨质流失。金领微等[16]报道,二甲双胍能通过调节氧化应激、自噬及内质网应激反应减轻肾缺血再灌注损伤。本研究结果显示,加入二甲双胍干预后,PDLCs细胞中SOD水平升高、MDA水平降低,提示二甲双胍可通过上调SOD水平、下调MDA水平,抑制AGEs在PDLCs细胞中引起的氧化应激反应。
IL-6、TNF-α均为重要的炎症因子,在慢性炎症状态下大量产生,促使炎症状态不断延长,加重对牙周组织的破坏[17]。研究显示,炎症反应与氧化应激同为糖尿病牙周炎的重要发病机制[14]。QU等[18]报道,二甲双胍可抑制脂多糖诱导的血管平滑肌细胞的炎症反应。本研究结果显示,PDLCs细胞加入AGEs后,细胞上清液中IL-6、TNF-α水平显著升高,提示AGEs可诱导炎症因子IL-6、TNF-α大量释放。给予二甲双胍干预后,PDLCs细胞上清液中IL-6、TNF-α水平均降低,提示二甲双胍可抑制AGEs引起的炎症反应。
NF-κB是重要的转录因子,在不同类型细胞中存在,能控制多种基因的表达。正常情况下,NF-κB处于非活化状态,以功能性亚基p65和抑制性亚基IκBα结合的复合物形式存在于细胞质中,应激反应条件下,IκBα被降解,p65被释放并转移至细胞核中,直接与DNA结合引起基因转录调控[6,19]。p38 MAPK是NF-κB的上游激酶,属于应激性蛋白激酶,在炎症因子、氧化应激等作用下激活,由细胞质进入细胞核中进一步诱导NF-κB活化,最终导致细胞产生大量炎症因子[20-21]。本研究结果显示,加入AGEs后,PDLCs细胞p-p38 MAPK、NF-κB p65蛋白表达明显升高,提示AGEs可激活p38 MAPK/NF-κB通路可能进一步导致炎症因子IL-6、TNF-α大量释放[22]。给予二甲双胍干预后,PDLCs细胞中p-p38 MAPK/p38 MAPK、NF-κB p65蛋白表达降低,提示二甲双胍可降低p38 MAPK磷酸化及NF-κB活化水平,可能通过降低AGEs引起的氧化应激反应,抑制p38 MAPK/NF-κB通路激活,减轻炎症反应程度[23]。
综上所述,二甲双胍可降低AGEs诱导的PDLCs细胞中的氧化应激反应,并通过抑制p38 MAPK/NF-κB通路活性降低炎症反应程度,从而抑制细胞凋亡并促进细胞增殖,可能为二甲双胍治疗糖尿病牙周炎提供实验依据。
