重楼皂苷Ⅶ下调S100A8抑制肺癌转移前微环境形成①
2021-05-26罗斌姚望阙祖俊于盼罗添乐田建辉
罗斌 姚望 阙祖俊 于盼 罗添乐 田建辉
(上海中医药大学附属龙华医院肿瘤科,上海 200032)
癌症是全球非传染性疾病的第2大死亡疾病,其中肺癌死亡人数占据第1位[1]。美国肺癌年死亡约13.6万,中国肺癌年死亡人数约63万,其中约90%与转移相关[2‐3]。因此,研发治疗转移的新药具有重要的临床价值。转移前微环境(pre‐metastatic niche,PMN)是肺癌转移的关键步骤,揭示PMN形成的分子机制,将有助于阐明转移发生的机制,发现新的干预靶点[4]。免疫抑制是PMN的首要特征,研究证实髓源性抑制细胞(myeloid‐derived suppres-sor cells,MDSCs)介导的免疫抑制在PMN形成过程中发挥重要作用[5‐6]。MDSCs通过分泌精氨酸酶‐1(arginase1,Arg‐1)、吲哚胺2,3‐双加氧酶(indole-amine 2,3‐dioxygenase,IDO)、活性氧簇(reactive ox-ygen species,ROS)等介导免疫抑制,诱导肺脏区域免疫紊乱。本课题组前期研究也证实MDSCs在非小细胞肺癌(non‐small cell lung cancer,NSCLC)患者的外周血中高表达,并与NSCLC的临床分期相关,同时研究发现肺积方(生黄芪、北沙参、石见穿、重楼等)具有下调肿瘤微环境中IDO表达,改善局部免疫抑制的作用[7‐8]。为了深入探索MDSCs介导的区域免疫抑制在诱导PMN形成过程中的作用机制,以及中医药对PMN的调节作用,本实验从MD-SCs介导的肺脏区域免疫紊乱促进PMN形成的角度,揭示中药重楼的有效单体重楼皂苷Ⅶ干预PMN形成的机制,以初步探索恶性肿瘤转移的局部“正虚”科学内涵。
1 材料与方法
1.1 材料小鼠2LL‐GFP/Luc细胞购自中国生命科学院上海细胞库;5~6周龄的C57BL/6小鼠购自上海斯莱克实验动物有限责任公司,在上海中医药大学动物实验中心饲养;DMEM培养基、胎牛血清、青霉素‐链霉素双抗购自美国Gibco公司;重楼皂苷Ⅶ购自四川省维克奇生物科技有限公司(货号:C11007228);紫杉醇购自海口市制药厂有限公司(国 药 准 字H10980170);CD11b(APC)/Ly‐6G(FITC)/Ly‐6C(PE)流式抗体购自达科为生物技术股份有限公司;免疫组化抗体IDO/Arg‐1/ROS/S100A8/S100A9购自CST公司;免疫组化试剂盒购自福建迈新生物科技有限公司;全自动多色分析流式细胞仪系统(FACSVerse)及红细胞裂解液购自美国BD公司;荧光倒置显微镜(DMI3000B)购自德国莱卡公司;小动物活体成像仪(LB983 NC320)购自德国Berthold Technologies GmbH&Co.KG公司。
1.2 方法
1.2.1 造模及干预方法将悬浮于含10%胎牛血清的DMEM培养基中的小鼠2LL‐GFP/Luc细胞放在37℃、湿度40%、5%CO2的条件下培养,待细胞达到对数期时,采用细胞计数仪进行计数,然后消化备用。将实验用C57BL/6小鼠(体重20±2 g)按体重随机分组的方法分为生理盐水对照组(NS)、重楼皂苷Ⅶ组(PP7)、紫杉醇组(PTX)、重楼皂苷Ⅶ+紫杉醇联合组(PP7+PTX),每组8只;在超净台中,在小鼠右侧腋下(去毛备皮)注射准备好的细胞悬液(2×105个/只),建立小鼠皮下移植瘤模型。完成建模后第1天,按照计算用量及组别,分别给予紫杉醇[15 mg/(kg·d),每隔3 d给药1次,腹腔注射]和重楼皂苷Ⅶ[10 mg/(kg·d),给药方式同紫杉醇]。
从造模第一天开始每3 d做1次小鼠活体成像实验,检测小鼠成瘤情况及肺脏转移情况,并记录皮下瘤长宽径,待第18天采用麻醉后先采静脉血,后颈椎脱臼法处死小鼠,取瘤体称重并留取检测样本。
1.2.2 流式细胞术检测方法取100µl静脉血样本置于标记好的流式上样管,加入5 µl的Fc阻断剂,避光室温孵育5 min;在上样管中分别加入抗体CD11b(APC)/Ly‐6G(FITC)/Ly‐6C(PE)各5 µl,避光孵育15 min;每个上样管中加入红细胞裂解液3 ml,避光孵育6~8 min,至澄清时离心(1 500 r/min,5 min);弃上清,重复上述离心步骤2次,弃上清,加入生理盐水300µl,在混悬仪器上混匀,上机检测。
1.2.3 免疫组化检测方法将组织石蜡包埋切片;烤片:将切好的切片置于70℃烤箱内烤片2 h;脱蜡水化:按照顺序依次以二甲苯10 min×3次、无水乙醇10 min、95%乙醇10 min、85%乙醇10 min、75%乙醇10 min,后自来水冲洗5 min;抗原修复:配置EDTA抗原修复溶液5 ml,微波中火加热至沸腾约需210 s,然后将病理切片缓慢放入沸腾的修复液内,微波修复20 min,自然冷却,PBS冲洗3 min×3;封闭内源性过氧化物酶:滴加H2O2溶液(试剂A),室温孵育10 min,PBS冲洗3 min×3;抗原封闭:滴加动物非免疫动物血清(试剂B),室温下孵育10 min;结合抗体:除去多余血清,每张切片加抗体1滴(1∶200),4℃过夜,PBS冲洗3 min×3。滴加生物素标记的第二抗体(试剂C),室温孵育10 min,PBS冲洗3 min×3。滴加链霉素抗生物蛋白(试剂D),室温孵育10 min,PBS冲洗3 min×3。配备DAB溶液2 ml(A 2 ml、B 2滴、C 2滴),每张切片加100 µl新鲜配制的DAB溶液,肉眼观察直至变黄,约3~5 min。自来水冲洗2 min,苏木素衬染3 min,自来水冲洗5 min,PBS返蓝2 min。透明,烘干,中性树胶封片,镜下扫描读片,并采用Image J软件对扫描的结果进行定量分析。
1.3 统计学方法采用Graphpad Prism 8.0软件对数据进行统计分析,多组间比较采用单因素方差分析,以P<0.05表示具有统计学意义。
2 结果
2.1 重楼皂苷Ⅶ抑制模型皮下肿瘤增殖采用活体成像技术检测小鼠肺脏转移灶形成情况(图1),采用HE染色检测留取的小鼠肺脏组织样本,发现PP7组的1只小鼠肺脏出现明显的转移灶(图2E),同时,结果显示瘤体积在对照组与PP7+PTX组之间具有显著性差异(图2C)。与对照组相比,瘤重在PP7组、PP7+PTX组之间具有显著性差异,紫杉醇组无显著性差异(图2B),各组之间的小鼠体重之间无显著性差异(图2D)。
2.2 外周血MDSC的表达比例本实验以流式细胞术检测皮下瘤移植模型小鼠外周血中的MDSCs的比例,以CD11b、Ly‐6G、Ly‐6C为标志,结果发现各组的外周血中M‐MDSCs与PMN‐MDSCs无统计学意义(图3)。
2.3 肺脏微环境中MDSCs发挥免疫抑制因子检测为了进一步证实MDSCs发挥免疫抑制促进局部免疫环境紊乱,检测了MDSCs发挥免疫抑制作用的蛋白IDO、ROS、Arg‐1在肺脏组织的表达情况。结果发现,与对照组比较,联合组的Arg‐1表达水平明显下调,而IDO的表达水平,各组均下调;与紫杉醇组比较,联合组及PP7组未见明显差异;ROS在各组之间无显著性差异(图4)。
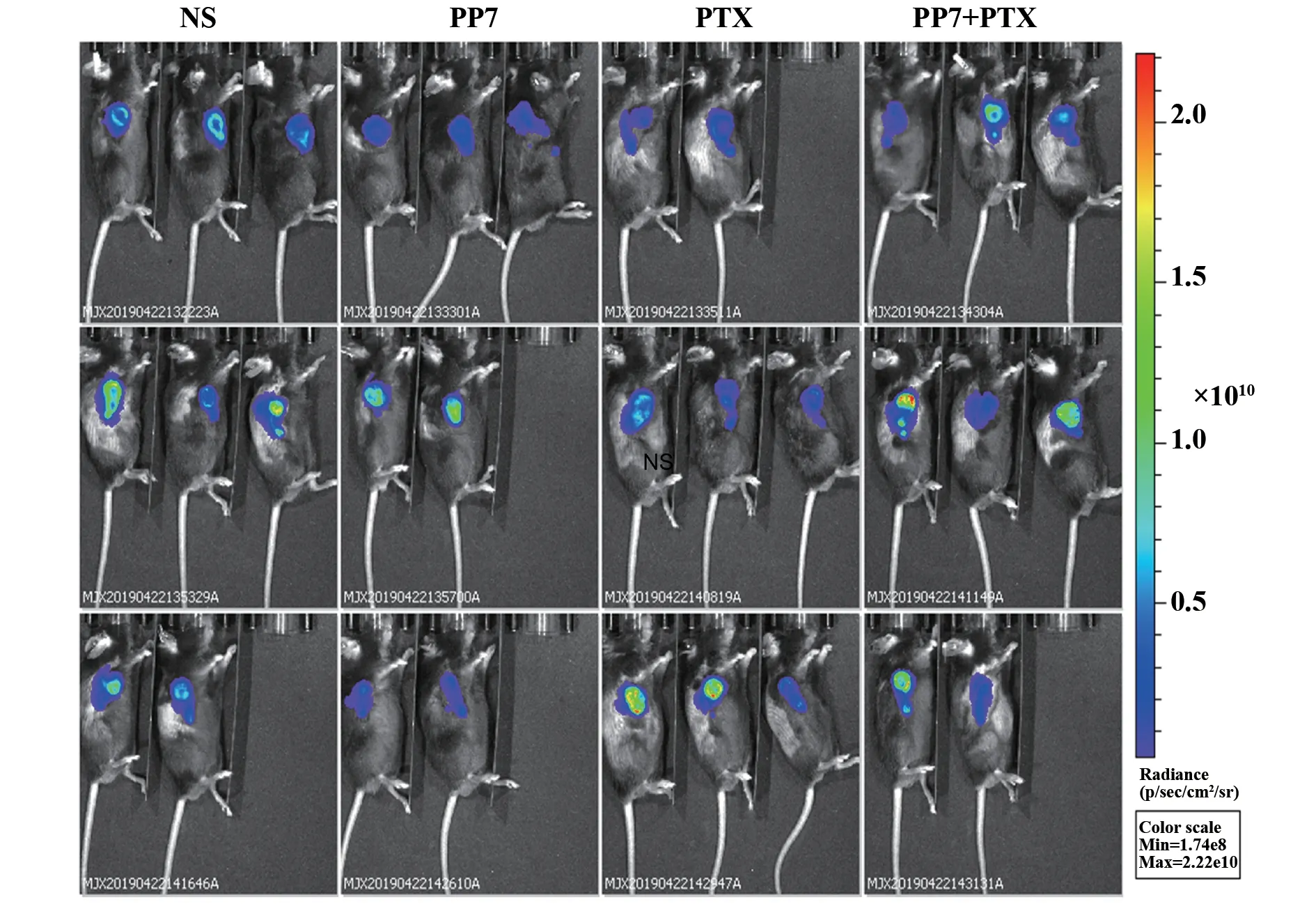
图1 造模后第12天的小鼠活体成像检测Fig.1 In vivo imaging of mice on the 12th day after mod-eling
2.4 MDSCs诱导肺脏局部免疫紊乱促进转移前微环境形成采用免疫组化检测了肺脏中S100A8/S1000A9蛋白的表达,结果发现,与对照组比较,紫杉醇、PP7及联合组均可以下调S100A8的表达,而各组之间S100A9表达水平无统计学意义(图5)。

图2 重楼皂苷Ⅶ抑制皮下肿瘤增殖Fig.2 PolyphyllinⅦinhibits subcutaneous tumor prolif-eration

图3 流式细胞术检测各组模型外周血中MDSC不同亚群的比例Fig.3 Flow cytometry was used to detect the proportion of MDSC subgroups in peripheral blood of each group
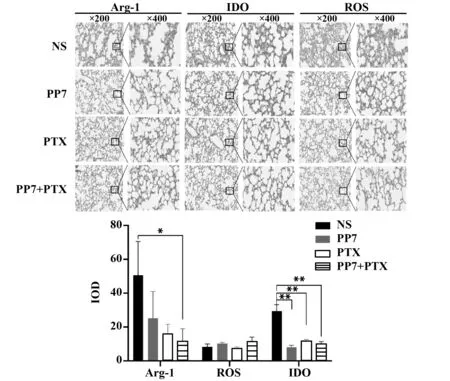
图4 各组小鼠肺脏中MDSCs分泌的免疫抑制蛋白表达水平Fig.4 Expressions level of immunosuppressive protein se-creted by MDSCs in lung of each group
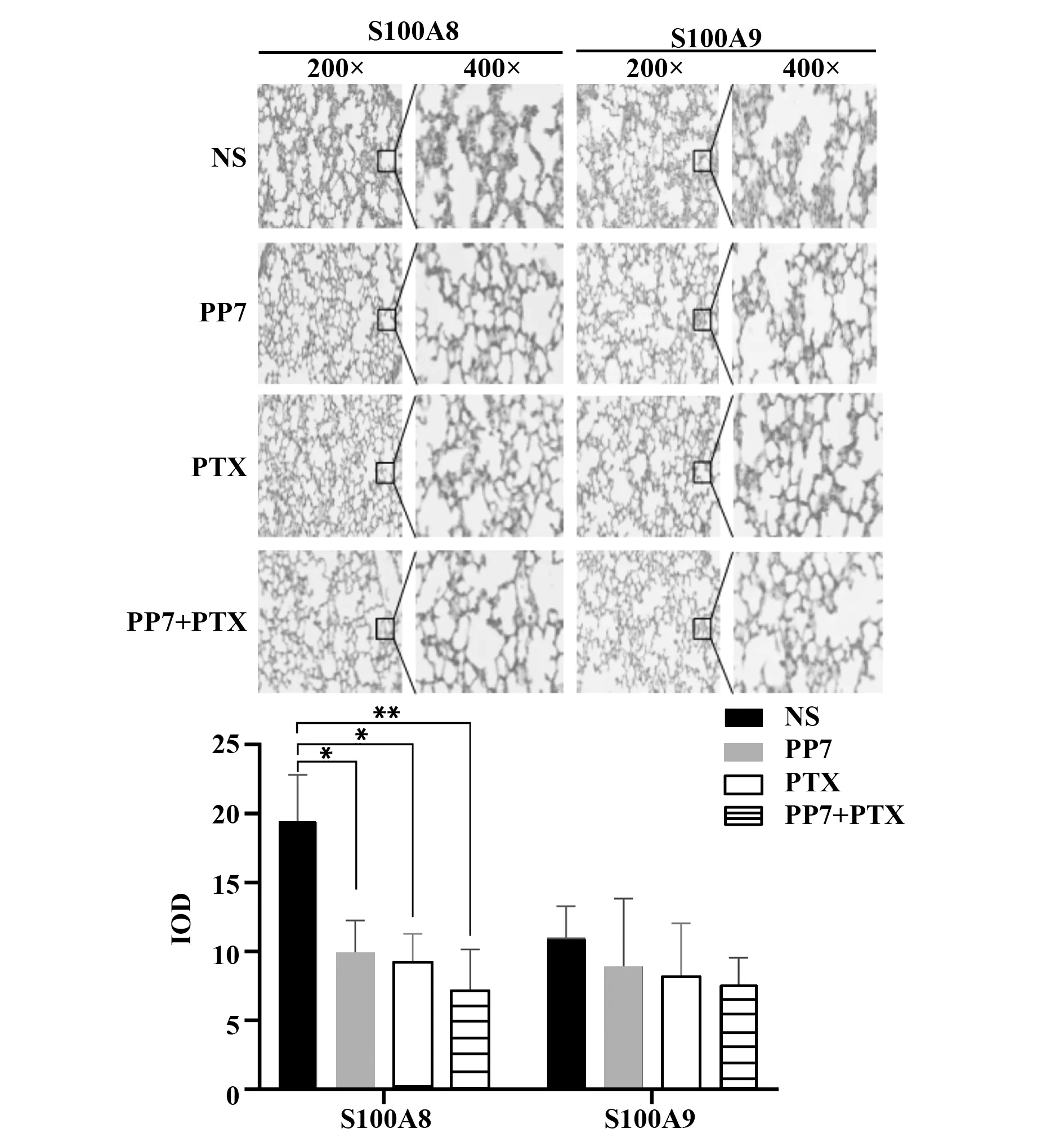
图5 肺脏组织S100A8/S1000A9表达与PMN形成Fig.5 Expressions of S100A8/9 and PMN formation in lung tissue
3 讨论
转移是恶性肿瘤患者死亡的主要原因,有研究显示NSCLC转移的主要部位发生率是大脑(12%~47%)、骨(16%~39%)、肝脏(7%~22%)、肺内(对侧或同侧肺叶,11%~26%)、胸膜(10%~13%)、胸腔淋巴结(29%)和肾上腺(6%~15%)[8]。而转移发生的主要步骤是原发灶的免疫逃逸、外周循环生存、靶器官的定植与增殖,针对原发灶的肿瘤微环境,目前免疫治疗制剂已经进入临床应用,而外周血中主要是循环肿瘤细胞(circulating tumor cells,CTC),但是由于外周血成分复杂而且CTC缺乏明确的生物学标记,因此靶向外周的治疗手段存在较大的技术瓶颈[9‐10]。所以,阻止转移靶器官环境形成是预防转移发生的一个重要策略,本研究发现重楼的有效单体重楼皂苷Ⅶ通过下调皮下移植瘤模型肺脏S100A8表达抑制PMN形成预防肺转移,其机制可能是干预MDSCs的免疫抑制作用,初步揭示了扶正中药预防肺癌细胞转移的可能机制,为中医药临床应用提供依据。
PMN的形成是肺癌细胞转移的必要环节,研究发现PMN的主要特征是免疫抑制[11]。在PMN形成过程中,肿瘤原发灶分泌的外泌体(含蛋白、RNA、DNA等)、调节性T细胞、免疫细胞因子、血管内皮生长因子、MDSCs等均发挥了重要作用[5,12‐14]。而MD-SCs作为PMN形成过程中的重要因素近年来备受学者关注[15]。MDSCs是一群具有免疫抑制作用的骨髓来源异常分化细胞,主要分为2个亚群:单核系MDSC(M‐MDSCs)和 多 核 系MDSCs(PMN‐MD-SCs)[16]。研究发现临床中肺癌患者外周血中的MD-SCs表达比例与其临床分期具有密切相关性[6]。而Lewis肺癌细胞培养上清具有激活MDSCs糖酵解途径,促进其抑制T细胞的功能,MDSCs以IDO、ROS、Arg‐1、S100A8/9等 多 途径 介导 机 体免 疫紊乱 是PMN形成 的重 要因 素[17,11]。肺 脏 组织 中S100A8/S1000A9/MMP9/Fn/Bv8的表达变化是PMN形成的重要指标[11,18]。而S100A8/S1000A9是MDSC分泌的免疫炎性蛋白,是促进肺脏局部免疫紊乱的重要因素[19‐20]。本研究发现外周循环MDSCs的不同亚群比例在各组之间无差异,但肺脏中MDSCs发挥免疫抑制作用的IDO、Arg‐1在对照组与各组之间存在差异,其原因可能是干预手段对外周循环的MDSCs无显著影响,但是对肺脏MDSCs的招募及免疫抑制功能的活化可能发挥作用。另外,有研究发现S100A8/9在调节髓系细胞免疫功能方面发挥重要作用[21]。而LIU等[22]亦发现在肺癌PMN形成过程中S100A8/9、MMP9等过表达。吕彦天等[23]发现S100A8蛋白在NSCLC组织中明显高于癌旁组织,随病理分期增高及肿瘤分化程度降低,S100A8蛋白表达阳性率增高,而且研究证实MDSCs分泌S100A8/9发挥免疫抑制作用,同时S100A8高表达对MDSCs局部累积有募集作用[6,24]。因此S100A8在肿瘤模型的肺脏组织中高表达可能促进MDSCs的招募并活化MDSCs的免疫抑制作用,促进有利于CTC定植的肺脏PMN形成,形成临床微转移。本研究发现重楼皂苷Ⅶ具有下调S100A8作用,故初步揭示了中医药干预PMN形成预防转移的分子机制是下调肺脏S100A8水平,但是具体机制仍待进一步研究。有研究发现S100A8可激活MAPK途径和NF‐κB信号通路促进肿瘤细胞的增殖[6]。因此课题组未来将从抑制PMN形成与肿瘤细胞增殖角度出发,深入研究中医药干预S100A8表达预防转移的分子机制。
转移是恶性肿瘤治疗失败的主要原因,而目前尚无具有明确疗效的针对转移预防的药物,其原因主要是以下3点:一是转移具体机制尚未阐明,缺乏成熟的理论指导;二是目前肿瘤转移防治药物的开发多以原发灶肿瘤细胞为基础,而建立有效的具有转移潜能的细胞系可能是重要方向;三是对转移发生靶器官的认识不足,尤其是肿瘤细胞是如何选择生存的靶器官。在“扶正治癌”学术思想指导下,田建辉结合中医学、肿瘤学、免疫学等学科交叉的国内外研究进展,提出肺癌转移的“正虚伏毒”核心病机,认为“伏毒”是以CTC、肿瘤干细胞、休眠肿瘤细胞等为代表的潜伏因素,而“正虚”则是以免疫衰老、免疫逃逸、神经‐内分泌‐免疫紊乱等为代表[24‐25]。课题组已率先建立了人肺腺癌CTC系(CTC‐TJH‐01),构建了转移研究的药物筛选平台,基于CTC‐TJH‐01建立的转移研究平台,课题组初步揭示了扶正中药的防治转移的机制[26]。PMN的形成是脏腑局部免疫抑制导致的“正气亏虚”,既往研究显示重楼皂苷Ⅶ主要是抑制肿瘤细胞的增殖、促进其凋亡等[27]。本研究发现重楼皂苷Ⅶ能抑制PMN形成,提示其可能具有“扶正”的作用,这初步证实中药多组分、多途径、多靶点作用机制在临床中的不同价值,将为未来筛选转移防治药物提供新思路。
PMN作为CTC进入靶器官定植的关键条件,为其生存、增殖提供了有利环境。肺癌术后患者在临床中缺乏明确的症状或体征,尤其是早期患者(Ⅰa期)西医认为属于治愈,术后不需要任何的干预,仅定期随访即可。PMN的形成是靶器官局部的微观变化,现代医学缺乏有效手段以直接观察,因此易被忽视。中医古籍《黄帝内经》曰“邪之所凑,其气必虚”,因此术后靶器官的PMN形成可能是脏腑局部“正虚”的表现,局部的“正气亏虚”形成适宜“伏毒(循环肿瘤细胞等)”生存的环境,随着正气的进一步亏耗,最终形成微转移。中医学历来重视“治未病”的思想,而干预PMN形成阻止CTC的定植,可能是扶正中药预防恶性肿瘤转移的关键途径,本研究对中药单体在抑制PMN形成的作用进行了探索,这可能为未来研究中医药预防转移的临床应用提供新的策略。